DERLEME
Tuberk Toraks 2021;69(2):253-260
Astım ve nazal polipozis:
Biyolojik tedaviler etkili mi?
Sevgi ÇOLAK1 , Mustafa ÇOLAK2 , Dilşad MUNGAN1
1Ankara Üniversitesi Tıp Fakültesi, İmmünoloji ve Alerji Hastalıkları Bilim Dalı, Ankara, Türkiye
1Division of Immunology and Allergic Diseases, Ankara University Faculty of Medicine, Ankara, Turkey
2Ankara Şehir Hastanesi, Kulak Burun Boğaz Kliniği, Ankara, Türkiye
2Clinic of Otolaryngology, Ankara City Hospital, Ankara, Turkey
Makale atıfı: Çolak S, Çolak M, Mungan D. Astım ve nazal polipozis: Biyolojik tedaviler etkili mi? Tuberk Toraks 2021;69(2):253-260.
ÖZ
Astım ve nazal polipozis: Biyolojik tedaviler etkili mi?
Ağır astım hastalığına nazal polipli kronik rinosinüzit sıklıkla eşlik etmektedir. Kontrolsüz nazal polip varlığı, tek başına hayat kalitesini bozmakla kalmayıp, eşlik eden astım hastalığının kontrolünü de zorlaştırmaktadır. Tip 2 inflamasyonun hakim olduğu eozinofilik kronik sinüzit, fenotipik olarak nazal poliple kendini göstermektedir. Son yıllarda astım hastalığında olduğu gibi kronik sinüzit hastalarında da fenotip ve endotipe yönelik yaklaşımlar gelişmekte olup; uygun endotipe sahip kontrolsüz hastalarda biyolojik tedaviler gündeme gelmektedir. Bu hastalarda Ig-E, IL-5 ve IL-4a yolaklarını antagonize eden tedaviler ile ilgili son yıllarda yapılan randomize kontrollü çalışmalar yüz güldürücüdür. Yakın gelecekte nazal polip hastalarının yönetiminde klinik pratiğe daha çok dahil olacağını düşündüğümüz biyolojik tedavilerin etkinlikleri, gerçek yaşam verilerinin literatürde artmasıyla netlik kazanacaktır.
Anahtar kelimeler: Ağır astım; nazal polip; tip 2 inflamasyon; biyolojik tedaviler
ABSTRACT
Asthma and nasal polyposis: Are biological treatments effective?
Chronic rhinosinusitis with nasal polyps often accompanies severe asthma. Uncontrolled nasal polyp does not only impair the quality of life, but also makes it difficult to control the accompanying asthma. Eosinophilic chronic sinusitis dominated by type 2 inflammation is phenotypically manifested by nasal polyps. In recent years, approaches towards phenotype and endotype have developed in patients with chronic sinusitis as well as in asthma; biological treatments come into question in uncontrolled patients with appropriate endotype. Randomized controlled trials conducted on treatments that antagonize the Ig-E, IL-5, and IL-4a pathways in these patients are promising. The effectiveness of biological treatments, which we think will be more involved in clinical practice in the management of nasal polyp patients in the near future, will become clear with the increase in real life data in the literature.
Key words: Severe asthma; nasal polyp; type 2 inflammation; biological treatments
Geliş Tarihi/ Received: 24.03.2021 - Kabul Ediliş Tarihi/ Accepted: 12.04.2021
GİRİŞ
Nazal polipli kronik rinosinüzit (npKRS) astım hastalığına en sık eşlik eden komorbiditelerden biridir. Patolojik üst ve/veya alt solunum yolları, hastalık semptomlarını çift yönlü olarak arttır ve kontrolsüz npKRS ağır astım hastalığında tedavi başarısızlığının önemli nedenlerindendir (1). Bu derlemede, astım ve npKRS ilişkisinin değerlendirilmesi ve npKRS tedavisinde gelecek vadeden biyolojik tedavilerin ortaya konması amaçlanmıştır.
Tanımlamalar
Ağır astım hastalığı: Astım kronik hava yolu inflamasyonu ile karakterize heterojen bir hastalıktır. Hastalardaki hava yolu kısıtlılığı değişkendir; nefes darlığı, öksürük ve göğüste sıkışıklık hissi semptomlarının varlığı, sıklığı ve yoğunluğu aynı hastada zaman içinde farklılık gösterir. Ağır astım ise yüksek doz standart tedaviye ve modifiye edilebilir faktörlerin düzeltilmesine rağmen kontrol altına alınamamış veya ancak yüksek doz tedavi ile kontrolü sürdürülebilen astım hastalığını tanımlar. Yanlış tanı, yanlış inhaler tekniği, tedaviye uyumsuzluk, sigara kullanımı, tetikleyicilerle temasın sürmesi ya da eşlik eden komorbiditelerin tedavi edilmemiş olması gibi modifiye edilebilir faktörlerin varlığı ağır astım tanısından önce gözden geçirilmelidir ((2),(3)).
Kronik rinosinüzit (KRS): KRS sinonazal kavitelerin kronik inflamasyonudur. 12 haftadan uzun süreyle hastada en az biri burun/geniz akıntısı ya da burun tıkanıklığı olmak üzere- burun/geniz akıntısı, burun tıkanıklığı, yüz/baş ağrısı ve koku kaybı semptomlarından 2 veya daha fazlasının bulunması olarak tanımlanır (4).
KRS klasifikasyonu: Temel olarak nazal polipli ve nazal polipsiz kronik rinosinüzit olarak yapılan sınıflamaya son yıllarda endotip ve fenotipe dayandırılarak yapılan bir alternatif önerilmiştir. Nazal mukozanın patolojisine bağlı olarak gelişen primer KRS ve sistemik hastalığa (vaskülit ya da immün yetmezlik gibi) bağlı olarak gelişen sekonder KRS şeklinde ikiye ayrılır. Tutulumun genişliğine göre ise lokalize ve diffüz hastalık olarak sınıflandırılır. Primer KRS endotipik olarak tip 2 inflamasyonun söz konusu olup olmamasına bağlı olarak değerlendirilir ((4),(5)). Bu derlemenin konusu olan npKRS; primer, diffüz ve tip 2 inflamasyon sonucu gelişen KRS fenotipidir.
Nazal polipli kronik rinosinüzit (npKRS): Bilateral orta mea veya sinüslerde nazal poliplerin endoskopik veya radyolojik olarak gözlenmesi ile tanı koyulur. Altta yatan patolojik mekanizmayı vurgulayan eozinofilik KRS (eKRS) tabiri de npKRS için kullanılabilmektedir (4).
Ağır KRS: KRS’de hastalık ağırlığı vizüel analog skoru (VAS) ile ifade edilir. VAS hem ayrı ayrı semptomların ağırlığını hem de total hastalık ağırlığını değerlendirmede kullanılabilir. VAS’ın 0-3 arası olması hafif hastalığı; 3-7 arası olması orta; 7 ve üzerinde olması ise ağır KRS’yi tanımlar (4).
KRS hastalık kontrolü: Son yıllarda KRS takibinde hastalık kontrolünün değerlendirilmesi önem kazanmıştır. Kontrol parametrelerinin klinik araştırmalarda kullanımı da son kılavuzlarda teşvik edilmektedir. Burun tıkanıklığı, burun/geniz akıntısı, yüzde ağrı/basınç hissi, koku kaybı ve uyku bozukluğu/bitkinlik semptomlarının olmadığı ya da rahatsız edici boyutta olmadığı; son 6 ay için KRS için kurtarıcı tedavi (antibiyotik ya da sistemik steroid) ihtiyacı olmayan; nazal endoskopi de (mevcut ise) sağlıklı ya da hemen hemen sağlıklı bir mukozaya sahip bir kişide KRS kontrol altındadır. Yukarıda sayılan faktörlerden en az biri mevcut ise kısmi kontrollü KRS; 3 veya daha fazlası mevcut ise kontrolsüz KRS söz konusudur. Klinik araştırmalar için bir semptomun anlamlı olması için VAS’da 5’in üzerinde puan verilmiş olması gerekmektedir (4) (Tablo 1).
Epidemiyoloji
Prevelans çalışmalarında kullanılan değişik yöntemler farklı sonuçlara neden olabilmektedir. Bununla beraber tüm dünyada yetişkinlerde astım prevelansı %4,2; Türkiye’de ise 2,06 olarak tahmin edilmiştir (6). Ülkemizde yapılan çeşitli çalışmalarda erişkinlerde astım oranı %1,2-9,4 olarak bulunmuştur (7). KRS için klinik tanım kullanılarak yapılan anket çalışmalarında prevelans %10,9 olarak bildirilmiştir (8). Nazal endoskopi veya BT dahil edilerek yapılan toplum temelli farklı epidemiyolojik çalışmalarda ise prevelans %1,2 ve %6,8 olarak saptanmıştır ((9),(10)). Yapılan bir çalışmada npKRS’nin erişkinlerde prevelansı %2,7 olarak saptanmış; yaşla prevelansının arttığı, aynı zamanda erkeklerde iki kat daha sık görüldüğü bildirilmiştir (11). Nazal polipsiz KRS prevelansı ise farklı bir çalışmada %3,5 olarak bildirilmiş olup 40 yaş altında prevelansı daha yüksek bulunmuştur (11). Sinüs cerrahisi sıklığının daha yüksek olduğu non-steroid antiinflamatuar ilaçlar ile alevlenen hava yolu hastalığında (NERD) ise hava yollarındaki eozinofilik inflamasyon kendini çoğunlukla npKRS olarak gösterir. NpKRS hastalarında NERD prevelansı %16 olarak bildirilmiştir (12).
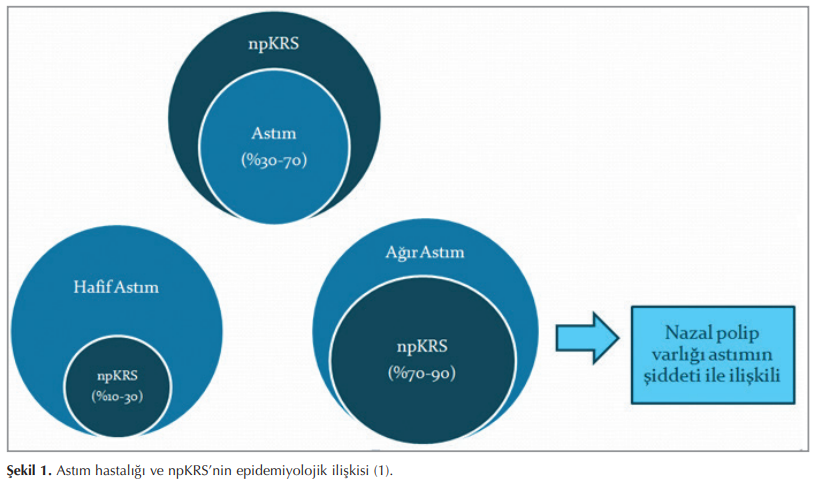
Genel toplumda astım hastalığı prevelansı %5 iken KRS hastalarında %25 olarak bildirilmiştir (13). Başka bir çalışmada astım hastalığı; kontrol grubunda %9,9; nazal polipsiz KRS hastalarında %21,2; npKRS hastalarında %44,9 olarak saptanmıştır (14). NpKRS’li hastaların %30-70’ine astım hastalığının eşlik ettiği düşünülmektedir. Astım hastalığına npKRS’nin ne derece eşlik ettiği ise astım hastalığının şiddeti ile ilişkilidir. Hafif astımda npKRS %10-30 oranında görülürken, ağır astımda bu oran %70-90’dır (15) (Şekil 1).
Patofizyoloji
Astım hastalığında demografik, klinik ve patofizyolojik özelliklere göre birçok fenotip tanımlanmıştır. Fenotip, hastalığın gözlenebilir özelliklerini, endotip ise bu özelliklere neden olan biyolojik mekanizmaları ve inflamasyonun moleküler özelliklerini tanımlar. Bu sınıflama kişiye özgü tedavi yaklaşımlarına olanak sağlaması nedeniyle, özellikle ağır astım yönetiminde önem kazanmaktadır (7).
Astımın en iyi bilinen endotipi Th2 sitokinlerin varlığı ile karakterize Tip 2 astımdır. Tip 2 (eozinofilik) astım allerjik ve non-allerjik karakterde olabilir. Allerjik eozinofilik inflamasyonda; allerjene spesifik IgE’nin neden olduğu mast hücre degranülasyonu; non-allerjik eozinofilik inflamasyonda ise hasarlı epitel hücrelerinden salınan IL-33 ve Timik Stromal Lenfopoietin (TSLP)’nin tip 2 doğal lenfosit hücreleri (ILC2) aktive etmesi inflamasyonu başlatır. IL-5 doku eozinofilisinden, IL-13 ise goblet hücrelerinden mukus yapımı ve hava yolu aşırı duyarlılığından sorumludur. Tip 2 olmayan (non-eozinofilik) inflamasyonun ise doğal immün yanıtta disregülasyon ve IL-17 bağımlı yolakların aktivasyonu sonucu geliştiği düşünülmektedir (7). Ancak Tip 2 olmayan endotiple ilgili bilgilerimiz henüz Tip 2 kadar belirli değildir.
Son yıllarda KRS yönetiminde de endotiplerin ortaya koyulması önem kazanmıştır. Th1 hücreler ve IFN-’nın ana rolü oynadığı Tip 1 KRS; Th2 hücreler ve IL-4-5-13’ün ana rol oynadığı Tip 2 KRS ve Th17 ve IL-17’nin ana rol oynadığı Tip 3 KRS inflamatuar mekanizmalar olarak önerilmekle beraber; sonuçta ortaya çıkan doku inflamasyonunun çoklu endotipleri içerebileceği düşünülmektedir. Astım birlikteliği ve konvansiyonel tedavilere direnç ile ilişkili Tip 2 KRS’deki doku inflamasyonu fibrin depolanması ve polip oluşumu ile sonuçlanır (4).
Tip 2 KRS, KRS'nin en kapsamlı olarak çalışılan endotipidir ve moleküler mekanizmaların çoğu protein düzeyinde doğrulanmıştır. NpKRS hastalarında, bozulmuş epitelyal bariyerden salgılanan TSLP, IL-25 ve IL-33’ün ILC2’leri aktive etmesi IL-13 ve IL-5 artışına neden olur. IL-5 eozinofiliye; IL-13 ise mukus üretiminde artış, bazofili ve doku plazminojen aktivatörü (t-PA) inhibisyonuna neden olur. T-PA inhibisyonu, poliplerin doku matrisini oluşturan bir fibrin ağının birikmesine yol açar (4). Tip 2 KRS’de önerilen farklı bir başlatıcı faktör ise hasarlı epitelde daha sık kolonize olan Staphylococcus Aerius’un bir süperantijen gibi davranarak Th2’yi aktive etmesidir. Th2’lerin oligoklonal artışı, B hücrelerinden zengin germinal merkez benzeri özellikler gösteren lenfoid agregatlar oluşumuna ve lokal IgE üretimine yol açar. Nazal polip hastalarında atopiden bağımsız olarak saptanan bu poliklonal IgE artışının da kronik inflamasyonda etkili olduğu düşünülmektedir ((16),(17)).
Bir komorbidite, mekanizma olarak astım şiddetini çeşitli yollarla etkileyebilir: bir astım fenotipinin gelişmesine veya bu fenotipin evrimine neden olarak; aynı patofizyolojik sürecin bir parçası olarak (ortak hava yolu hipotezinde olduğu gibi); tanıda veya kontrol değerlendirmesinde karıştırıcı faktör halinde ya da astımın klinik bulgularını, tedavinin etkinliğini ve tedaviye uyumu etkileyerek (1). NpKRS eşlik etmesi, yukarıda sayılan 4 mekanizmanın hepsiyle astım şiddetini arttırabilir. NERD başlı başına bir astım fenotipi olarak bu başlık altındaki en ağır polip kliniğine neden olur. Bu durumda tekrarlayan cerrahi tedavilere refrakter olabilen polip varlığı, astım kontrolünü de zorlaştırmaktadır. Bu yönden düşünülünce üst ve alt solunum yollarının ortak patogenetik mekanizmasına etki edebilen biyolojik tedaviler, hastalık yönetiminde yeni bir yol açmaktadır.
Tedavi
Astım hastalığı farmakolojik tedavisinde kullanılan inhale kortikosteroidler (IKS), inhale kortikosteroid ve uzun etkili beta2-agonist sabit kombinasyonları (IKS+LABA) ve antilökotrien ilaçlar antiinflamatuar etkileriyle hastalığı kontrol altında tutarlar. Kısa etkili inhale beta2 agonistler (SABA), kısa etkili inhale antikolinerjikler, sistemik steroid, kısa etkili teofilin ve magnezyum sülfat semptom giderici ilaçlardır. Bunların yanında ağır astım hastalarında uzun etkili inhale antikolinerjikler, yavaş salınımlı teofilin, uzun süreli düşük doz oral steroid tedavisi ve biyolojik ajanlar kullanılabilir (7).
Ağır astım fenotipinin belirlenmesi için kan eozinofil düzeyi, fraksiyone ekshale nitrik oksit (FeNO) ölçümü, balgam eozinofilisi, atopik durum ve idame oral kortikosteroid ihtiyacı olup olmadığı değerlendirilerek Tip 2 inflamasyon varlığı araştırılır. Tip 2 inflamasyon belirteçleri saptanan hastada spesifik yaklaşımlar açısından NERD, allerjik bronkopulmoner aspergillozis (APBA), KRS ve atopik dermatit eşlik edip etmediği değerlendirilmelidir. Hali hazırda onaylanmış biyolojik tedavi seçenekleri arasında omalizumab (anti-IgE), mepolizumab (anti-IL5), benralizumab (anti-IL5 reseptör a), reslizumab (anti-IL5) ve dupilumab (anti-IL4 reseptör a) mevcut olup, tedaviye yanıtın öngörülmesini sağlayacak faktörler değerlendirilerek uygun ajan seçilmelidir (2) (Tablo 2). Dört aylık tedavi sonrasında hasta atak sayısı, semptom kontrolü, solunum fonksiyon testleri, oral steroid ihtiyacındaki azalma gibi faktörler ile değerlendirilir. İyi yanıt durumunda tedaviye devam edilir. Yanıt belirsiz ise 6-12 aya kadar tedavi uzatılıp yeniden değerlendirilir. Yanıtsız hastada ise mevcut tedavi kesilerek mümkünse farklı bir biyolojik tedaviye geçilebilir (2).
Diffüz bilateral KRS’de intranazal kortikosteroidler ve serum fizyolojik ile irrigasyon tedavinin temelini oluşturur. Sistemik kortikosteroid kullanımı hastanın semptomatolojisine göre gündeme gelebilir. Kılavuzlar alevlenmeler dışında antibiyotik kulanımını önermemektedir. Bu tedaviler ile yanıt alınamayan hastalarda fenotiplendirmeye yönelik bilgisayarlı tomografi (BT), nazal endoskopi, kan eozinofil düzeyinin tayini gibi ileri tetkikler yapılmalı; astımın eşlik edip etmediği, hastanın atopik durumu, NSAİİ duyarlılığı sorgulanmalıdır. Tip 2 endotipe sahip hastalarda, endoskopide nazal polipler ve eozinofilik müsin gözlenir. Konvansiyonel tedavilere yanıtsız hastalarda fonksiyonel endoskopik sinüs cerrahisi (FESS) yapılabilir(4). Cerrahi tedavinin amacı fizyolojik sinüs ventilasyonu ve drenajını yeniden sağlamaktır. Cerrahi tedavi altta yatan enflamatuar bozukluğu doğrudan tedavi etmediğinden, sinüs cerrahisi sonrası idame antiinflamatuar tedavi şarttır, aksi takdirde semptomlar her zaman geri dönecektir. Bu özellikle cerrahi polipektomi için geçerlidir. Polipler genellikle medikal tedavi olmaksızın birkaç yıl içinde yeniden birikir (18).
Astımı olan veya olmayan npKRS hastalarının tedavisinde biyolojik tedavi alternatifleri için öneriler geliştirmek amacıyla, Avrupa Alerji ve Hava Yolu Hastalıklarında Araştırma ve Eğitim Forumu (EUFOREA) 2019 yılında bir konsensus yayınlamıştır. Hastada tip 2 inflamasyonun biyokimyasal kanıtlarının bulunması, sistemik steroid ihtiyacı olması, hayat kalitesinde ciddi azalma, koku kaybı ve eşlik eden astım hastalığı olması şeklinde sıralanan 5 kriterden 3’ünün mevcut olması; daha önce FESS geçiren npKRS hastalarında biyolojik tedavi endikasyonunu belirler( Şekil 2). Daha önce cerrahi tedavi geçirmeyen hastalarda ise 5 kriterden 4’ü gereklidir. Biyolojik tedavi başlanan hastalarda 16 hafta sonra yanıt değerlendirmesi yapılarak tedavinin devamına karar verilir. NpKRS’de konvansiyonel tedaviler altında kontrolsüz hastalık yükü fazla olmakla beraber biyolojik tedavilerin yüksek maliyeti hasta seçiminde dikkatli olunmasını gerektirmektedir (15).
NpKRS Tedavisinde Biyolojik Ajanlar
Anti-IgE: Uzun yıllardır özellikle alerjik astım tedavisinde kullanılan omalizumabın, npKRS hastalarında nazal mukozada saptanan lokal artmış poliklonal IgE’yi antagonize ederek etki ettiği düşünülmektedir. Dokudaki lokal IgE artışı, hastalığın ciddiyeti ve cerrahi sonrası polip nüksünün hızı ile koreledir (19). Omalizumabın KRS hastaları üzerindeki etkisini araştıran ilk randomize kontrollü çalışma 2010 yılında Pinto ve arkadaşları tarafından yapılmıştır. Bu çalışmada 12’si nazal polipli 14 KRS hastası 6 ay süreyle omalizumab ve plasebo kollarına randomize edilmiş, ancak çalışmanın primer sonlanım noktası olan Lund-MacKey skorunda (nazal polip BT skoru) anlamlı iyileşme saptanmamıştır (20). 2013 yılında, 24 npKRS hastası dahil edilerek yapılan Geavert ve arkadaşlarının çalışmasında ise 16 hafta sonrasında çalışma kolunun nazal polip skorunda (NPS) anlamlı azalma (-2,67 p= 0,001) saptanmıştır. 2020 yılında yayınlanan POLYP1 ve POLYP2 çalışmalarına sırasıyla 138 ve 127 hasta dahil edilmiş, 24 hafta sonunda primer sonlanım noktaları olan nazal polip ve nazal konjesyon skorlarında anlamlı azalma saptanmıştır (NPS için POLYP1’de -1,14 p< 0,001 POLYP2’de -0,59 p= 0,014). Her 2 çalışmada da total nazal semptom skoru, koku kaybı ve SNOT-22 (Sinonasal outcome test-22)’de de anlamlı iyileşme izlenmiştir (21). Aralık 2020’de npKRS tedavisinde Amerikan Gıda ve İlaç Dairesi (FDA) onayı alan omalizumabın nazal polip tedavisinde ne derece yer edeceği, daha fazla hasta ile yapılacak yeni çalışmalarla belirlenecektir.
Anti IL-5/IL-5Ra: Serbest IL-5’i bağlayarak, IL-5’in eozinofilleri arttırıcı etkisini baskılayan mepolizumab, günümüze kadar 2 randomize kontrollü çalışma ile npKRS tedavisinde araştırılmıştır. Bunlarla beraber 2 faz-3 çalışmanın sonuçları beklenmektedir. Yayınlanan çalışmalardan ilki 2011 yılında Geavert ve arkadaşları tarafından 30 npKRS hastası ile yapılmıştır. Tedavi koluna 28 gün arayla 750 mg iv mepolizumab 2 doz verilmiş, 8. haftada NPS’de plaseboya göre -1,5’lik (p= 0,028) azalma saptanmıştır. Çalışmanın izleminde olfaktör fonksiyonlardaki düzelme tedavi kesilmesinden 9 ay sonrasına kadar korunmuştur. Diğer semptom skorlarında da düzelme kaydedilmekle beraber istatiksel anlamlı bulunmamıştır (2). Farklı bir çalışma ise 2017 yılında Bachert ve arkadaşları tarafından, özgeçmişinde en az 1 sinüs cerrahisi olan 105 ağır npKRS hastası ile yapılmış, farklı olarak primer sonlanım noktası “cerrahi tedavi gereksinimi kalmayan hasta sayısı” olarak tasarlanmıştır. Tedavi koluna 6 ay süreyle 4 haftada bir iv 750 mg mepolizumab uygulanmış, 25 haftalık izlem sonunda artık cerrahi tedavi gereksinimi kalmayan hasta sayısı plasebo koluna göre anlamlı olarak farklı saptanmıştır (Tedavi kolunda 16, plasebo kolunda 5, p= 0,006). NPS, VAS ve Snot-22’de de anlamlı düzelme görülmüştür (23). Bu çalışma mepolizumabın ağır npKRS hastalarında cerrahi tedavi ihtiyacını azalttığına dair kanıt oluşturmaktadır. Ağır eozinofilik astım hastalarında mepolizumab etkinliğinin değerlendirildiği bir çalışmada ise, npKRS’li alt grupta mepolizumab plaseboya göre Snot-22’yi anlamlı olarak azaltmıştır ((19),(24)). Gelecekteki yeni çalışmalar mepolizumabın npKRS tedavisindeki etkinliğinin ortaya koyacaktır.
Anti IL-5 humanize monoklonal antikoru reslizumab’ın 2006 yılında 24 npKRS hastası ile yapılan randomize kontrollü çalışmasında, hastalar 1 veya 3 mg/kg reslizumab tek doz ve plasebo kollarına ayrılmış; 36 haftalık izlem sonucunda semptom skorlarında anlamlı azalma olmazken; NPS 1 mg/kg grubunda sadece 12. haftada anlamlı düşük saptanmıştır (25). Eozinofilik astım hastalarında reslizumab’ın etkisini inceleyen farklı çalışmalarda da npKRS’li alt grupta reslizumab’ın yaşam kalites-ini olumlu etkilediği gösterilmiştir ((26),(27)). Halihazırda, sinonazal etkileriyle ilgili olarak bu ajanla ilgili başka hiçbir çalışma bildirilmemiştir, ancak etkinlik npKRS’de IL-5'in yüksek ekspresyonuna ve diğer anti IL-5 ajanlarının etkinliğine dayanılarak tahmin edilebilir (19).
IL-5 reseptör ablokörü benralizumab’ın devam eden 2 adet faz-3 çalışmasının sonuçları, bu ajanın da npKRS tedavisinde yer edinip edinemeyeceğini belirleyecektir (OSTRO ve ORCHID çalışmaları) ((28),(29)).
Anti IL-4Ra: Tip 2 inflamasyonun ana sitokinlerinden IL-4 ve IL-13 yolağını bloke eden dupilumab, npKRS tedavisinde ilk FDA onayını alan ajandır. 2016 yılında Bachert ve arkadaşları tarafından yapılan çalışmada, 60 npKRS hastası, dupilumab (600 mg yükleme dozu, 300 mg subkutan haftalık) ve plasebo kollarına randomize edilmiş; 16. haftada NPS plaseboya göre -1,6 puan azalmıştır (p< 0,001) (30). 2019 yılında yine Bachert ve arkadaşları tarafından yapılan LIBERTY SINUS-24 ve LIBERTY SINUS-52 çalışmaları etkinliğine kanıt oluşturan en geniş kapsamlı 2 randomize kontrollü çalışmadır. SINUS-24 çalışmasında 276 npKRS hastası 2 haftada bir 300 mg dupilumab ve plasebo kollarına randomize edilmiş; 24 hafta sonunda NPS’de -2,06’lık (p< 0,001) azalma saptanmıştır. 448 hastanın 52 hafta boyunca 2 haftada bir 300 mg dupilumab, 24 hafta 2 haftada bir 300 mg geri kalan 28 hafta 4 haftada bir 300 mg dupilumab ve plasebo olmak üzere 3 kola randomize edildiği SINUS-52 çalışmasında ise 24. haftada NPS’de -1,80’lik (p< 0,001); 52. Haftada ise -2,4’lük (p< 0,001) azalma saptanmıştır. 24. haftada dupilumab kesilen kolda, 52. haftaya kadar NPS’deki azalmanın tedrici olarak eski haline döndüğü; 24 hafta sonrasında 4 haftada bir devam edilen kolda ise NPS’deki azalma halinin, 52 hafta boyunca 2 haftada bir 300 mg alan gruba benzer şekilde devam ettiği gözlenmiştir. Çalışmada nazal konjesyon, nazal obstrüksiyon ve semptom skorlarında da plaseboya göre anlamlı düzelme saptanmıştır (31). Bu sonuçlar dahilinde nazal polip tedavisi için umut vadedici görünen dupilumab, uzun vadede gerçek yaşam verileri ile tedavi şemasındaki yerini kazanacaktır.
Sonuç
NpKRS özellikle ağır astıma sıklıkla eşlik etmesi ve hastalık şiddeti ile ilişkili olması nedeniyle alerji pratiğinde önemli bir yer tutmaktadır. Sağlıklı üst solunum yolları havayı filtreleyip nemlendirerek alt solunum yollarının iyiliğine katkı sağlarken; patolojik üst ve/ve ya alt solunum yolları, epiteldeki ortak disfonksiyon ve nöral interaksiyonları nedeniyle iki yönlü olarak olumsuz etki etmektedir. Bu nedenle bu antitelere ayrı ayrı patolojiler gibi eğilmek yerine global hava yolu hastalığı konseptine uygun olarak bütüncül bir yaklaşım sergilenmelidir. Farklı fenotip ve endotipe sahip hastalar, ilgili bölüm uzmanları tarafından işbirliği içerisinde ele alınmalı, refrakter hastalar 3. basamak merkezlerde ileri tedaviler için değerlendirilmelidir. NpKRS hastaları ile yapılan randomize kontrollü çalışmaların sonuçları değerlendirildiğinde, astımın eşlik ettiği ya da etmediği refrakter npKRS hastalığının yönetiminde, biyolojik tedavilerin önümüzdeki günlerde daha da önem kazanacağı aşikar görünmektedir.
KAYNAKLAR
- Boulet LP. Influence of comorbid conditions on asthma. Vol. 33, European Respiratory Journal. 2009. p. 897-906.
- Global Initiative for asthma (GINA). Diagnosis and Management of Difficult-to-treat and Severe Asthma Guide. Available from: https://ginasthma.org/severeasthma/ https://ginasthma.org/difficult-to-treat-and-severe-asthma-guide. 23 March 2021.
- Global Initiative for asthma (GINA). 2020 GINA Report, Global strategy for asthma management and prevention. Available from: https://ginasthma.org/gina-reports/. 23 March 2021.
- Fokkens WJ, Lund VJ, Hopkins C, Hellings PW, Kern R, Reitsma S, et al. Epos 2020. Off J Eur Int Rhinol Soc Confed Eur ORL-HNS. 2020;Suppl 29:1-464.
- Grayson JW, Hopkins C, Mori E, Senior B, Harvey RJ. Contemporary Classification of Chronic Rhinosinusitis Beyond Polyps vs No Polyps A Review. 2020;1:1-8.
- To T, Stanojevic S, Moores G, Gershon AS, Bateman ED, Cruz AA, et al. Global asthma prevalence in adults: Findings from the cross-sectional world health survey. Vol. 12, BMC Public Health. BioMed Central; 2012. p. 204.
- Türkiye Ulusal Allerji ve Klinik İmmünoloji Derneği. Astım Tanı ve Tedavi Rehberi 2020 Güncellemesi. Available from: https://www.aid.org.tr/wp-content/uploads/2020/12/astim-rehberi-2020.pdf.23 March 2021
- Pleis JR, Lucas JW, Ward BW. Summary health statistics for U.S. adults: National Health Interview Survey, 2008. Vital Heal Stat Ser 10 Data from Natl Heal Surv. 2009;10(242):1-15.
- Kim JH, Cho C, Lee EJ, Suh YS, Choi BI, Kim KS. Prevalence and risk factors of chronic rhinosinusitis in South Korea according to diagnostic criteria. Rhinol J. 2016 Dec 1;54(4):329-35.
- Tomassen P, Newson RB, Hoffmans R, Lötvall J, Cardell LO, Gunnbjörnsdóttir M, et al. Reliability of EP3OS symptom criteria and nasal endoscopy in the assessment of chronic rhinosinusitis - A GA2LEN study. Allergy Eur J Allergy Clin Immunol. 2011 Apr;66(4):556-61.
- Won HK, Kim YC, Kang MG, Park HK, Lee SE, Kim MH, et al. Age-related prevalence of chronic rhinosinusitis and nasal polyps and their relationships with asthma onset. Ann Allergy, Asthma Immunol. 2018 Apr 1;120(4):389-94.
- Stevens WW, Peters AT, Hirsch AG, Nordberg CM, Schwartz BS, Mercer DG, et al. Clinical Characteristics of Patients with Chronic Rhinosinusitis with Nasal Polyps, Asthma, and Aspirin-Exacerbated Respiratory Disease. J Allergy Clin Immunol Pract. 2017 Jul 1;5(4):1061-1070.e3.
- Seybt MW, McMains KC, Kountakis SE. The prevalence and effect of asthma on adults with chronic rhinosinusitis. Ear, Nose Throat J. 2007 Jul 1;86(7):409-11.
- Philpott CM, Erskine S, Hopkins C, Kumar N, Anari S, Kara N, et al. Prevalence of asthma, aspirin sensitivity and allergy in chronic rhinosinusitis: Data from the UK National Chronic Rhinosinusitis Epidemiology Study. Respir Res. 2018 Jun 27;19(1).
- Fokkens WJ, Lund V, Bachert C, Mullol J, Bjermer L, Bousquet J, et al. EUFOREA consensus on biologics for CRSwNP with or without asthma. Allergy. 2019 Dec 15;74(12):2312-9.
- Abdurrahman G, Schmiedeke F, Bachert C, Bröker BM, Holtfreter S. Allergy—A New Role for T Cell Superantigens of Staphylococcus aureus? Toxins (Basel). 2020;12(3):1-21.
- Schryver E De, Devuyst L, Derycke L, Dullaers M, Zele T Van, Bachert C, et al. De Schryver-2015-Local immunoglobulin e in the. 2015;7(4):321-31.
- Gosepath J, Pogodsky T, Mann WJ. Characteristics of recurrent chronic rhinosinusitis after previous surgical therapy. Acta Otolaryngol. 2008;128(7):778-84.
- Eschenbacher W, Straesser M, Knoeddler A, Li R chi, Borish L. Biologics for the Treatment of Allergic Rhinitis, Chronic Rhinosinusitis, and Nasal Polyposis. Immunol Allergy Clin North Am. 2020;40(4):539-47.
- Pinto JM, Mehta N, DiTineo M, Wang J, Baroody FM, Naclerio RM. A randomized, double-blind, placebo-controlled trial of anti-IgE for chronic rhinosinusitis. Rhinol J. 2010 Sep 1;48(3):318-24.
- Gevaert P, Omachi TA, Corren J, Mullol J, Han J, Lee SE, et al. Efficacy and safety of omalizumab in nasal polyposis: 2 randomized phase 3 trials. J Allergy Clin Immunol. 2020 Sep 1;146(3):595-605.
- Gevaert P, Bruaene N Van, Cattaert T, Steen K Van. Mepolizumab , a humanized anti - IL-5 mAb , as a treatment option for severe nasal polyposis. J Allergy Clin Immunol. 128(5):989-995.e8.
- Bachert C, Sousa AR, Lund VJ, Scadding GK, Gevaert P, Gilbert J, et al. Reduced need for surgery in severe nasal polyposis with mepolizumab : Randomized trial. J Allergy Clin Immunol. 140(4):1024-1031.e14.
- Chupp GL, Bradford ES, Albers FC, Bratton DJ, Wang-Jairaj J, Nelsen LM, et al. Efficacy of mepolizumab add-on therapy on health-related quality of life and markers of asthma control in severe eosinophilic asthma (MUSCA): a randomised, double-blind, placebo-controlled, parallel-group, multicentre, phase 3b trial. Lancet Respir Med. 2017 May 1;5(5):390-400.
- Gevaert P, Lang-loidolt D, Lackner A, Bachert C. Nasal IL-5 levels determine the response to anti - IL-5 treatment in patients with nasal polyps. :1133-41.
- Castro M, Zangrilli J, Wechsler ME, Bateman ED, Brusselle GG, Bardin P, et al. Reslizumab for inadequately controlled asthma with elevated blood eosinophil counts: Results from two multicentre, parallel, double-blind, randomised, placebo-controlled, phase 3 trials. Lancet Respir Med. 2015 May 1;3(5):355-66.
- Jappe U, Beckert H, Bergmann K-C, Gülsen A, Klimek L, Philipp S, et al. Biologics for atopic diseases: Indication, side effect management, and new developments. Allergol Sel. 2021;5(01):1-25.
- U.S. National Library of Medicine ClinicalTrials.gov. Efficacy and safety study of benralizumab for patients with severe nasal polyps (OSTRO). Available from: https://clinicaltrials.gov/ct2/show/NCT03401229.23 March 2021.
- U.S. National Library of Medicine ClinicalTrials.gov. Efficacy and Safety Study of Benralizumab in Patient With Eosinophilic Chronic Rhinosinusitis With Nasal Polyps (ORCHID) Available from: https://clinicaltrials.gov/ct2/show/NCT04157335. 23 March 2021.
- Bachert C, Mannent L, Naclerio RM, Mullol J, Ferguson BJ, Gevaert P, et al. Effect of subcutaneous dupilumab on nasal polyp burden in patients with chronic sinusitis and nasal polyposis: A randomized clinical trial. JAMA - J Am Med Assoc. 2016 Feb 2;315(5):469-79.
- Bachert C, Han JK, Desrosiers M, Hellings PW, Amin N, Lee SE, et al. Efficacy and safety of dupilumab in patients with severe chronic rhinosinusitis with nasal polyps ( LIBERTY NP SINUS-24 and LIBERTY NP SINUS-52 ): results from two multicentre , randomised , double-blind , placebo-controlled , parallel-group phase 3 trials. Lancet 2019 Nov 2;394(10209):1638-1650.
Yazışma Adresi (Address for Correspondence)
Dr. Sevgi ÇOLAK
Ankara Üniversitesi Tıp Fakültesi,
İmmünoloji ve Alerji Hastalıkları Bilim Dalı,
ANKARA - TÜRKİYE
E-mail: drsevgicolak@gmail.com