REVIEW
Tuberk Toraks 2021;69(1):84-93
ABPA’lı hastalarda biyolojik tedaviler
Merve ERKOÇ , Ömür AYDIN , Sevim BAVBEK
Ankara Üniversitesi Tıp Fakültesi, Göğüs Hastalıkları Anabilim Dalı, İmmünoloji ve Alerji Bilim Dalı, Ankara, Türkiye
Division of İmmunology and Allergy, Department of Chest Diseases, Ankara University Faculty of Medicine, Ankara, Turkey
Makale atıfı: Erkoç M, Aydın Ö, Bavbek S. ABPA’lı hastalarda biyolojik tedaviler. Tuberk Toraks 2021;69(1):84-93.
ÖZ
ABPA’lı hastalarda biyolojik tedaviler
Alerjik Bronkopulmoner Aspergillozis (ABPA); Aspergillus fumigatus’a karşı Tip 1 aşırı duyarlılığın neden olduğu tekrarlayan pulmoner opasiteler ve bronşektazi ile karakterize bir akciğer hastalığıdır. Astım hastalığın önemli bir parçasıdır ve genelde ağır seyreder. Hastalığın patogenezinde A. fumigatus’a karşı immünoglobulinler, Th2 kaynaklı IL-4, IL-5 ve IL-13 gibi sitokinler ve eozinofilik inflamasyonun rol oynadığı düşünülmektedir. Patogenezde yer alan IL-4, IL-5, IL-13 ve IgE’yi hedef alan monoklonal antikorlar daha önce astımlı hastalarda kullanılmıştır. Alevlenmeler ve remisyonlarla seyreden ABPA’nın temel tedavisi oral kortikosteroidlerdir (OKS). Ancak kortikosteroid dozunun azaltılamadığı ya da yan etkisinin geliştiği durumlarda monoklonal antikorlar tedaviye eklenebilir. Buradan yola çıkarak tüm bu sitokin ve mediatörleri hedefleyen; omalizumab, mepolizumab, benralizumab ve dupilumab gibi monoklonal antikorlar ABPA’lı hastalarda uygulanmıştır. Omalizumab ile alevlenmelerde ve OKS gereksiniminde azalma, astım semptomlarında iyileşme ve solunum fonksiyon parametrelerinde düzelme gösterilmiştir. Mepolizumab ile OKS dozunda azalma, kan eozinofil sayısında azalma, klinik iyileşme ve radyolojik düzelme görülmüştür. Benralizumab ile eozinofil sayısında azalma hatta sıfırlanma, klinik ve radyolojik düzelme saptanmıştır. Dupilumab ile ise semptomlarda düzelme, OKS kesilmesi ancak tedavi başlangıcında eozinofil sayısında artış bildirilmiştir. Sonuç olarak ABPA’lı hastalarda monoklonal antikorlar genel olarak başarılı ve güvenli bulunmuştur.
Anahtar kelimeler: ABPA; astım; biyolojik; monoklonal antikor; omalizumab
ABSTRACT
Biological Treatments in patients with ABPA
Allergic Bronchopulmonary Aspergillosis (ABPA) is a pulmonary disease characterized by recurrent pulmonary opacities and bronchiectasis caused by Type 1 hypersensitivity to A. fumigatus. Asthma is an important part of the disease and is generally in severe form. It is thought that immunoglobulins against A. fumigatus, Th2-derived cytokines such as IL-4, IL-5 and IL-13 and eosinophilic inflammation play a role in the pathogenesis of the disease. Monoclonal antibody treatments targeting IL-4, IL-5, IL-13 and IgE, which are involved in pathogenesis, have been used in asthmatic patients before. The main treatment of ABPA for exacerbations and remissions is oral corticosteroids (OCS). However, in cases where the corticosteroid dose cannot be reduced or side effects develop, monoclonal agents may be added to the treatment. Monoclonal agents such as omalizumab, mepolizumab, benralizumab and dupilumab targeting cytokines involved to the patogenesis have been used in patients with ABPA. Omalizumab has shown a reduction in exacerbations and OCS requirements, improvement in asthma symptoms and improvement in pulmonary function parameters. With mepolizumab, a decrease in OCS dose, decrease in blood eosinophil count, clinical improvement and radiological improvement were observed. Benralizumab reduced, the number of eosinophil or even almost nullified as well as clinical recovery alongside with radiological improvement. With dupilumab, improvement in symptoms, discontinuation of OCS, but increase in eosinophil count at the beginning of treatment was reported. As a result, monoclonal antibodies were generally found to be successful and safe in patients with ABPA.
Key words: ABPA; asthma; biological; monoclonal antibody; omalizumab
Geliş Tarihi/ Received: 20.12.2020 - Kabul Ediliş Tarihi/ Accepted: 05.01.2021
GİRİŞ
Alerjik Bronkopulmoner Aspergillozis (ABPA) ilk olarak Hinson, Moon ve Plummer tarafından 1952 yılında tanımlanmıştır (1). Astımlı ve kistik fibrozisli hastalarda Aspergillus fumigatus’a (A. fumigatus) karşı Tip 1 aşırı duyarlılığın neden olduğu tekrarlayan pulmoner opasiteler ve bronşektazi ile karakterize edilen bir akciğer hastalığıdır (2). Astımı olan yetişkinlerin %2,5’inde ABPA geliştiği düşünülmektedir (3).
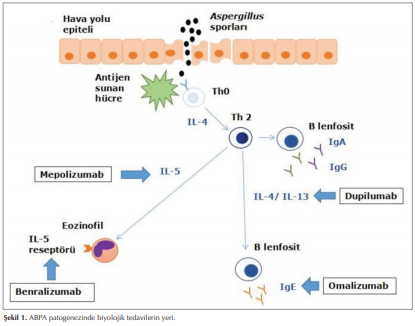
Alerjik Bronkopulmoner Aspergillozis’in patogenezi tam olarak anlaşılamamıştır. Hastalık gelişiminin iki yönü olduğu düşünülmektedir. Bunlardan ilki astım veya kistik fibroziste solunum yolu epitelindeki hasarlanma nedeni ile klirensin bozulması ve hava yollarında Aspergillus sporlarının kalıcılığının artması, ikincisi ise bu koşullarda Aspergillus’a karşı aşırı T-yardımcı 2 (Th2) yanıtı oluşmasıdır. ABPA’da klirensi bozularak antijenik hale gelen Aspergillus proteinleri özellikle HLA-DR2 veya HLA-DR5 taşıyan antijen sunan hücreler tarafından işlenir ve bronkoalveolar lenfoid doku içindeki T hücrelerine sunulur. Aspergillus’a karşı ortaya çıkan CD4+ T hücresi; interlökin (IL)-4, IL-5 ve IL-13 sitokinlerinin üretimi ile Th2 yanıta neden olur. Bu Th2 yanıt; mast hücre degranülasyonu, çok sayıda eozinofil ve nötrofil ile içeren yoğun bir inflamasyon ile karakterlidir. Ayrıca ABPA hastalarında T hücre yanıtı B hücre aktivasyonuna ve kanda Aspergillus’a karşı immünoglobulin (Ig) E, IgA ve IgG gelişimine neden olmaktadır ((2),(4)) Şekil 1.
Alerjik Bronkopulmoner Aspergillozis hastalarında 8 majör ve 3 minör kriterden oluşan Rosenberg-Patterson tanı kriterleri 1977 yılından itibaren kullanılmaya başlanmıştır (5). 2013 yılında ise International Society for Human and Animal Mycology-Allergic Bronchopulmonary Aspergillosis (ISHAM-ABPA) çalışma grubu tarafından önerilen yeni kriterler yayınlanmıştır (6).
Alerjik Bronkopulmoner Aspergillozis için geri dönüşümsüz hasar oluşmadan tanı koymayı amaçlayan asemptomatik evreden solunum yetmezliğinin, fibrozisin eşlik edebildiği ileri evreyi içeren 7 aşamadan oluşan evreleme önerilmiştir (6). ABPA’da tedavinin amacı inflamasyonu azaltmak ve hastalığın progresyonunu sınırlamaktır. Bu nedenle erken ve agresif tedavi önemlidir. Oral kortikosteroidler (OKS) bu amaçla uzun yıllardır ABPA’nın temel tedavisi olarak kullanılmaktadır ancak hastalık sık sık nüksetmekte ve OKS kesmek zor olmaktadır. Kortikosteroidlerin yan etkileri göz önünde bulundurulduğunda, tedaviyi en erken sürede azaltmak gerekmektedir. Hava yollarındaki mantar yükünü azaltan itrakonazol, vorikonazol veya nebülize amfoterisin gibi antifungal ajanların OKS’nin azaltılmasına katkıda bulunarak ve kortikosteroidlerin kesilmesinden sonra nüksü önleyerek tedavide yararlı olduğu düşünülmektedir (7). ABPA tedavisinde kortikosteroid temel tedavi olmakla birlikte kortikosteroidleri azaltamamak, ilaca bağlı yan etki görülmesi ya da hastanın OKS kullanmak istememesi ek tedavi seçeneklerinin aranmasına neden olmuştur. Çeşitli monoklonal antikorların (MoAb) astım hastalarında güvenli ve etkin kullanımı ABPA tanılı astım hastalarında da kullanılabileceği fikri oluşturmuş. Patogenezde yer alan sitokin ve mediatörleri hedefleyen MoAb’lar ABPA’lı hastalarda da denenmiştir. Yazımızın bundan sonraki bölümünde ABPA’lı hastalarda; omalizumab, mepolizumab, benralizumab ve dupilumab kullanımının sonuçları özetlenecektir.
Omalizumab
Omalizumab; serbest IgE’yi bağlayan rekombinant humanize, IgG1 tipi MoAb’dır. Bu bağlanma sonucu serumda serbest IgE azalır. Serbest IgE’nin azalması; mast hücre, bazofil, B lenfosit, dendritik hücreler gibi üzerinde IgE’nin yüksek afiniteli Fcepsilon(Ɛ)RI ve düşük afiniteli FcƐRIII reseptörlerinin azalması ile sonuçlanır (8). Omalizumab yüksek doz inhale kortikosteroid ve uzun etkili beta-2 agonist tedavisi ile kontrol edilemeyen ağır alerjik astımlı hastalarda kullanım onayı almıştır (9). Ülkemizde de bu endikasyonda en uzun süredir kullanımda olan biyolojik ajandır.
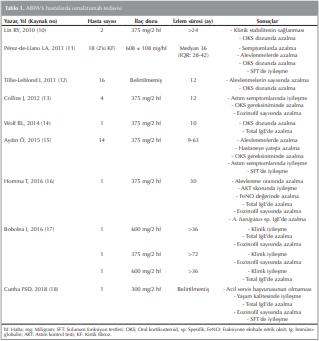
Alerjik Bronkopulmoner Aspergillozisli hastalarda da Tip 1 aşırı duyarlılık patogenezin önemli bir parçasıdır ve Aspergillus’a karşı aşırı IgE yapımı ile total IgE yüksekliği vardır. Bu nedenle de omalizumab etkili bir tedavi seçeneği olabilir. ABPA tanılı astımlı hastalarda literatürde İngilizce tam metnine ulaşılabilen ilk olgu raporu 2010’da yayınlanmıştır ve bunu daha sonraki yıllarda yapılan çalışmalar izlemiştir Tablo 1.
Omalizumab tedavisi sonrası ABPA’lı hastalarda OKS ihtiyacında azalma olmuştur ((10)-(15)). ABPA’lı hastalarada omalizumab tedavisi sonrası alevlenmelerde ve hastaneye yatışta azalma ile birlikte astım semptomlarında iyileşme bu sayede yaşam kalitesinin artma yapılan çalışmalarda gösterilmiştir ((13),(15)). Ayrıca ABPA’lı hastalarda omalizumab tadevisi ile inflamatuar belirteçlerden olan eozinofil sayısında azalma olduğu bildirilmiştir ((13),(16)-(18)).
Omalizumab ile birinci saniyedeki zorlu ekspiratuar volümde (FEV1) iyileşmenin gösterildiği ABPA’lı hastalar mevcuttur ((11),(15),(18)). Oysaki geniş hasta popülasyonu olan bir çalışmada akciğer fonksiyonunda anlamlı iyileşme olmadığı gösterilmiştir (12).
Kliniğimizde yapılan bir çalışmada total serum IgE düzeyleri 1000 IU/mL’den daha düşük olan ABPA’ lı hastalar, 1000 IU/mL’den daha yüksek IgE düzeyleri olanlara kıyasla omalizumaba daha duyarlı olarak bulunmuş ve başlangıç serum IgE seviyeleri yanıtın bir öngörücüsü olarak düşünülmüştür (15). Ancak bir sistemik derlemede serum IgE’si >1000 IU/mL olan hastalar, omalizumab tedavisine <1000 IU/mL olanlara göre daha duyarlı olarak bulunmuştur (19).
Alerjik Bronkopulmoner Aspergillozisli hastalarda akciğerlerin fibrozise ilerlemesini sistemik steroidlerin kullanımı önlemektedir. Omalizumabın benzer bir etkiye sahip olup olmadığı ABPA’lı hastalarda yapılan çalışmalarda radyolojik bulguların değerlendirilmemesi nedeniyle net bilinmemektedir. ABPA nedeniyle omalizumab uygulanan, toraks bilgisayarlı tomografisi ile değerlendirilen az sayıda hastada tedavi sonrası distal hava yollarında azalmış impaksiyon ve inflamasyon gösterilmiştir ((13),(19)).
Total IgE düzeylerindeki artış, uzun yıllardır ABPA alevlenmeleri ile ilişkilendirilmiştir (21). ABPA’lı hastalarda tedavi sonrası azalması beklenen total IgE seviyesi omalizumab sonrası değerlendirilmiş ve farklı sonuçlar ortaya çıkmıştır. Beklenmeyen bir sonuç olarak omalizumab tedavisi başladıktan sonra total IgE seviyelerinin azaldığı gösterilmiştir ((10),(14)). Bir çalışmada ise omalizumab sonrası total IgE seviyeleri artmış, serbest IgE seviyeleri ise düşmüştür (20). Farklı bir açıdan bakılarak ABPA tanılı hastalarda anti-IgE tedavisi sırasında alevlenmelerde IgE değerlendirilmiş. Anti-IgE tedavisine rağmen ABPA alevlenmeleri sırasında total ve A. fumigatus’a karşı spesifik IgE düzeylerinin önemli ölçüde arttığı bildirilmiştir (17). Bu çalışmadan yola çıkarak omalizumab alan astımlı hastalarda total ve spesifik IgE değerlerinin ABPA alevlenmelerinde kullanılabileceği düşünülebilir.
Alerjik Bronkopulmoner Aspergillozisli hastalarda omalizumab tedavisi ile fraksiyone ekshale nitrik oksit (FeNO) arasındaki ilişki yeterince değerlendirilmemiştir. Yayınlanan bir olguda omalizumab tedavisi sonrası FeNO düzeylerinin azaldığı bildirilmiştir (16).
Tedavi dozu konusunda güncel kabul gören yaklaşım en yüksek doz olan 2 haftada bir 600 mg omalizumab uygulamasıdır. Ancak tabloda belirtilen çalışmalarda görüldüğü üzere daha düşük dozlarda da klinik etkinlik sağlanabilmektedir. Sistemik bir derlemede omalizumabın kabul edilebilir bir güvenlik profiline sahip olduğu belirtilmiştir (19).
Mepolizumab
İnterlökin-5’e karşı humanize bir MoAb olan mepolizumab, hem balgam hem de kandaki eozinofil sayısını azaltır, aynı zamanda selektif olarak eozinofilik inflamasyonu inhibe eder. Ağır eozinofilik astımda mepolizumab, astım alevlenmelerinde ve sistemik glukokortikoid ile tedavi ihtiyacında azalmaya neden olur (22).
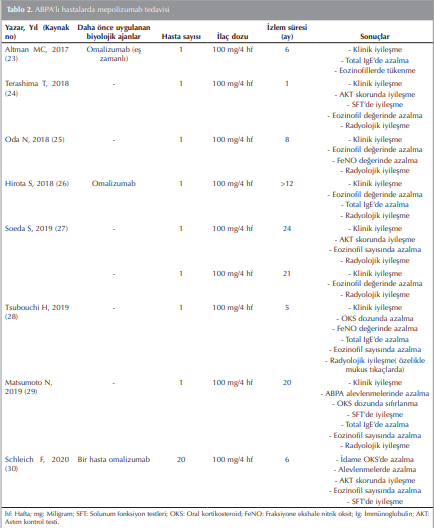
Alerjik Bronkopulmoner Aspergillozis patogenezinde yer alan eozinofilleri hedefleyen mepolizumabın 4 haftada bir 100 mg subkutan olarak başarıyla uygulandığı olgular literatürde yer almaktadır Tablo 2.
Omalizumab ile semptomları tam olarak kontrol altına alınamayan ve kortikosteroid dozu tamaman azaltılamayan ABPA tanılı bir hastada; tedaviye mepolizumab eklenmesi ile hastada klinik iyileşme görülmüştür. Omalizumab ile beraber mepolizumabın yan etki göstermeksizin sinerjist etkili olduğu bu olguda gösterilmiştir (23).
Mepolizumab tedavisi başlangıcında OKS tedavisi alan ABPA’lı hastalarda OKS dozu azaltılmış, bazı hastalarda ise tamamen kesilmiştir ((28)-(30)). ABPA’lı yirmi hastayı içeren geniş kapsamlı bir çalışmada mepolizumabın astım kontrol testinde (AKT) iyileşme, alevlenmelerde ve idame OKS dozunda azalma sağladığı gözlenmiştir (30).
Mepolizumab tedavisi sonrası periferik eozinofil sayısının azaldığı hatta iki olguda sıfırlandığı gösterilmiştir ((23)-(30)). Mepolizumab tedavisi total IgE değerlerinde de azalmaya neden olmakla birlikte ((23),(26),(28),(29)), bazı olgularda total IgE değerlerinin değişmediği gösterilmiştir. Mepolizumab ile tedavi edilen total IgE değeri değişmeyen bu ABPA’lı hastaların steroid almaması dikkat çekmektedir ((24),(27)).
Mepolizumab tedavisi ile ABPA’da klinik ve radyolojik iyileşme olgu raporlarında gösterilmiştir. Radyolojik iyileşmede özellikle mukus tıkaçlarının azaldığı ya da tamamen temizlendiği dikkat çekmektedir. Aynı zamanda mukus tıkaçlarında düzelmeye infiltrasyonlarda düzelme eşlik edebilmektedir ((24)-(29)).
Alerjik Bronkopulmoner Aspergillozis tanısı alan eşlik eden eozinofilik sinüziti ve otitis mediası omalizumab tedavisi altında kötüleşen ve radyolojik bulguları düzelmeyen hastada mepolizumab, ABPA’nın astım komponentini remisyonda tutmakla kalmayarak aynı zamanda sinüzit ve orta kulak iltihabı ile radyolojik bulgularını da iyileştirmiştir (26). Bir başka refrakter eozinofilik kronik rinosinüzitli ABPA olgusunda mepolizumab uygulaması hem ABPA hem de eozinofilik kronik rinosinüzit için iyi klinik yanıt ve uzun vadeli hastalık kontrolü sağlamıştır (29).
Mepolizumab sonrası solunum fonksiyonları değerlendirildiğinde; FEV1 değerinde artış olgularla gösterilmiştir ((24),(29),(30)). Daha önce ağır astımda gösterildiği gibi, ABPA’lı hasta grubunda mepolizumab kullanımıyla FeNO’da azalma gözlenmiş ancak anlamlı bulunmamıştır (30). Ayrıca yayınlanan iki olguda daha mepolizumab sonrası FeNO değerlerinde düşme gösterilmiştir ((25),(28)). Mepolizumab ile tedavi edilen ABPA’lı hastalardan oluşan derlemede mepolizumaba bağlı herhangi bir yan etki bildirilmemiştir (31).
Benralizumab
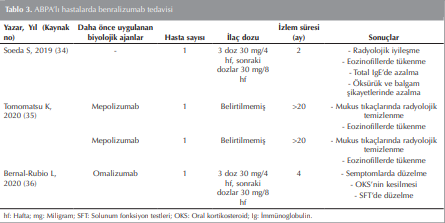
Benralizumab, interlökin-5 reseptör alfaya karşı humanize bir MoAb’tır. Bu antikor doğal öldürücü hücrelerin rol aldığı antikora bağımlı hücre aracılı sitotoksisite mekanizmasıyla eozinofil apopitozuna neden olmaktadır. Benralizumab bu sayede eozinofillerin hızlı, doğrudan ve neredeyse tamamen tükenmesini sağlar. Benralizumab ağır eozinofilik astımda standart tedaviye ek olarak kullanılmaktadır ((32),(33)). Benralizumab tedavisinin ABPA’lı hastalarda kullanıldığı az sayıda çalışma mevcuttur Tablo 3.
Alerjik Bronkopulmoner Aspergillozis tanılı sistemik steroidin ve itrakanozolün yan etkilerinden endişe eden bir hastaya benralizumab tedavisi uygulanmış. Benralizumab ile hastada hızlı ve dramatik radyolojik iyileşmeyle birlikte periferik eozinofillerin tamamen tükendiği bildirilmiştir. Yazarlar hızlı ve dramatik düzelmede, bronşektazi gibi geri dönüşümsüz komplikasyonun olmadığı erken evre ABPA olmasının katkısı olabileceğini ifade etmişlerdir. Ayrıca bu olguda antimikrobiyal tedavi almadan benralizumab sonrası radyolojik iyileşmenin olması enfeksiyondan ziyade eozinofilik inflamasyona bağlı değişiklikleri düşündürmektedir (34).
Komorbid durumları nedeniyle OKS alamayan, radyolojik görüntülerde mukus tıkaçları olan ABPA’lı iki erişkin hasta bildirilmiştir. Bu iki hastaya mepolizumab uygulanmış; hastaların solunum semptomlarında ve solunum fonksiyonlarında iyileşme ile birlikte periferik kan eozinofil sayısında azalma gözlemlenmiş ancak mukus tıkaçları görüntülemelerde devam etmiştir. Bunun üzerine hastaların mepolizumab tedavisi benralizumab ile değiştirilmiştir. Benralizumab tedavisi sonrası kontrollerinde bilgisayarlı tomografi mukus tıkaçları temizlenmiş ve hastaların periferik eozinofil değerleri sıfırlanmıştır (35). Bu iki hastada mukus tıkaçların tamamen temizlenmesinde ve periferik eozinofil sıfırlanmasında benralizumabın mepolizumabdan daha etkin olduğunu göstermektedir. Benralizumab antikor bağımlı hücre aracılı sitotoksisite ile hava yollarında mevcut olan eozinofilleri de ortadan kaldırabilir. Bu sayede mepolizumaba ek fayda sağlayabilir (32).
Oral kortikosteroid bağımlı ve omalizumab yanıtsız ABPA’lı bir başka hastada benralizumab tedavisi ile klinik iyileşme, solunum fonksiyonlarında düzelme, steroid ihtiyacında azalma gösterilmiştir (36). Literatürde benralizumab ile tedavi edilen astımlı ABPA hastalarında herhangi bir yan etki bildirilmemiştir ((34)-(36)).
Dupilumab
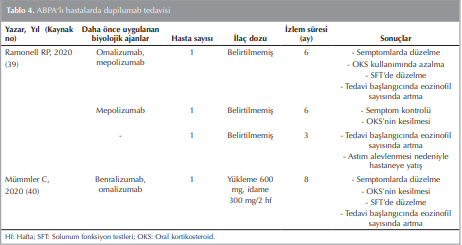
Dupilumab, hem IL-4 hem de IL-13 uyarısıni inhibe eden IL-4 reseptör alfa alt birimine karşı geliştirilmiş bir humanize MoAb’tır. Th2 inflamasyonun aracılık ettiği ağır astım, atopik dermatit ve nazal polip gibi hastalıkların tedavisinde kullanılmaktadır. Dupilumab tedavisi ile astımlı hastalarda solunum fonksiyonları iyileşmekte; alevlenmeler, Tip 2 inflamasyon biyobelirteçleri ve OKS dozları azalmaktadır ((37),(38)). Patogenezde yer alan hem IL-4 hem de IL-13 sitokinlerinin etkisini engelleyen dupilumab tedavisinin, ABPA’lı hastalarda uygulandığı az sayıda olgu sunusu bulunmaktadır (Tablo 4).
İlk olgu serisinde ABPA tanılı üç hastaya dupilumab uygulanmıştır. Bu olgulardan ilkinde omalizumab ve mepolizumab tedavisinden yeterli yanıt almayan hasta dupilumab sonrası FEV1 değeri iyileşmiş, FeNO değeri düşmüş ve astım semptomları düzelmiş. İkinci olguda ise mepolizumaba yeterli yanıtı alınamamış; dupilumab tedavisi ile OKS ihtiyacı ve total IgE değeri azalmış, semptomları düzelmiş. Üçüncü olguda dupilumab uygulanmış, ancak muhtemel dupilumabın neden olduğu hipereozinofili ilişkili astım alevlenmesi ile kişi hastaneye başvurmuş ve steroid tedavisinden fayda görmüş. Bu olgu serisinde üç hastadan ikisi tedavilerinin erken döneminde eozinofil sayısında artış göstermiştir. Eozinofil sayısı artmayan hastanın OKS kullanması, steroidin bu etkiden sorumlu olabileceğini düşündürmektedir (39). Bu olgulardan yola çıkarak ABPA’da dupilumabın başlangıç döneminde sistemik steroid kullanımının yararlı olabileceği düşünülebilir.
Benralizumab ve omalizumabdan fayda görmeyen ABPA tanılı bir hastanın tedavisi dupilumab ile değiştirilmiş ve dupilumab sonrası hastanın semptomları düzelmiş, AKT puanı yükselmiş ve OKS dozu azalmış. Ayrıca tedavi ile FEV1, total IgE ve FeNO düşmüş, ancak tedavinin başlangıç döneminde eozinofil değerleri yükselmiş (40). Sonuç olarak ABPA tanılı az sayıda hastaya dupilumab uygulanmış ve hastalar fayda görmüştür. Ancak dupilumab tedavisinin erken döneminde eozinofil sayısının artabileceği akılda tutulmalıdır.
SONUÇ
Farklı hedeflere yönelik çeşitli MoAb’lar ABPA’lı hastalarda genel olarak güvenle ve başarıyla kullanılmıştır. Hangi MoAb’ın kullanılacağı hasta özelinde karar verilmeli ayrıca hangi MoAb’ın başlanacağı, uygulanma sırası; esas olarak ilaçların bulunabilirliği ve ruhsatlandırma durumuna göre değerlendirilmelidir.
KAYNAKLAR
- Hinson KF, Moon AJ, Plummer NS. Broncho-pulmonary Aspergillosis: a review and a report of eight new cases. Thorax 1952; 7(4): 317-33.
- Agarwal R, Sehgal IS, Dhooria S, Muthu V, Prasad KT, Bal A, et al. Allergic bronchopulmonary Aspergillosis. Indian J Med Res 2020; 151(6): 529-49.
- Denning DW, Pleuvry A, Cole DC. Global burden of allergic bronchopulmonary Aspergillosis with asthma and its complication chronic pulmonary Aspergillosis in adults. Med Mycol 2013; 51(4): 361-70.
- Tillie-Leblond I, Tonnel AB. Allergic bronchopulmonary Aspergillosis. Allergy 2005; 60(8): 1004-13.
- Rosenberg M, Patterson R, Mintzer R, Cooper BJ, Roberts M, Harris KE. Clinical and immunologic criteria for the diagnosis of allergic bronchopulmonary Aspergillosis. Ann Intern Med 1977; 86: 405-14.
- Agarwal R, Chakrabarti A, Shah A, Gupta D, Meis JF, Guleria R, et al. Allergic bronchopulmonary Aspergillosis: review of literature and proposal of new diagnostic and classification criteria. Clin Exp Allergy 2013; 43: 850-73.
- Greenberger PA, Bush RK, Demain JG, Luong A, Slavin RG, Knutsen AP. Allergic bronchopulmonary Aspergillosis. J Allergy Clin Immunol Pract 2014; 2(6): 703-8.
- Kuhl K, Hanania NA. Targeting IgE in asthma. Curr Opin Pulm Med 2012; 18(1): 1-5.
- Hanania NA, Alpan O, Hamilos DL, Condemi JJ, Reyes-Rivera I, Zhu J, et al. Omalizumab in severe allergic asthma inadequately controlled with standard therapy: a randomized trial. Ann Intern Med 2011; 154(9): 573-82.
- Lin RY, Sethi S, Bhargave GA. Measured immunoglobulin E in allergic bronchopulmonary Aspergillosis treated with omalizumab. J Asthma 2010; 47(8): 942-5.
- Pérez-de-Llano LA, Vennera MC, Parra A, Guallar J, Marin M, Asensio O. Effects of omalizumab in Aspergillus-associated airway disease. Thorax 2011; 66(6): 539–40.
- Tillie-Leblond I, Germaud P, Leroyer C, Tétu L, Girard F, Devouassoux G. Allergic bronchopulmonary Aspergillosis and omalizumab. Allergy 2011; 66(9): 1254-6.
- Collins J, Devos G, Hudes G, Rosenstreich D. Allergic bronchopulmonary Aspergillosis treated successfully for one year with omalizumab. J Asthma Allergy 2012; 5: 65-70.
- Wolf BL, Johnson A. Unexpected decrease in total IgE in a patient with allergic bronchopulmonary Aspergillosis treated with omalizumab. J Allergy Clin Immunol Pract 2014; 2(1): 111-3.
- Aydın Ö, Sözener ZÇ, Soyyiğit Ş, Kendirlinan R, Gençtürk Z, Mısırlıgil Z, et al. Omalizumab in the treatment of allergic bronchopulmonary Aspergillosis: one center’s experience with 14 cases. Allergy Asthma Proc 2015; 36(6): 493-500.
- Homma T, Kurokawa M, Matsukura S, Yamaguchi M, Adachi M. Anti-IgE therapy for allergic bronchopulmonary Aspergillosis. J Microbiol Immunol Infect 2016; 49(3): 459-63.
- Bobolea I, Fernández Rodriguez C, Diaz-Campos R, Melero-Moreno C, Vives-Conesa R. Measuring total IgE is useful in detecting exacerbations in patients with allergic bronchopulmonary Aspergillosis receiving omalizumab. J Allergy Clin Immunol Pract 2016; 4(2): 361-3.
- Cunha FSD, Valle SOR, Elabras Filho J, Dortas Júnior SD, França AT. Omalizumab as add-on therapy in patients with asthma and allergic bronchopulmonary Aspergillosis. J Bras Pneumol 2018; 44(5): 439-41.
- Li JX, Fan LC, Li MH, Cao WJ, Xu JF. Beneficial effects of Omalizumab therapy in allergic bronchopulmonary Aspergillosis: a synthesis review of published literature. Respir Med 2017; 122: 33-42.
- Hamilton RG, Marcotte GV, Saini SS. Immunological methods for quantifying free and total serum IgE levels in allergy patients receiving omalizumab (Xolair) therapy. J Immunol Methods 2005; 303(1-2): 81-91.
- Ricketti AJ, Greenberger PA, Patterson R. Serum IgE as an important aid in management of allergic bronchopulmonary Aspergillosis. J Allergy Clin Immunol 1984;74: 68-71.
- Ortega HG, Liu MC, Pavord ID, Brusselle GG, FitzGerald JM, Chetta A. Mepolizumab treatment in patients with severe eosinophilic asthma. N Engl J Med 2014; 371: 1198-207.
- Altman MC, Lenington J, Bronson S, Ayars AG. Combination omalizumab and mepolizumab therapy for refractory allergic bronchopulmonary Aspergillosis. J Allergy Clin Immunol Pract 2017; 5(4): 1137-9.
- Terashima T, Shinozaki T, Iwami E, Nakajima T, Matsuzaki T. A case of allergic bronchopulmonary Aspergillosis successfully treated with mepolizumab. BMC Pulm Med 2018; 18(1): 53.
- Oda N, Miyahara N, Senoo S, Itano J, Taniguchi A, Morichika D, et al. Severe asthma concomitant with allergic bronchopulmonary Aspergillosis successfully treated with mepolizumab. Allergol Int 2018; 67(4): 521-3.
- Hirota S, Kobayashi Y, Ishiguro T, Nishida T, Kagiyama N, Shimizu Y, et al. Allergic bronchopulmonary Aspergillosis successfully treated with mepolizumab: case report and review of the literature. Respir Med Case Rep 2018; 24: 59-62.
- Soeda S, To M, Kono Y, Yamawaki S, Tsuzuki R, Katsube O, et al. Case series of allergic bronchopulmonary Aspergillosis treated successfully and safely with long-term mepolizumab. Allergol Int 2019; 68(3): 377-9.
- Tsubouchi H, Tsuchida S, Yanagi S, Shigekusa T, Miura M, Sakaguchi K, et al. Successful treatment with mepolizumab in a case of allergic bronchopulmonary Aspergillosis complicated with nontuberculous mycobacterial infection. Respir Med Case Rep 2019; 28: 100875.
- Matsumoto N, Shigekusa T, Matsuo A, Tsubouchi H, Yanagi S, Nakazato M. Allergic bronchopulmonary Aspergillosis complicated by eosinophilic chronic rhinosinusitis successfully treated with mepolizumab. Respirol Case Rep 2019; 7(7): 00465.
- Schleich F, Vaia ES, Pilette C, Vandenplas O, Halloy JL, Michils A, et al. Mepolizumab for allergic bronchopulmonary Aspergillosis: report of 20 cases from the Belgian Severe Asthma Registry and review of the literature. J Allergy Clin Immunol Pract 2020; 8(7): 2412-3.
- Tolebeyan A, Mohammadi O, Vaezi Z, Amini A. mepolizumab as possible treatment for allergic bronchopulmonary Aspergillosis: a review of eight cases. Cureus 2020; 12(8): 9684.
- Busse WW, Katial R, Gossage D, Sari S, Wang B, Kolbeck R, et al. Safety profile, pharmacokinetics, and biologic activity of MEDI-563, an anti-IL-5 receptor alpha antibody, in a phase I study of subjects with mild asthma. J Allergy Clin Immunol 2010; 125(6): 1237-44.
- FitzGerald JM, Bleecker ER, Nair P, Korn S, Ohta K, Lommatzsch M, et al. Benralizumab, an anti-interleukin-5 receptor α monoclonal antibody, as add-on treatment for patients with severe, uncontrolled, eosinophilic asthma (CALIMA): a randomised, double-blind, placebo-controlled phase 3 trial. Lancet 2016; 388(10056): 2128-41.
- Soeda S, Kono Y, Tsuzuki R, Yamawaki S, Katsube O, To M, et al. Allergic bronchopulmonary Aspergillosis successfully treated with benralizumab. J Allergy Clin Immunol Pract 2019; 7(5): 1633-5.
- Tomomatsu K, Sugino Y, Okada N, Tanaka J, Oguma T, Asano K. Rapid clearance of mepolizumab-resistant bronchial mucus plugs in allergic bronchopulmonary Aspergillosis with benralizumab treatment. Allergol Int 2020; 69(4): 636-38.
- Bernal-Rubio L, de-la-Hoz Caballer B, Almonacid-Sánchez C, González-de-Olano D. Successful treatment of allergic bronchopulmonary Aspergillosis with benralizumab in a patient who did not respond to omalizumab. J Investig Allergol Clin Immunol 2020; 30(5): 378-9.
- Wenzel S, Ford L, Pearlman D, Spector S, Sher L, Skobieranda F, et al. Dupilumab in persistent asthma with elevated eosinophil levels. N Engl J Med 2013; 368(26): 2455-66.
- Mümmler C, Munker D, Barnikel M, Veit T, Kayser M, Welte T, et al. Dupilumab improves asthma control and lung function in patients with insufficient outcome during previous antibody therapy. J Allergy Clin Immunol Pract 2020; 24: 2213-98.
- Ramonell RP, Lee FE, Swenson C, Kuruvilla M. Dupilumab treatment for allergic bronchopulmonary Aspergillosis: a case series. J Allergy Clin Immunol Pract 2020; 8(2): 742-3.
- Mümmler C, Kemmerich B, Behr J, Kneidinger N, Milger K. Differential response to biologics in a patient with severe asthma and ABPA: a role for dupilumab? Allergy Asthma Clin Immunol 2020; 16: 55.
Yazışma Adresi (Address for Correspondence)
Dr. Sevim BAVBEK
Ankara Üniversitesi Tıp Fakültesi,
Göğüs Hastalıkları Anabilim Dalı, İmmünoloji ve Alerji Bilim Dalı,
ANKARA - TÜRKİYE
E-mail: bavbek@medicine.ankara.edu.tr