REVIEW
Doi: 10.5578/tt.53798
Tuberk Toraks 2017;65(3):237-244

Şistosomiyazis ve pulmoner hipertansiyon
Nazan ŞEN1
1 Başkent ?niversitesi Adana Dr. Turgut Noyan Uygulama ve Araştırma Merkezi, G?ğ?s Hastalıkları Kliniği, Adana, T?rkiye
1 Clinic of Chest Diseases, Adana Dr. Turgut Noyan Practice and Research Center, Baskent University, Adana Turkey
?ZET
Şistosomiyazis ve pulmoner hipertansiyon
Şistosomiyazis d?nyada en sık g?r?len paraziter hastalıklardan biridir. D?nya ?zerinde yetmişten fazla ?lkede endemik olup, 200 milyondan fazla kişi şistosoma ile infektedir. Pulmoner hipertansiyon (PHT) şistosomiyazisin kronik komplikasyonlarından biridir. Şistosoma ilişkili PHT (Ş-PHT)'nin patogenezi tam olarak bilinmemekle birlikte parazitik arter embolizasyonu, pulmoner arteriopati ve portopulmoner hipertansiyon gibi birka? mekanizmanın rol oynadığı d?ş?n?lmektedir. Ş-PHT'de pulmoner damarlardaki patolojik değişiklikler idiyopatik pulmoner arteriyel hipertansiyon (İPAH) ile benzer bulunmuştur. Şistosomiyazisin, ?zellikle gelişmekte olan ?lkelerde, pulmoner arteriyel hipertansiyon (PAH)'un en sık nedenlerinden biri olması hastalık hakkında bilgilerimizi artırmanın ?nemini vurgulamaktadır. PAH tedavisindeki gelişmeler son yirmi yılda prognozda iyileşme, yaşam beklentisi ve yaşam kalitesinde anlamlı artışa neden olmuş ve Ş-PHT'nin ?nemi daha da artmıştır. Şistosomiyazis pirazikuantel ile tedavi edilir. Bununla birlikte bu tedavinin PHT i?in etkin olduğu y?n?nde ?ok az kanıt vardır. Antihelmintik ila?lar hastalıkta anlamlı bir iyileşmeye neden olmamakla birlikte, yararlı etkileri vardır ve progresyon hızını yavaşlatabilirler. Şistosoma ilişkili PAH (Ş-PAH)'lı hastalarda PAH spesifik tedavilerin kullanımı prognozu iyileştirebilir. Bununla birlikte klinik ?alışmaların yetersizliği ve hastalığın endemik olduğu b?lgelerdeki kısıtlı kaynaklar bu pahalı ila?ların geniş ?apta kullanımlarına olanak tanımamaktadır. Bu tedavilerin etkinliğinin belirlenmesi i?in daha fazla ?alışmalara gereksinim vardır.
Anahtar kelimeler: Şistosomiyazis, pulmoner hipertansiyon
SUMMARY
Schistosomiasis and pulmonary hypertension
Schistosomiasis is one of the most prevelant parazitic diseases in the world.? It is endemic in more than 70 countries, and more than 200 million people worldwide are infected with Schistosoma. Pulmonary hypertension (PHT) is one of the chronic complications of schistosomiasis. The exact pathogenesis of schistosomiasis-associated pulmonary hypertension (S-PHT) remains unclear, although several mechanisms such as parazitic arterial embolisation, pulmonary arteriopathy, and portopulmonary hypertension have been suggested. Pathological pulmonary vascular changes in S-PHT were found similar to those in idiopathic pulmonary arterial hypertension (IPAH). The fact that schistosomiasis is one of the most common causes of pulmonary arterial hypertension (PAH), particularly in the developing countries, underlines the importance of enhancing our knowledge on this disease. Developments in the treatment of PAH have resulted in improved prognosis and significant increase in life expectancy and quality of life in the last two decades, which has enhanced the importance of S-PHT. Schistosomiasis is treated with praziquantel. Nevertheless, there is limited evidence that this treatment is effective for PHT. Although antihelmintic medications do not lead to significant improvement, they have beneficial effects and may slow down disease progression. Using PAH-specific treatments in the patients with schistosomiasis-associated PAH (S-PAH) can improve prognosis. However, inadequate clinical studies and limited sources in the endemic regions restrict extensive usage of these expensive medications. Further studies are required to determine the efficacy of these treatment modalities.
Key words: Schistosomiasis, pulmonary hypertension
Geliş Tarihi/Received: 01.03.2017 - Kabul Ediliş Tarihi/Accepted: 06.03.2017
GİRİŞ
Şistosomiyazis ilk olarak Theodor Bilharz tarafından 19. y?zyılda tanımlanmıştır. Hastalığa Schistosoma denilen parazitik trematod neden olur. Şistosomiyazis d?nya genelinde malarya ve amebiyazisten sonra en sık g?r?len ???nc? paraziter hastalıktır (1,2). Akut ve kronik hastalık olarak karşımıza ?ıkabilir. Akut şistosomiyazis genellikle kendini sınırlayan benign bir hastalıkken, kronik formu ciddi sağlık sorunlarına yol a?abilmektedir (1). Pulmoner arteriyel hipertansiyon (PAH) kronik şistosomiyazisin en ağır komplikasyonlarından biri olup sağ kalp yetmezliği ve ?l?mle sonu?lanabilir (1,3).
Patogenezde parazitik arter embolizasyonu, pulmoner arteriopati ve portopulmoner hipertansiyon gibi birka? mekanizmanın rol oynadığı d?ş?n?lmekle birlikte, ger?ek patogenezi tam olarak bilinmemektedir (1). Bu hastalıktan ?len kişilerin akciğerlerinde ?ok sayıda parazit yumurtası g?r?lm?ş ve uzunca bir s?re, pulmoner hipertansiyonun (PHT) ve sağ kalp yetmezliğinin bu yumurtaların yol a?tığı mekanik obstr?ksiyona bağlı olduğu d?ş?n?lm?şt?r (4,5). Sonraları ise hastalıklı kişilerin akciğerlerinden yapılan ?alışmalarda pleksiform lezyonların ve idiyopatik PAH (İPAH)'a benzer başka patolojik bulguların varlığı g?sterilmiştir. B?ylelikle şistosoma ilişkili PAH (Ş-PAH), D?nya Sağlık ?rg?t? (DS?) tarafından bağ doku hastalığı ve İPAH gibi grup 1 hastalık olarak sınıflandırılmıştır (6).
Şistosomiyazisin, ?zellikle gelişmekte olan ?lkelerde, PAH'ın en sık nedenlerinden biri olması hastalık hakkında bilgilerimizi artırmanın ?nemini vurgulamaktadır. PAH tedavisindeki gelişmeler son yirmi yılda prognozda iyileşme, yaşam beklentisi ve yaşam kalitesinde anlamlı artışa neden olmuş ve şistosomiyazis ilişkili PHT (Ş-PHT)'nin? ?nemi daha da artmıştır (1,3).
EPİDEMİYOLOJİ
Şistosomiyazisin en sık g?r?ld?ğ? b?lge Afrika'dır. İnfeksiyona G?ney Amerika, Karayip Adaları, Orta Doğu ve Asya'nın bazı b?lgelerinde de sık rastlanır. D?nya genelinde yetmişten fazla ?lkede endemik olup, 200-300 milyon kişinin infekte ve 120 milyon kişinin semptomatik olduğu tahmin edilmektedir (1,2,7,8). İnfekte olguların %85'i Sahra altı Afrika'da yaşamaktadır. Endemik b?lgelerde tekrarlayan infeksiyonlara bağlı kronik form daha sıktır. En ?ok etkilenenler 5-20 yaş arası kişilerdir. İleri yaşlarda, y?ksek risk grupları dışında, prevalans azalır. Daha k???k yaş grupları ve yenidoğanlarda sıklığı artmıştır (1).
Akut infeksiyonu olan hastaların %20 kadarında kronik şistosomiyazis gelişebilir. En sık g?r?len kronik bulgu hepatosplenik hastalık olup kronik olguların yaklaşık %4-8'ini oluşturur (3). Etkenler daha ?ok Schistosoma mansoni ve Schistosoma japonicum'dur. Prospektif bir ?alışmada S. mansoni kaynaklı hepatosplenik hastalığı olan olgularda sağ kalp kateterizasyonu ile PHT prevalansı %7.6 olarak bulunmuştur. PHT'nin %4.6'sı PAH iken, %3'?nde postkapiller PHT saptanmıştır (9). Bu durum PHT gelişiminde farklı patogenetik mekanizmaların varlığını d?ş?nd?rmektedir. Yakın zamanda yapılan bir ?alışmada PAH olgu y?k?n?n %20'sini Ş-PAH'ın oluşturduğu g?sterilmiştir (10). Bu bulgular şistosomiyazisin y?ksek prevalansı da g?z ?n?nde bulundurulduğunda, Ş-PHT'nun d?nyada en sık PHT nedeni olduğu g?r?ş?n? g??lendirmektedir (3).
K?t? hijyenik koşullarda yaşayan bireylerin reinfeksiyonu, baraj yapımı gibi ekonomik gelişmeler ve sel gibi doğal afetler nedeniyle infeksiyon, endemik b?lgelerde ?nemli bir sağlık sorunu oluşturmaktadır. Piraziquental gibi tedavilerin etkinliğine rağmen, sosyal ve ekonomik g??l?kler şistosomiyazisin kontrol?n? zorlaştırmakta ve tek başına ila? tedavisini yetersiz kılmaktadır (8). Buna dayanarak hastalığı daha iyi kontrol edebilmek ve tedavi sonu?larını iyileştirmek amacıyla, ?zellikle ila? tedavileri ve korunmaya y?nelik yoğun bir ilgi olmuştur (1). PHT'de kullanılan yeni spesifik tedaviler şistosomiyazisli hastalarda ?ok fazla denenmemiştir ve hastalığın endemik olduğu gelişmekte olan ?lkelerde, kaynakların kısıtlı olması nedeniyle genellikle kullanılamamaktadır (8).
PARAZİTOLOJİ
G?n?m?zde 24 şistosoma t?r? tanımlanmış olup sadece bir kısmı insanlar i?in patojendir. En patojen olanları primer olarak gastrointestinal hastalığa yol a?an S. mansoni ve S. japonicum ve başlıca genito?riner hastalığa yol a?an Schistosoma haematobium'dur. Schistosoma mekongi ve Schistosoma intercalatum daha az g?r?l?r, fakat insanda hastalığa neden oldukları bilinmektedir (1).
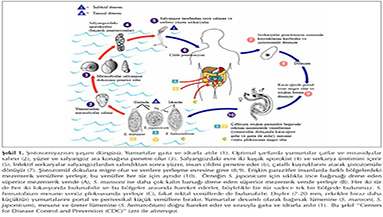
Yaşam d?ng?leri parazitin yumurtalarını suya bırakması ile başlar (Şekil 1). Yumurtalar suyla temas ettiğinde i?erisinden mirasidyalar ?ıkar ve salyangozları (parazit i?in ara konak) infekte eder. Mirasidyalar salyangoz i?erisinde aseks?el olarak b?l?n?r ve serkaryaları oluşturan sporokistlere d?n?ş?r. Birka? hafta sonra ?ok sayıda serkarya g?nl?k sirkadiyen ritmle infekte salyangozlardan suya salınır. Serkaryalar 1 mm uzunluğundadır ve karakteristik ?atallı kuyrukları vardır. Salyangozlardan salındıktan sonra 24 saat yaşarlar ve su y?zeyinde y?zerler. Serkaryalar infekte suda ?alışan veya yıkanan insanların derisinden, proteolitik enzimlerini kullanarak 3-5 dakikada penetre olurlar. Parazit ?atallı kuyruklarını atıp şistozom?le d?n?şene kadar 1-2 g?n ciltte kalır. Penetrasyon yerinde serkarya dermatiti olarak bilinen kaşıntılı, eritemat?z bir nokta oluşur. Şistozom?l kapiller ve lanfatik damarlara girer. Ven?z sistemde migrasyon devam eder ve parazit akciğerlere ulaşır. Bu d?nemde Katayama ateşi olarak bilinen kendini sınırlayan subakut bir hastalığa yol a?ar. Parazitler akciğerlerden sonra bir hafta i?erisinde sistemik ven?z dolaşım yoluyla portal venlere migre olur. Kırmızı kan h?crelerinden beslenmeye başlar ve 6-8 hafta i?inde erişkin hale gelir. Portal ven?z sistemde erişkin hale gelmiş parazitler ?iftleşerek yumurta ?retmeye başlar. Yumurtalar damar duvarını aşarak doku i?erisine, bağırsak ve mesane l?menine ge?er. Fe?es veya idrarla dışarıya atılır ve d?ng? yeniden başlar. Bununla birlikte bazı yumurtalar bağırsak l?menine ilerlemez ve karaciğerin k???k ven?lleri i?erisinde hapsolur. Burada g??l? bir antijenik yanıt oluşturarak periportal fibrozis ve ardından portal hipertansiyona yol a?ar. Bu durumda portokaval şantlar a?ılır, akciğere kan akımı artar, yumurtalar akciğer kapillerine taşınır ve buraya yerleşir (1,2,3,8).
Konakta parazitler otuz yıl kadar yaşar ve yumurta salmaya devam ederler. Parazit kalın dış tabakası sayesinde konak imm?n sistemi tarafından destr?ksiyondan korunur. Bu durum uzun yaşam s?resine olanak tanır (2,8). Kronik infeksiyonda başlıca lezyonlar parazite bağlı değil, parazit yumurtaları nedeniyledir. Gastrointestinal sistem ve genito?riner sistem en sık etkilenen organlar olup, bir?ok organ hastalığın hedefi olabilir (3). S. mansoni yaklaşık 300 adet/g?n, S. japonicum ise 3000 adet/g?n yumurta ?retir. Yumurtalar metabolik olarak ?ok aktiftir ve dokuya ge?ebilmek i?in ?ok fazla sayıda protelitik enzim salgılar (2,8).
KLİNİK BULGULAR
Şistosomiyazis infeksiyonu erken, akut ve kronik formlara ayrılır. Erken form temasın ilk 24 saatinde serkaryaların cilde giriş yerinde akut, pruritik, mak?lopap?ler erupsiyon ile karakterizedir. Bu iki g?n kadar s?rebilir ve şistosoma dermatiti veya y?z?c? kaşıntısı olarak bilinir (1,8).
Katayama ateşi olarak da bilinen akut form primer maruziyet ile ilişkilidir. İnok?lasyondan 6-8 hafta sonra g?r?l?r. Sıklıkla endemik hastalık b?lgelerine seyahat edenlerde ortaya ?ıkar, orada yaşayan pop?lasyonda sık g?r?lmez. Asemptomatik olabileceği gibi, baş ağrısı, kas ve eklem ağrıları, batında sağ ?st kadran ağrısı, kanlı ishal, halsizlik, eozinofili ve S. mansoni varlığında solunumsal semptomlar g?r?lebilir. Solunumsal semptomlar ?ks?r?k, nefes darlığı veya hışıltı şeklindedir. Semptomların şiddeti değişebilir. Akciğer grafisinde veya bilgisayarlı tomografide nod?ler, retik?lonod?ler g?r?n?m izlenebilir. Radyolojik bulgular her zaman semptomlarla korele değildir (1,8). Akut şistosomiyaziste meningoensefalit veya serebral infarkt gibi başka n?rolojik komplikasyonlar ortaya ?ıkabilir. Endomiyokardiyal fibrozis, perikardit ve miyokardit gibi kardiyopulmoner komplikasyonlar gelişebilir. Yine de akut hastalık kendini sınırlar, parazit hedef organa ulaşana kadar birka? haftada spontan d?zelir ve ?nemli uzun d?nem sekeller kalmaz (1).
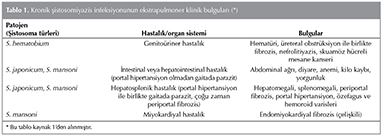
Kronik şistosomiyazis infeksiyonu takiben altı ay i?inde başlayarak uzun yıllar devam edebilir. Bu evrede hastalık farklı organları etkileyerek ilerler ve PHT, portal hipertansiyon, asit ve ?zefagus varis r?pt?r? gelişebilir (3). Hastalığın klinik bulguları yumurta y?k? ve infeksiyon s?resi gibi ?zelliklere g?re farklılıklar g?sterir. Bulgular aynı zamanda şistosoma t?r?ne g?re de değişmektedir. Kronik intestinal (hepatointestinal olarak da bilinir) şistosomiyazis portal hipertansiyon olmadan gaitada parazit saptanması; kronik hepatosplenik şistosomiyazis ise portal hipertansiyon ve sıklıkla periportal fibrozis ile birlikte gaitada parazit g?r?lmesi olarak tanımlanır. Başlıca neden S. japonicum ve S. mansoni'dir. Hastalığın ekstrapulmoner bulguları Tablo 1'de ?zetlenmiştir. Kronik şistosomiyazis sağ ventrik?l disfonksiyonu ve yetmezliği ile birlikte pulmoner vask?ler remodeling ve PHT'ye yol a?abilir. Bu durum istirahatte ve eforda nefes darlığı, alt ekstremitelerde ?dem ve asit gibi vol?m y?klenme bulguları ile karşımıza ?ıkabilir (1). Ş-PAH'ın klinik bulguları İPAH'a benzer. Giderek artan nefes darlığı, g?ğ?s ağrısı, alt ekstremitelerde ?dem ve senkop g?r?lebilir. Radyolojik bulgusu olduk?a dikkat ?ekici olup belirgin pulmoner arter dilatasyonu g?zlenir (3). Pulmoner vask?ler dilatasyonun pulmoner arter basıncından bağımsız olduğu ileri s?r?lm?şt?r. Bu radyolojik bulgunun hastalığın yavaş progresyonuna veya ?zel bir adaptasyon mekanizmasına bağlı olabileceği d?ş?n?lmektedir (11).
ŞİSTOSOMİYAZİS TANISI
Şistosomiyazis tanısı parazite ?evresel temas ?yk?s? ile birlikte gaita, idrar veya rektal biyopside parazit yumurtalarının saptanması ile konulur. Canlı yumurtanın g?r?lmemesi tanıyı dışlamaz. Serolojik testler şistosomalara daha ?nce maruz kalmış kişileri tanımlayabilir. Test endemik olmayan b?lgelerdeki hastalarda daha yararlıdır. Endemik b?lgelerde yaşayanlarda daha ?nce ge?irilen infeksiyonlar nedeniyle, saptanabilecek pozitif seroloji testin değerini d?ş?r?r (2,12).
Abdominal ultrasonografide karaciğer sol lobunda genişleme veya periportal fibrozis olması endemik b?lgelerden gelen hastalarda şistosomiyazis tanısını d?ş?nd?r?r. Ancak karaciğer tutulumu bulgusu olmadan da hastalık gelişebilir. Hepatosplenik değişiklikler Ş-PAH varlığını g??lendiren bir belirte?tir. Endemik b?lgelerde yaşayanlarda hepatosplenik tutulum olmadığında, Ş-PAH ve İPAH ayrımında sorun yaşanabilir (12).
Ş-PAH hastaları asemptomatik olabilir ve PHT taramalar sırasında saptanabilir. Hastaların ?oğunda artmış pulmoner vask?ler diren? (PVR) ve sağ kalp yetmezliğine bağlı semptom ve bulgular vardır. Ek olarak prehepatik portal hipertansiyonun semptom ve bulguları (ciltte varis veya gastrointestinal sistem kanama ?yk?s?) g?r?lebilir. Ekokardiyografi (EKO) hastalığın ağırlığı ve sağ ventrik?l fonksiyonları hakkında bilgi verebilir. Hastalığın endemik olduğu ?oğu ?lkede ilk tanı aracıdır. Ancak EKO'da tahmin edilen sağ ventrik?l basıncı ile sağ kalp kateterizasyonuyla ?l??len ger?ek pulmoner arter basıncı (PAB) arasında belirgin uyumsuzluk saptanabilir (2). PHT tanısında altın standart, PAB'ı direkt olarak ?l?en sağ kalp kateterizasyonudur. PHT ortalama PAB'ın 25 mmHg'nın ?zerinde olması, PAH ise normal pulmoner arter "wedge" basıncı (≤ 15 mm) ile birlikte PHT varlığı olarak tanımlanır. Sağ kalp kateterizasyonu sırasında yapılacak vazodilatasyon testi ile kalsiyum kanal blokeri tedavisi i?in karar verilebilir (1,2). Bir ?alışmada 54 hastanın hi?birinde vazodilator yanıt alınmazken? diğer bir ?alışmada 84 hastanın sadece 3'?nde anlamlı akut vazodilat?r yanıt alınmıştır (12,13).
PATOGENEZ
Parazitin her yaşam siklusunda ?retilen yumurtalar konağın gastrointestinal sisteminden (S. japonicum ve S. mansoni i?in) ?evreye yayılır. Yumurtaların bir kısmı portal ven?z sistem i?erisinde kalır. Bu yumurtalar konak imm?n sistemi i?in hedef haline gelir, mikroapseler ve ardından gran?lomlara d?n?şen lokal inflamatuvar lezyonlar oluşur. Sonu?ta kollajen birikimi olur ve gran?lomların yerini fibrotik lezyonlar alır. Kronik infekte hastaların %4-8'inde periportal fibrozis gelişir ve portal ven?z hipertansiyona yol a?ar. Y?ksek portal basın? nedeniyle gelişen portosistemik şantlar kronik hepatosplenik şistosomiyazisin ağır bir komplikasyonudur. B?ylelikle parazit yumurtaları ?zellikle akciğerlere ve santral sinir sistemine migre olabilir. Şistosoma yumurtalarının akciğere ulaşarak? neden olduğu mekanik pulmoner arter obstr?ksiyonunun PHT gelişimi i?in başlıca yol olduğuna inanılmasına rağmen, tek mekanizma bu değildir. Parazit y?k? olmadan da akciğerlerde histopatolojik değişiklikler saptanabilir (1).
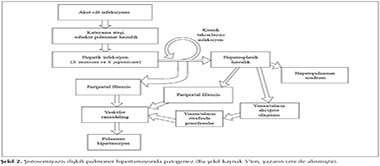
Kronik hepatosplenik şistosomiyazis varlığında PHT'ye neden olan ?? patofizyolojik mekanizma tanımlanmıştır. Patogenezin bu ?? mekanizmayı da i?erdiği d?ş?n?lmektedir (Şekil 2). Birincisi, ilk olarak tanımlanan mekanizma, pulmoner arterlere parazit yumurtası embolizasyonudur. Portal hipertansiyon varlığında ortaya ?ıkar. Oluşan portosistemik şantlar parazit yumurtalarının akciğere migrasyonuna, pulmoner arterlere yumurta embolizasyonuna ve b?ylelikle pulmoner arterlerde obstr?ksiyon, destr?ksiyon ve pleksiform lezyon oluşumuna yol a?ar. Pleksiform lezyonlar hem akciğer parankimini hem de damar yatağını etkiler. Distal pulmoner damar yatak kaybına neden olarak PVR'yi artırır. Başlangı?ta PHT başlıca bu yolla a?ıklanırken, g?n?m?zde inflamatuvar yanıtla ilişkili pulmoner arter vask?lopatisi ile birlikte olduğu d?ş?n?lmektedir. Yumurtaların neden olduğu mekanik obstr?ksiyon PVR'de anlamlı bir artışa neden olmaz, PHT vask?lopatiye bağlıdır (1).
Ş-PHT'de ikinci mekanizma obliteratif arterit olarak tanımlanan dif?z heterojen vask?lopatidir. Parazit yumurta y?k? ile ilişkisi bilinmemektedir. İmm?n aracılı inflamatuvar kaskat inflamasyon, medial kalınlaşma ve intimal remodeling gibi pulmoner vask?ler değişikliklere yol a?ar. Ş-PHT'de oluşan lezyonun en ilgin? yanı İPAH ile olan benzerliğidir (1). Kronik şistosoma infeksiyonuna bağlı PAH nedeniyle kaybedildiği d?ş?n?len hastaların otopsi ?alışmalarında akciğerlerde S. mansoni yumurta ve yumurta antijeni bulunamamıştır (14). İmm?nolojik kaskat bir kez başladığında, parazit akciğerden temizlenmiş olsun veya olmasın, PHT'ye yol a?an pulmoner vask?lopati gelişebilir. Bu durum parazit tedavi edilse, yumurta ve antijenleri eradike edilse bile pulmoner vask?lopatinin sebat edebileceğini g?sterir (15). Daha fazla parazit yumurta y?k? daha k?t? hastalık ile korele bulunmasına rağmen, ağır PHT i?in yumurtanın varlığı gerekmemektedir (14,15).
???nc? hipotez ise Ş-PHT'nin portopulmoner hipertansiyonun bir varyantı olduğudur. Şistosomaya bağlı hepatosplenik hastalık sonrasında portal hipertansiyon ve sonu? olarak PHT gelişir. Bu olay damar yatağında gran?lom veya parazit yumurta embolizasyonu olmaksızın PHT'yi a?ıklamaktadır (14).
Ş-PHT dışında şistosoma infeksiyonu kaynaklı hepatopulmoner sendrom (HPS) da bildirilmiştir. Patogenezi bilinmemekle birlikte intrapulmoner şanta neden olan intrapulmoner vask?ler dilatasyonlar ve PHT bulgusu olmadan hipoksi gelişir (16).
Sonu? olarak; Ş-PHT'nin ger?ekten parazit yumurtasının neden olduğu pulmoner vask?ler gran?lomlara mı, antijen ilişkili vask?lopatiye mi, altta yatan karaciğer hastalığına bağlı portal hipertansiyona mı, yoksa bunların kombinasyonuna mı bağlı ortaya ?ıktığı sorusu hen?z tam olarak yanıtlanamamıştır. Ş-PHT gelişiminde genetik yatkınlık ile birlikte ?evresel fakt?rlerin etkisi olabileceği d?ş?n?lmektedir (1).
İMM?NOLOJİ
Ş-PHT'de pulmoner damarlardaki patolojik değişiklikler İPAH'takine benzerdir. Bu nedenle her iki tip PHT'nin ortaya ?ıkışında benzer sitokin kaskatlarının ve patobiyolojik yolakların yer aldığı d?ş?n?lmektedir. İster pulmoner vask?ler gran?lomlar, imm?n aracılı vask?lopati veya isterse portosistemik şant yoluyla olsun, sonu? sitokin salınımıdır. Sonunda pulmoner vask?ler remodeling ve pleksiform lezyonlar oluşur (1).
Parazite karşı ilk konak imm?n yanıtı, akut infeksiyon s?resince, parazit? antijenleri tarafından başlatılır. Bu T helper 1 h?cre aracılı bir yanıttır. T?m?r nekroz fakt?r a, interl?kin (IL)-1, IL-12 ve interferon y gibi ?ok sayıda sitokin salınımı ger?ekleşir (17). Bu yanıt, sekonder imm?n yanıta doğru yavaş?a ilerleyen g??l? bir inflamatuvar fazdır. Sekonder imm?n yanıt ise parazit yumurta ve antijenlerine bağlıdır ve gran?lom oluşumu i?in gereklidir. T helper 2 h?cre aracılı olup, daha ?ok IL-4, IL-5, IL-10 ve IL-13 gibi sitokinler rol oynar. Bu olayların amacı patojeni izole etmek ve daha ileri organ hasarını ?nlemek amacıyla gran?lom oluşturmaktır (18). Oluşan gran?lomlar başlangı?ta koruyucu olmakla birlikte, zamanla fibrozise yol a?ar. (1). Anahtar rol oynayan sitokinler IL-4 ve IL-13't?r. Deneysel olarak şistosoma maruziyeti ile PHT oluşturulan farelerde, TGF-'nın neden olduğu PHT'den korunabilmek i?in IL-4 ve IL-13'te yetersizlik oluşturulması gerekmiştir. Bu yolağın inhibe edilmesi Ş-PAH'lı hastalarda yeni bir tedavi yaklaşımı olabilir (19,20). Bu alandaki yeni gelişmelere rağmen altta yatan ger?ek mekanizma ve Ş-PAH patogenezine inflamasyonun katkısı tam olarak anlaşılamamıştır ve yeni ?alışmalara ihtiya? vardır (2).
TEDAVİ
Aktif şistosoma infeksiyonu varlığında antihelmintik bir ila? olan pirazikuantel kullanılmalıdır. Erişkin parazitlere karşı olduk?a etkili iken, immatur parazitlere etkisi yoktur. Tek doz olarak kullanılır ve yan etkisi azdır. Erişkin parazitlerin konak damar duvarından ayrılmasına ve b?ylelikle ?lmesine neden olarak, %90'a varan oranlarda k?r sağlar (1,2).
Akut infeksiyon ş?phesinde, birka? hafta arayla iki doz olarak da uygulanabilir. Hasta ilk tedavide k?r olmasa bile parazit ve yumurta y?k? belirgin olarak azalır, ikinci tedavi k?r? ile parazit genellikle eradike edilir (1,2). Parazitin ?l?m? ile birlikte akut antijen salınımı nedeniyle ateşli hastalık g?r?lebilir. Bu durumda semptomları azaltmak amacıyla, pirazikuantel ile birlikte kısa s?reli kortikosteroid tedavisi verilebilir (2,8). Ayrıca pirazikuantelin inflamatuvar h?cre ve fibroblast sayısını azaltarak, akciğerlerdeki gran?lomları baskıladığı y?n?nde veriler vardır. Şistozom?le etkili olmaması ve kısa yarı ?mr? nedeniyle kemoprofilaksi i?in iyi bir se?enek değildir (Artemether kemoprofilaksi i?in daha iyi bir se?enektir) (1). Artemether juvenil formlara etkili iken, erişkin parazitlere daha az etkilidir. Bu nedenle akut infeksiyonda daha etkili olabilir ve Katayama ateşinden korumaktadır (8).
Kronik infeksiyonda pirazikuantel tedavisi yumurta ?reten erişkin parazitleri ?ld?r?r, yumurta miktarını azaltır. B?ylelikle antijen y?k?nde azalmaya neden olarak vask?ler remodelinge yol a?an uyarıları azaltır. K?ratif tedavi ile alveollerdeki periov?ler gran?lomlar geri d?nd?r?lebilirken, vask?ler lezyonlar hasarlı onarılır (8). Patolojik vask?ler remodeling yumurtalar temizlendikten ve gran?lomlar rezol?syona uğradıktan sonra da sebat eder (2).
PAH'lı hastalarda gerektiğinde di?retikler, antikoag?lanlar ve oksijen gibi konvansiyonel tedaviler kullanılmaktadır. Bununla birlikte hepatosplenik şistosomiyazisli hastaların ?oğunda portal hipertansiyon vardır ve ?zefagus varis kanaması olasılığı nedeniyle antikoag?lan kullanımı risklidir (21).? Y?ksek doz kalsiyum kanal blokerleri portal hipertansiyon varlığında yan etkileri nedeniyle ?nerilmez (12).
Ş-PAH'ta antihelmintik tedaviye, PAH'a y?nelik spesifik tedavilerin (prostanoidler, endotelin resept?r antagonistleri veya fosfodiesteraz-5 (PD-5) inhibit?rleri gibi) de eklenmesi konusundaki bilgiler net değildir. İPAH ve Ş-PAH arasındaki patolojik ve imm?nohistokimyasal benzerlik spesifik PAH tedavisinin Ş-PAH'ta etkili olabileceğini d?ş?nd?rm?şt?r. Bu tedavilerin Ş-PAH'ta kullanımını araştıracak klinik ?alışmalara gereksinim vardır. Bunun yanında hastalığın endemik g?r?ld?ğ? b?lgelerdeki kaynak yetersizlikleri, mali g??l?kler bu ila?ların kullanımlarını kısıtlamaktadır (1,8).
Şistosomiyaziste PAH spesifik tedavilerle ilgili ?alışmalar k???k ?aplı olgu serileri ile sınırlıdır. Fosfodiesteraz-5 inhibit?rleri, endotelin resept?r antagonistleri veya kombinasyonları tedavide kullanılmıştır. Bu ?alışmalarda fonksiyonel sınıflama, hemodinamik parametreler ve 6 dakika y?r?me testinde anlamlı iyileşme saptandığı bildirilmiştir (22). Brezilya'da yapılmış bir ?alışmada PAH spesifik tedavi alan İPAH'lı hastalarla, bu tedaviyi almayan Ş-PAH'lı hastalar karşılaştırılmıştır. Ş-PAH'lı hastalarda tanı sırasındaki hemodinamik ?zellikler ve klinik seyir daha iyi bulunurken, sağkalım oranları İPAH'la benzer bulunmuştur. Bununla birlikte Ş-PAH'ta ?l?m riski oranının, istatistiksel olarak anlamlı olmasa da, İPAH'a g?re 1.16 kat arttığı g?sterilmiştir (%95 g?ven aralığı: 0.29-4.68; p= 0.84) (12).?
G?n?m?zde Ş-PHT'nin başlangı?ta altta yatan parazitin eradike edilmesi amacıyla en az bir k?r pirazukuantel ile (veya gaita incelemesi sonucuna g?re, gerekirse iki kez) tedavi edilmesi, parazitin yok edildiği doğrulandığında g?ncel PAH tedavi kılavuzuna uygun olarak spesifik medikal tedavi verilmesi y?n?nde g?r?ş belirtilmiştir (23).
SONU?
Şistosomiyazis ve ilişkili kronik hepatosplenik form, endemik b?lgelerde ?ok sık g?r?len ve hayatı tehdit eden bir hastalıktır. İnfekte bireylerin sayısının ?okluğu nedeniyle şistosomiyazis PHT'nin en sık nedenlerinden biri durumuna gelmiştir. Endemik b?lgelerde yaşayan ve başka bir nedenle a?ıklanamayan dispnesi olan hastalarda bu tanının d?ş?n?lmesi gerekir. Ş-PHT'nin patogenezi halen tam olarak anlaşılamamış olup, ?? farklı mekanizma vardır. Bunun yanında patogenezi benzer, fakat klinik seyir, prognoz ve tedavi yanıtları farklı değişik fenotipleri de olabilir.
Şistosomiyazis pirazikuantel ile tedavi edilir. Bununla birlikte bu tedavinin altta yatan PHT i?in etkin olduğu y?n?nde ?ok az kanıt vardır. Antihelmintik ila?lar hastalıkta anlamlı bir iyileşmeye neden olmamakla birlikte, yararlı etkileri vardır ve progresyon hızını yavaşlatabilirler. Ş-PAH'lı hastalarda PAH spesifik tedavilerin kullanımı, PAH'ın diğer formlarında olduğu gibi prognozu iyileştirebilir. Bununla birlikte klinik ?alışmaların yetersizliği ve hastalığın endemik olduğu b?lgelerdeki kısıtlı kaynaklar bu pahalı ila?ların geniş ?apta kullanımlarına olanak tanımamaktadır.
KAYNAKLAR
- Papamatheakis DG, Mocumbi AO, Kim NH, Mandel J. Schistosomiasis? associated pulmonary hypertension. Pulm Circ 2014;4:596-611.
- Graham BB, Kumar R. Schistosomiasis and the pulmonary vasculature (2013 Grover Conference series). Pulm Circ 2014;4:353-62.
- Gavilanes F, Fernandes CJ, Souza R. Pulmonary arterial hypertension in schistosomiasis. Curr Opin Pulm Med 2016;22:408-14.
- Simonneau G, Gali? N, Rubin LJ, Langleben D, Seeger W, Domenighetti G, et al. Clinical classification of pulmonary hypertension. J Am Coll Cardiol 2004;43(Suppl 12):S5-S12.
- Fishman AP.? Clinical classification of pulmonary hypertension. Clin Chest Med 2001;22:385-91.
- Simonneau G, Gatzoulis MA, Adatia I, Celermajer D, Denton C, Ghofrani A, et al. Updated clinical classification of pulmonary hypertension. J Am Coll Cardiol 2013;62(Suppl 25):D34-D41.
- Butrous G. Saudi guidelines on the diagnosis and treatment of pulmonary hypertension: schistosomiasis and pulmonary arterial hypertension. Ann Thorac Med 2014;9(Suppl): S38-S41.
- Graham BB, Bandeira AP, Morrell NW, Butrous G, Tuder RM. Schistosomiasis-associated pulmonary hypertension: pulmonary vascular disease: the global perspective. Chest 2010;137(Suppl):S20-S29.
- Lapa M, Dias B, Jardim C, Fernandes CJ, Dourado PM, Figueiredo M, et al. Cardiopulmonary manifestations of hepatosplenic schistosomiasis. Circulation 2009;119: 1518-23.
- Alves JL Jr, Gavilanes F, Jardim C, Fernandes CJ, Morinaga LT, Dias B, et al. Pulmonary arterial hypertension in the southern hemisphere: results from a registry of incident Brazilian cases. Chest 2015;147:495-501.
- Hoetle S, Figueiredo C, Dias B, Alves JL Jr, Gavilanes F, Prada LF, et al. Pulmonary artery enlargement in schistosomiasis associated pulmonary arterial hypertension. BMC Pulm Med 2015;15:118.
- Fernandes CJ, Jardim CV, Hovnanian A, Hoette S, Dias BA, Souza S, et al. Survival in schistosomiasis-associated pulmonary arterial hypertension. J Am Coll Cardiol 2010; 56:715-20.
- Japyassu FA, Mendes AA, Bandeira AP, Oliveira FR, Sobral Filho D. Hemodynamic profile of severity at pulmonary vasoreactivity test in schistosomiasis patients. Arq Bras Cardiol 2012;99:789-96.
- Graham BB, Chabon J, Bandeira A, Espinheira L, Butrous G, Tuder RM. Significant intrapulmonary Schistosoma egg antigens are not present in schistosomiasis-associated pulmonary hypertension. Pulm Circ 2011;1:456-61.
- Pedroso ER, Lambertucci JR, Greco DB, Rocha Ode C, Ferreira CS, Raso P. Pulmonary involvement in schistosomiasis mansoni. Mem Inst Oswaldo Cruz 1987;82(Suppl):S221-7.
- Ferreira RCS, Domingues ALC, Markman B, Veras FH, Batista LJB, Albuquerque ES. Hepatopulmonary syndrome in patients with Schistosoma mansoni periportal fibrosis. Acta Trop 2009;11:119-24.
- Boros DL, Whitfield JR. Enhanced Th1 and dampened Th2 responses synergize to inhibit acute granulomatous and fibrotic responses in murine schistosomiasis mansoni. Infect Immun 1999;67:1187-93.
- Burke ML, Jones MK, Gobert GN, Li YS, Ellis MK, McManus DP. Immunopathogenesis of human schistosomiasis. Parasite Immunol 2009;1:163-76.
- Kumar R, Mickael C, Chabon J, Gebreab J, Rutebemberwa A, Garcia AR, et al. The causal role of IL-4 ve IL-13 in Schistosoma mansoni pulmonart hypertension. Am J Respir Crit Care Med 2015;192:998-1008.
- Graham BB, Chabon J, Gebreab L, Poole J, Debella E, Davis L, et al. TGF- signaling promotes pulmonary hypertension caused by Schistosoma mansoni. Circulation 2013;128: 1354-64.
- Hovnanian A, Hoette S, Fernandes CJ, Jardim C, Souza R. Schistosomiasis associated pulmonary hypertension. Int J Clin Pract Suppl 2010;165:25-8.
- Fernandes CJ, Dias BA, Jardim CV, Hovnanian A, Hoette S, Morinaga LK, et al. The role of target therapies in schistosomiasis-associated pulmonary arterial hypertension. Chest 2012;141:923-8.
- Gali? N, Corris PA, Frost A, Girgis RE, Granton J, Jing ZC, et al. Updated treatment algorithm of pulmonary arterial hypertension. J Am Coll Cardiol 2013;62(Suppl 25): D60-D72.
Yazışma Adresi (Address for Correspondence)
Dr. Nazan ŞEN
Başkent ?niversitesi Adana Dr. Turgut Noyan
Uygulama ve Araştırma Merkezi,
G?ğ?s Hastalıkları Kliniği,
Adana - T?rkiye
e-mail: nazansen68@gmail.com