REVIEW
Doi: 10.5578/tt.10231
Tuberk Toraks 2016;64(2):163-170

Akciğer kanseri ve epigenetik değişiklikler
G?lbahar DARILMAZ Y?CE1, Ebru ORTA? ERSOY2
1 Turgut ?zal ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Ankara, T?rkiye
1 Department of Chest Diseases, Faculty of Medicine, Turgut Ozal University, Ankara, Turkey
2 Hacettepe ?niversitesi Tıp Fak?ltesi, Yoğun Bakım ?nitesi, Ankara, T?rkiye
2 Intensive Care Unit, Faculty of Medicine, Hacettepe University, Ankara, Turkey
?ZET
Akciğer kanseri ve epigenetik değişiklikler
Epigenetik değişiklikler, DNA dizisinde değişiklik olmadan gen ekspresyonunda gelişen kalıtımsal değişikliklerdir. DNA metilasyonu, histon modifikasyonları ve non-coding RNA gibi mekanizmaları i?ermektedir. Epigenetik değişiklikler akciğer kanserinin gelişimi, ilerlemesi ve tedavi direncinden sorumludur. DNA metilasyonu, histon modifikasyonları ve miRNA'lar akciğer kanseri erken tanısında, prognoz tayininde, ayırıcı tanıda, tedaviye cevabı değerlendirmede v?cut sıvılarında noninvaziv olarak kolaylıkla ?alışılabilecek potansiyel epigenetik belirte?ler sunmaktadır. Bu derlemenin amacı; akciğer kanseriyle ilişkili epigenetik değişikliklerin anlatılması ve bu değişikliklerin tarama, erken tanı, prognoz ve tedavideki ?neminin vurgulanmasıdır.
Anahtar kelimeler: Akciğer kanseri, epigenetik, kromatin, histon modifikasyonları, DNA metilasyonu
SUMMARY
Lung cancer and epigenetic modifications
Epigenetic alterations, including DNA methylation, histone modifications, and noncoding RNA expression, have been reported to play a major role in the genesis of lung cancer. DNA methylation, histone modifications, and RNA expression are epigenetic markers in assesment of early detection, prognosis and evaluation of treatment of lung cancer. In this rewiev we summarize the common epigenetic changes associated with lung cancer to give some clarity to its etiology, and to provide an overview of the potential translational applications of these changes, including applications for early detection, diagnosis, prognostication, and therapeutics.
Key words: Lung cancer, epigenetics, chromatin, histone modifications, DNA methylation
GİRİŞ
Akciğer kanseri kanserden ?l?mlerin başta gelen nedenidir. T?m d?nyada akciğer kanseri sıklığı giderek artmaktadır. Akciğer kanserinde erken evrelerde tanı koymak zordur, prognoz k?t?d?r ve tedaviye cevap sınırlıdır. Bu nedenle akciğer kanserinde erken tanı, prognoz belirte?leri, bireysel ve hedefe y?nelik tedavi molek?ler onkoloji i?in ?nemli bir araştırma alanı olmuştur. Diğer t?m?rlerde olduğu gibi akciğer kanserinde de epigenetik mekanizmalar erken ve ge? karsinogenezde ?nemlidir. T?m?r supress?r genlerin hipermetilasyonu, onkogenlerin hipometilasyonu kanser gelişiminde kilit noktalardan birisidir. Son zamanlarda epigenetik işaretler ve belirte?ler kullanılarak akciğer kanserinin erken tanısı, prognozu, tedaviye cevabı, bireysel ve hedefe y?nelik tedavisi ile ilgili başarılı sonu?lar elde edilmiştir. Epigenetik değişikliklerin geri d?n?ş?ml? olması tedavi a?ısından son derece ?nemli ve umut vericidir (1).
Akciğer Kanseri Gelişiminde Epigenetik Değişiklikler
Epigenetik değişiklikler anormal DNA metilasyonu (hipo ve hipermetilasyon), histon modifikasyonları ve nonkoding-RNA reg?lasyonlarıdır (1). DNA dizisinde değişiklik olmadan gen ekspresyonunda gelişen kalıtımsal değişikliklerdir (2). DNA metilasyonu en ?ok araştırılmış epigenetik değişikliktir. DNA dizisinde bulunan Sitozin ve Guanin bazlarının bir araya geldiği alanlar CpG adaları olarak adlandırılır. CpG adaları t?m genomda %1 oranında bulunurken, genlerin transkripsiyonunu d?zenleyen promot?r b?lgelerde %50 oranında bulunur. DNA metilasyonu bu b?lgelerdeki sitozinlerin metil grubu ile bağlanmasıdır. Bu işlem DNA metiltransferaz (DNMTs) enzimi ile katalize edilir (3). İlgili gendeki transkripsiyonel sessizleşme, h?cre siklusu kontrol?, farklılaşma, sinyalizasyon ve apopitoz gibi h?cre fonksiyonları DNA metilasyonu ile kontrol edilir (4). Normal h?crelerde spesifik genlerde promot?r CpG adaları genellikle unmetiledir fakat genom global olarak metiledir. Kanserde ise bunun tam tersi bir durum s?z konusudur yani spesifik genlerde promot?r hipermetilasyonu, global hipometilasyon vardır (1). Global hipometilasyon benign h?creden malign h?creye doğru transformasyon i?in karakteristiktir ve kanser progresyonu ile artmaktadır. Diğer yandan t?m?r supres?r genler gibi ?zel b?lgelerin hipermetilasyonu akciğer kanserini de i?eren pek?ok kanser tipinde karsinogenezde ?nemli rol oynar. T?m?r supres?r genler (TSGs) h?crede proliferasyon, h?cre b?y?mesi ve apopitozda ?nemli roller ?stlenerek t?m?r gelişimini engellerler. TSGs ve DNA onarım genlerinin epigenetik olarak susturulması karsinogenezde erken bir olaydır (1). Yanagawa ve arkadaşları akciğer kanserinde DAPK, FHIT, H-cadherin, MGMT, p14, p16, RAR-beta, RASSF1A, RUNX3, TIMP-3 genlerinde, Zhang ve arkadaşları da APC, CDH13, KLK10, DLEC1, RASSF1A, EFEMP1, SFRP1, RARb ve p16 (INK4A)'yı i?eren 9 gende hipermetilasyon paterni saptamışlardır (5,6).
Akciğer kanserinde hipometilasyon 4 alanda g?zlenir. Onkogenlerin hipometilasyonu, genomda global olarak hipometilasyon, tekrarlayan dizilerin hipometilasyonu, LINE hipometilasyonu. Long interspersed element (LINE), insan genomunun yaklaşık olarak %17'sini kaplayan retrotranspozonlardır. LINE-1 sekansının hipometilasyonu transkripsiyonel olarak aktivasyonuna neden olur. Bu durum genomik instabilite ve karsinogenezin progresyonunu sağlar. LINE-1 hipometilasyonu evre IA k???k h?creli dışı akciğer kanserinde (KHDAK) k?t? prognozun bağımsız bir belirtecidir (1).
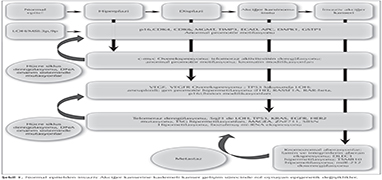
Kanser gelişimi kilit onkogenlerin, t?m?r supres?r genlerin ve DNA onarım genlerinin disreg?lasyonuna neden olan genetik ve epigenetik değişikliklerin bir birikimidir. Premalign ve malign evrelerde, h?cre d?ng?s? kontrol?, h?cre ?oğalması, apopitoz, h?cresel adhezyon, h?cre motilitesi ve DNA onarımı gibi ?nemli fonksiyonlarla ilgili genlerde promot?r metilasyonunun etkili olduğu g?zlemlenmiştir (7). Mutasyonlar ve kopya sayısı değişiklikleri onkogenezde rol oynar fakat epigenetik değişiklikler mutasyonlardan daha sık meydana gelmektedir (8). Promot?r hipermetilasyonu yoluyla t?m?r baskılayıcı genlerin inaktivasyonu, karsinogenezde erken bir olaydır ve akciğer kanserinin gelişeceğine dair bir işarettir (9). Kanser h?cresinde bazı gen sekanslarında hipermetilasyon olurken, bazı gen sekanslarında da eş zamanlı olarak hipometilasyon g?zlenebilmektedir. Bu durum birbirinden bağımsız olarak gelişmektedir. Hiperplaziden adenokarsinomaya doğru neoplastik s?re? ilerledik?e ilgili genlerdeki metilasyon d?zeyinin de arttığı ya da azaldığı g?sterilmiştir. Yani bu s?re? kademeli olarak ilerlemektedir (Şekil 1) (1,10).
Kromatin yapı, belirli bir genin eksprese olup olmayacağını belirlemede ?nemlidir. A?ık kromatin, transkripsiyonal olarak aktifken yoğunlaşmış kromatin inaktifdir. ?karyotlarda, kromatin histon proteinleri etrafında sarılı DNA'dan oluşur. Histonlar DNA katlanmasında rol oynarken post-translasyonel modifikasyonlarla da gen aktivitesini d?zenlerler. Histon asetiltransferaz enzimi (HATs) histonların asetilasyonu ve transkripsiyonel olarak aktivasyonunu sağlarken, histon deasetiltransferaz enzimi (HDATs) histonların deasetilasyonunu ve transkripsiyonel olarak supresyonunu sağlar (2). DNA metilasyonu ve histon modifikasyonları enzimatik reaksiyonlar olup geri d?n?ş?ml?d?r (1). Histonların asetilasyon paterni DNA replikasyonu, onarımı ya da rekombinasyonu ile ilgili genlerde transkrispsiyonun aktifleşmesi ya da inaktifleşmesine neden olur. B?ylece Histon modifikasyonları pek ?ok h?cresel olayı etkileyerek kanser gelişimine neden olabilir (1,11). Histon asetil transferazı kodlayan genlerdeki artmış transkripsiyon a?ık?a karsinogenezle ilişkilendirilmiştir. H4K5/H4K8 artmış asetilasyonu ve H4K20 trimetilasyon kaybı KHDAK de pre-invaziv bronşiyal displastik lezyonlarda g?sterilmiştir (10).
Son zamanlarda non-coding RNA'nın epigenetik kontroldeki ?nemi vurgulanmaktadır. Mikro RNA (miRNA) kısa, kodlayıcı olmayan RNA'lardır, mRNA translasyonunu etkileyerek hedef genlerin ekspresyonunu kontrol altında tutarlar (12). miRNA'lar pek ?ok h?cresel olayda rol oynar. Anormal ekspresyonları (downreg?lasyon ya da overekspresyon) pek?ok insan t?m?r?nde g?zlenmektedir. T?m?r supres?r ve onkogen gibi fonksiyon g?rd?kleri d?ş?n?lmektedir (1). Belirli miRNA'ların ekspresyonu akciğer dahil olmak ?zere ?eşitli kanserlerde metastazla ilişkilendirilmiştir (13). miRNA ların epigenetik reg?lasyonu h?cre ve t?m?re spesifiktir. ?rneğin let-7a-3 meme kanserinde hipermetileyken, akciğer kanserinde hipometile olabilmektedir (14,15). Sigara i?en ve sigara i?meyen kişilerin epitel h?crelerinde miRNA profillerinde farklılıklar rapor edilmiştir (16). miRNA'lar akciğer kanserinde tanısal, prognostik ve terap?tik kullanımda potansiyele sahiptir. Akciğer kanserinde, plazma, serum ya da balgamda miRNA'ların g?sterilmesi, hastalığın erken teşhisi i?in umut vermektedir (11).
Erken Tanıda Epigenetik Değişiklikler
Akciğer kanserinde 5 yıllık sağkalım erken evre hastalarda belirgin olarak daha iyidir, 5 yıllık sağkalım ileri evre hastalarda %10?dan daha azken, erken evre hastalarda %70'den fazladır (17). Bu nedenle erken tanı diğer kanserlerde olduğu gibi akciğer kanserinde de ?nemlidir.
Bu g?ne kadar kanserde DNA metilasyonunun belirte? olarak kullanımı ?zerine yapılmış ?ok sayıda ?alışma vardır. DNA hipermetilasyonu insan kanserlerinde sıklıkla ve erken evrelerde g?zlenen bir olaydır. ?zellikle sigara i?enler gibi y?ksek risk gruplarında displastik lezyonlar ve karsinoma in situ da dahil olmak ?zere premalign lezyonlarda metilasyon g?sterilmiştir (18). Akciğer kanserinin erken tanısında noninvaziv olarak v?cut sıvılarında DNA metilasyonu araştırılmıştır. Serum, plazma, balgam, bronşiyal yıkama suyu DNA metilasyonu a?ısından incelenmiştir.
p16'yı kodlayan gen (CDKN2A) h?cre siklusu kontrol?nde g?revli bir t?m?r supress?r gendir. Bu genin promot?r metilasyonu yoluyla susturulması adenokarsinom ve skuam?z h?creli karsinomda (SCC) g?sterilmiştir. p16 hipermetilasyonu premalign lezyonlarda tespit edilmiştir ve akciğer kanseri oluşumunda erken olarak ortaya ?ıkmaktadır (4). Belinsky ve arkadaşlarının yapmış oldukları ?alışmada bronşiyal epitel h?cre biyopsilerinde sigara i?meyenlerde p16 metilasyon sıklığı %0 iken, sigara i?enlerde %18 bulunmuştur. Premalign lezyonlarda metilasyon sıklığı bazal h?cre hiperplazisinden (%17) skuam?z h?cre metaplazisi (%24) ve karsinoma in situ ya (% 50) doğru gittik?e artış g?stermiştir. SCC'de ise metilasyon sıklığı %61 olarak saptanmıştır (19). Bu durum p16 metilasyonunun erken bir olay olduğunu, kansersiz sigara i?icilerinde bronkoskopik olarak tespit edilebileceğini, kanser gelişim s?recinde kademeli olarak arttığını g?stermektedir.
RASSF1A, APC, ESR1, ABCB1, MT1G ve HOXC9 promot?r metilasyonu evre I KHDAK'de g?sterilmiştir (20). Hwang ve arkadaşları akciğer kanserli hastaların balgamında HOXA9 metilasyonunu %70.7 duyarlılık ve %55.1 ?zg?ll?k ile g?stermiştir (21). Van der Drift ve arkadaşları da balgamda RASSF1A metilasyonu g?stermişlerdir (22). KHDAK hastalarında TCF21 geni anormal metilasyonunun kansersiz bireylerde %0, kansere bitişik normal dokuda %18, t?m?rl? kişi balgamında %54 ve primer t?m?r dokusunda %75 olduğu bulunmuştur (23). Kneip ve arkadaşları akciğer kanserli hastaların plazmasında %60 duyarlılık, %90 ?zg?ll?k ile SHOX2 genindeki metilasyonun biyobelirte? olarak kullanılabileceğini belirtmişlerdir (24). Bronşiyal yıkama ?rneklerinde santral ve b?y?k t?m?rlerde daha y?ksek oranlarda olmak ?zere RASSF1A geni hipermetilasyonu g?sterilmişdir. RASSF1A hipermetilasyonu nondiagnostik bronkoskopisi olan 17 hastanın 4'?nde saptanabilmişdir. Kontrol ?rneklerin hi?birisinde RASSF1A geni hipermetilasyonu bulunamamışdır (25).
Akciğer kanserinde erken tanıda plazma, serum, balgam ve ekshalasyon havasında miRNA'lar da ?alışılmışdır. Roa ve arkadaşları miR-21, miR-155, miR-210, miR-143 ve miR-372'den oluşan beşli panelin KHDAK'li hastaların balgamlarında %83 duyarlılık, %100 ?zg?ll?k ile erken tanıda kullanılabileceğini ?nermişlerdir (26).
miR-198, CEA ve sitokeratin fragment ile birlikte h?cre i?ermeyen malign ve benign? plevral sıvı ayrımında %89.2 duyarlılık ve %85 ?zg?ll?k sağlamışdır (27). ?yetmiş d?rt akciğer kanseri, 68 kontrol hastasının plazmasında miR-155, miR-197, miR-182 araştırılmış ve seviyeleri evre I hastalarda anlamlı olarak y?ksek bulunmuştur, metastazlı hastalarda metastazı olmayan hastalardan daha y?ksek saptanmıştır, ayrıca d?zeyleri kemoterapiye cevap veren hastalarda azalmıştır. Bu 3 miRNA kombinasyonu %81.33 duyarlılık ve %86.76 ?zg?ll?k ile kanserli hastaları kontrollerden ayırmıştır (28).
KHDAK'li hastaların ekshalasyon havasında ve plazmasında kontrollerden farklı olarak ve belirgin ?l??de miR-21'in artmış, miR-486'nın ise azalmış olduğu bulunmuştur (29). miRNA'ların ekspresyonları preneoplastik ve neoplastik bronşiyal ge?iş d?neminde değişiklikler g?stermektedir. Skuam?z h?creli akciğer kanserinde farklı evrelerde ardışık gelen bronş biyopsileri ile 69 miRNA'nın ifade değişiklikleri g?sterilebilmiştir (30). Bu sonu?lara g?re mRNA'lar ?nemli ?l??de tanısal değere sahiptir. Akciğer kanseri erken tanısında miRNA kullanımı yeterince duyarlıdır, son derece ?zg?ld?r, nispeten ucuzdur ve en ?nemlisi noninvazivdir. Epidemiyolojik riski y?ksek topluluklarda akciğer kanserinin erken tanısında birinci basamak tarama testi olarak kullanışlı olabilirler. Ancak g?n?m?zde akciğer kanseri erken tanısında uygun bir belirte? paneli oluşturabilecek miRNA kimliği ve sayısı ?zerinde herhangi bir fikir birliği yoktur.
Ayırıcı Tanıda Epigenetik Değişiklikler
Epigenetik değişiklikler akciğer kanseri histolojik tiplerini birbirinden ya da akciğer kanserini mezotelyomadan ayırmada kullanılmıştır. CDKN2A metilasyonu SCC'de daha yaygın iken APC, CCND2, KCNH5 ve RUNX metilasyonu adenokarsinomlarda anlamlı olarak daha sık g?zlenmiştir (31). Akciğer adenokarsinomu mikroskopik değerlendirmesi malign plevral mezotelyomaya benzemektedir. Fakat DNA metilasyon profili ile adenokarsinoma mezotelyomadan ayrılabilmiştir (32).
Akciğer kanseri histolojik tiplerini ayırmada miRNA panelleri de kullanılmıştır. K???k h?creli akciğer kanseri (KHAK) ile KHDAK arasında ve KHDAK patolojik subtipleri arasında miRNA profillerinde farklılıklar g?sterilmiştir (33-36). Bronşiyal fır?alama ?rneklerinde miR-29a ve miR-375 kullanımı KHAK ve KHDAK ayırıcı tanısında, miR-205 ve miR-34a skuam?z h?creli ve adeno kanser ayırıcı tanısında y?ksek tanısal doğruluk sağlamıştır (37).
Prognostik Belirte? Olarak Epigenetik Değişiklikler
Akciğer kanserinin tedaviye cevabını ?ng?rmede DNA metilasyonunun potansiyel yararları g?sterilmiştir. T?m?r baskılayıcı genlerin hipermetilasyonu pek?ok olguda k?t? sonu?la ilişkilendirilmiştir (11). Zhang ve arkadaşları 64 KHDAK'li hastadan alınan t?m?r ve komşu normal doku ?rneğinde, metilasyon spesifik PCR analizi ile, bir gen panelinde (APC, CHD13, KLK10, DLEC1, RASSF1A, EFEMP1, SFRP1, RARb, p16INK4a, RUNX3, hMLH1, DAPK, BRCA1, p14ARF) metilasyon durumunu araştırmıştır. CpG adalarında metilat?r fenotip pozitif (CIMP+) hastalarda 2 yıllık progresyonsuz sağkalım daha k?t? bulunmuştur (6).
Buckingham ve arkadaşları cerrahi olarak tedavi edilmiş olan evre I ve II KHDAK hastalarında p16, MGMT, RASSF1, DAPK, RASSF1, RASSF5 ve PTEN hipermetilasyonunun prognostik değerini araştırmışlardır. RASSF1, MGMT ve p16 promot?r hipermetilasyonunun kısa sağkalım ile DAPK, RASSF1, RASSF5 ve PTEN hipermetilasyonunun ise kısa s?rede rekk?rrens ile ilişkili olduğunu bulmuşlardır (38).
46 KHDAK'de 803 geni i?eren bir metilasyon ?alışmasında CALCA ve MMP-2 hipermetilasyonunun TNM evresinden bağımsız olarak k?t? sonu?la ilişkili olduğu fakat RASSF1 hipermetilasyonunun koruyucu olduğu belirtilmiştir (39).
hDAB2IP, H-kadherin, DAL-1 ve FBN2 hipermetilasyonu ileri evre KHDAK ile ilişkilendirilmiştir. Bu değişikliklerin kanser gelişim s?recinde daha sonraki bir aşamada meydana gelmesi ileri evrede gelişmeye devam kanserin konak bağışıklığından ve kanser tedavilerinden ka?masında, metastaz yapmak gibi ?zellikler kazanmasında epigenetiğin ?nemli rol oynadığını d?ş?nd?rmektedir (7).
Bazı metilasyon durumları belirli tedavilerin başarısında da etkili olabilmektedir. ?rneğin, plazmada unmetile CHFR genine sahip hastalar, metillenmiş CHFR genine sahip olan hastalara kıyasla EGFR tirozin kinaz inhibit?r? ile kemoterapiye ?nemli ?l??de daha iyi cevap vermektedir (40).
Akciğer kanserinde miRNA ekpresyonunun potansiyel prognostik ?nemini g?steren ilk ?alışma, let-7 pri-miRNA nın d?ş?k ekspresyonu ile KHDAK genel sağkalımının daha kısa olduğunun ortaya ?ıkarılmasıdır. Primer akciğer kanseri ve t?m?r i?ermeyen sağlıklı akciğer dokusunun karşılaştırıldığı bir ?alışmada y?ksek mir-155 ve d?ş?k let-7a-2 ekspresyonunun hastalık evresini hesaba katmaksızın k?t? sağkalımla ilişkili olduğu belirtilmektedir (11). Y?ksek miR-21 ekspresyonu k?t? prognozla ilişkili bulunmuştur (41). miR-34 ailesi normal dokuyla karşılaştırıldığında t?m?r dokusunda down-reg?le olarak bulunmaktadır ve bu d?ş?k seviyeleri y?ksek relaps olasılığı g?stermektedir (42). miR-183 ailesi ?yelerinin (miR-96, miR-182 ve miR-183) kanserli hastaların serum ve kanser dokularında tespiti genel olarak k?t? sağkalım ile ilişkili bulunmuştur (43).
Tedavi Hedefi Olarak Epigenetik DEGISIKLIKLER
Hedef genlerin epigenetik olarak aktivasyonu ya da susturulmasına dayalı stratejiler kanser tedavisinde kullanılabilir. Promot?r hipermetilasyonunu tersine ?eviren farmakolojik ajanlar, akciğer kanseri ?nlenmesi ve tedavisinde cazip bir hedef haline gelmiştir (4). DNA metilasyonu (DNMT enzimi ile) ve Histon deasetilasyonu (HDAC enzimi ile) t?m?r baskılayıcı gen inaktivasyonunun sık nedenlerindendir. Tedavi i?in sessizleştirilmiş olan bu t?m?r supres?r genlerin aktifleştirilmesi gereklidir. Deneysel, HDAC ve DNMT inhibit?rleri, t?m?r baskılayıcı gen ekspresyonunu onarabilir dolayısıyla, KHAK ve KHDAK hastaları i?in tedavide kullanılabilir (44,45).
Ayrıca HDAC inhibit?rleri, kanser h?cresinde EGFR sentezlenmesini inhibe etmiş ve EGFR eksprese eden KHDAK h?crelerinde apoptozisi ind?klemiştir (46). Telomeraz enzimi kanser h?crelerinde s?rekli aktiftir bu sayede kanser h?creleri uzun ?m?rl?d?r. HDAC inhibit?rlerinin telomeraz enzim aktivitesini de inhibe ettiği g?sterilmiştir (47).
Bcl-2 ve Bcl-XL antikanser maddelere karşı diren? kazandırdığı bilinen antiapoptotik proteinlerdir. KHAK'de sıklıkla eksprese edilmektedir. HDAC inhibit?r? ile kanser h?cre hatlarında Bcl-2 ve Bcl-XL mRNA ekspresyonu down-reg?le edilmiştir. HDAC inhibit?rleri Kaspaz bağımlı mitokondriyal apoptotik yolu aktive ederek kanser h?crelerinin apopitoza gitmesini sağlamıştır (48).
Yapılan bir ?alışmada KHDAK'de DNMT inhibisyonu ile metastaza eğilimli fenotip tersine ?evrilmiştir. Bu nedenle epigenetik mod?lasyon metastaz oluşumunu ?nlemek i?in de potansiyel bir tedavi yaklaşımı gibi g?r?nmektedir (49).
KHDAK'de genellikle kemoterapi tedavisine cevap sınırlıdır. Bu nedenle tedaviye yanıtı tahmin etmek i?in belirte?ler kullanışlı olabilir. Uygun rejimler i?in hastaları sınıflandırmak, sadece cevap olasılığı y?ksek olanları saptamak, hi?bir yarar elde edemeyecek hastaları yan etkilerden korumak amacıyla kullanılabilirler. miRNA'ların tedaviye yanıtta kullanımı ile ilgili ilk bulgular umut vericidir. miR-181b overeks-presyonu Bcl-2 protein seviyesini azaltır ve ?ok ilaca diren?li akciğer kanser h?crelerini sisplatin kaynaklı apopitoza duyarlılaştırır (50).
Gefitinib, epidermal b?y?me fakt?r? resept?r?n? (EGFR) hedef alan bir tirozin kinaz inhibit?r?d?r. Bazı t?m?r baskılayıcı miRNA'ların overekspresyonu (let-7a, miR-126 ve miR-145) akciğer kanser h?crelerinde Gefitinib ile ind?klenen sitotoksisiteyi artırmıştır (51). Adenomat?z polipozis koli (APC) geninin miR-135a aracılı olarak baskılanması paklitaksel direncine neden olur. Bundan dolayı paklitaksel direnci miR-135a up-reg?lasyonu ile ilişkilidir. miR-135a down-reg?lasyonu paklitaksel direncini engelleyebilir (52). Zorlanmış let-7 ekspresyonu k-Ras aktivasyonuna neden olarak akciğer kanser h?crelerinin radyoterapiye hassasiyetini artırır (53).
Sonu? olarak; epigenetik değişiklikler akciğer kanseri gelişimi ve ilerlemesinde bildiklerimizin ?tesinde, son zamanlarda daha sık olarak araştırılmış, kanser tanı ve tedavisinde y?ksek potansiyele sahip olduğu g?sterilmiş bir ?alışma alanıdır. Gelecekte epigenetiğin erken tanısal belirte?ler ve bireyselleştirilmiş, hedefe y?nelik tedavi alanlarında sıklıkla kullanılacağı beklenmektedir.
?IKAR ?ATISMASI
Bildirilmemiştir.
KAYNAKLAR
- Brzezian'ska E, Dutkowska A, Antczak A. The significance of epigenetic alterations in lung carcinogenesis. Mol Biol Rep 2013;40:309-25.
- Yasmin R, Siraj S, Hassan A, Khan AR, Abbasi R, Ahmad N. Epigenetic regulation of inflammatory cytokines and associated genes in Human malignancies. Mediators Inflamm 2015;2015:201703. doi: 10.1155/2015/201703.
- Jones PA, Liang G. Rethinking how DNA methylation patterns are maintained. Nat Rev Genet 2009;10:805-11.
- Belinsky SA. Silencing of genes by promoter hypermethylation: key event in rodent and human lung cancer. Carcinogenesis 2005;26:1481-7.
- Yanagawa N, Tamura G, Oizumi H, Kanauchi N, Endoh M, Sadahiro M, et al. Promoter hypermethylation of RASSF1A and RUNX3 genes as an independent prognostic prediction marker in surgically resected non-small cell lung cancers. Lung Cancer 2007;58:131-8.
- Zhang Y, Wang R, Song H, Huang G, Yi J, Zheng Y, et al.? Methylation of multiple genes as a candidate biomarker in non-small cell lung cancer. Cancer Lett 2011;303:21-8.
- Langevin SM,? Kratzke RA,? Kelsey KT.? Epigenetics of lung cancer. Translational Research 2015;165:74-90.
- Brzezianska E, Dutkowska A, Antczak A. The significance of epigenetic alterations in lung carcinogenesis. Mol Biol Rep 2013;40:309-25.
- Belinsky SA, Klinge DM, Dekker JD, Smith MW, Bocklage TJ, Gilliland FD, et al. Gene promoter methylation in plasma and sputum increases with lung cancer risk. Clin Cancer Res 2005;11:6505-11.
- Chung JH, Lee HJ, Kim BH, Cho NY, Kang GH. DNA methylation profile during multistage progression of pulmonary adenocarcinomas. Virchow Arch 2011;459:201-11.
- Liloglou T,? Bediaga NG,? Brown BRB,? Field JK,? Davies MPA. Epigenetic biomarkers in lung cancer. Cancer Letters 2014;342:200-12.
- Garzon R, Calin GA, Croce CM. MicroRNAs in Cancer, Annu Rev Med 2009;60:167-79.
- Bartels CL, Tsongalis GJ. MicroRNAs: novel biomarkers for human cancer. Clin Chem 2009;55:623-31.
- Lehmann U, Hasemeier B, Christgen M, M?ller M, R?mermann D, L?nger F, et al. Epigenetic inactivation of microRNA gene hsa-mir-9-1 in human breast cancer. J Pathol 2008;214:17-24
- Brueckner B, Stresemann C, Kuner R, Mund C, Musch T, Meister M, et al.? The human let-7a-3 locus contains an epigenetically regulated microRNA gene with oncogenic function. Cancer Res 2007;67:1419-23.
- Schembri F, Sridhar S, Perdomo C, Gustafson AM, Zhang X, Ergun A, et al. MicroRNAs as modulators of smoking-induced gene expression changes in human airway epithelium. Proc Natl Acad Sci USA 2009;106:2319-24.
- Hoffman PC, Mauer AM, Vokes EE. Lung cancer. Lancet 2000;355:479-85.
- Belinsky SA. Gene-promoter hypermethylation as a biomarker in lung cancer. Nat Rev Cancer 2004;4:707-17.
- Belinsky SA, Nikula KJ, Palmisano WA, Michels R, Saccomanno G, Gabrielson E, et al. Aberrant methylation of p16INK4a is an early event in lung cancer and a potential biomarker for early diagnosis. Proc Natl Acad Sci USA 1998;95:11891-6.
- Lin Q, Geng J, Ma K, Yu J, Sun J, Shen Z, et al. RASSF1A, APC, ESR1, ABCB1 and HOXC9, but not p16INK4A, DAPK1, PTEN and MT1G genes were frequently methylated in the stage I non-small cell lung cancer in China. J Cancer Res Clin Oncol 2009;135:1675-84.
- Hwang SH, Kim KU, Kim JE, Kim HH, Lee MK, Lee CH, et al. Detection of HOXA9 gene methylation in tumor tissues and induced sputum samples from primary lung cancer patients. Clin Chem Lab Med 2011;49:699-704.
- van der Drift MA, Prinsen CF, Hol BE, Bolijn AS, Jeunink MA, Dekhuijzen PN, et al. Can free DNA be detected in sputum of lung cancer patients? Lung Cancer 2008;61:385-90.
- Shivapurkar N, Stastny V, Xie Y, Prinsen C, Frenkel E, Czerniak B, et al. Differential methylation of a short CpG-rich sequence within exon 1 of TCF21 gene: a promising cancer biomarker assay. Cancer Epidemiol Biomarkers Prev 2008;17:995-1000.
- Kneip C, Schmidt B, Seegebarth A, Weickmann S, Fleischhacker M, Liebenberg V, et al. SHOX2 DNA methylation is a biomarker for the diagnosis of lung cancer in plasma. J Thorac Oncol 2011;6:1632-8.
- van der Drift MA, Prinsen CF, Knuiman GJ, Janssen JP, Dekhuijzen PN, Thunnissen FB. Diagnosing peripheral lung cancer: the additional value of RASSF1A methylation and KRAS mutation analyses in washings in nondiagnostic bronchoscopy. Chest 2012;141:169-75.
- Roa WH, Kim JO, Razzak R, Du H, Guo L, Singh R, et al. Sputum microRNA profiling: a novel approach for the early detection of non-small cell lung cancer. Clin Invest Med 2012;35:E271.
- Han HS, Yun J, Lim SN, Han JH, Lee KH, Kim ST, et al. Downregulation of cell-free miR-198 as a diagnostic biomarker for lung adenocarcinoma-associated malignant pleural effusion. Int J Cancer 2013;133:645-52.
- Zheng D, Haddadin S, Wang Y, Gu LQ, Perry MC, Freter CE, et al. Plasma microRNAs as novel biomarkers for early detection of lung cancer. Int J Clin Exp Pathol 2011;4:575-86.
- Mozzoni P, Banda I, Goldoni M, Corradi M, Tiseo M, Acampa O, et al. Plasma and EBC microRNAs as early biomarkers of non-small-cell lung cancer. Biomarkers 2013;18:679-86.
- Mascaux C, Laes JF, Anthoine G, Haller A, Ninane V, Burny A, et al. Evolution of microRNA expression during human bronchial squamous carcinogenesis. Eur Respir J? 2009;33:352-9.
- Hawes SE, Stern JE, Feng Q, Wiens LW, Rasey JS, Lu H, et al. DNA hypermethylation of tumors from non-small cell lung cancer (NSCLC) patients is associated with gender and histologic type. Lung Cancer 2010;69:172-9.
- Christensen BC, Marsit CJ, Houseman EA, Godleski JJ, Longacker JL, Zheng S, et al. Differentiation of lung adenocarcinoma, pleural mesothelioma, and nonmalignant pulmonary tissues using DNA methylation profiles. Cancer Res 2009;69:6315-21.
- Lebanony D, Benjamin H, Gilad S, Ezagouri M, Dov A, Ashkenazi K, et al. Diagnostic assay based on hsa-miR-205 expression distinguishes squamous from nonsquamous nonsmall-cell lung carcinoma. J Clin Oncol 2009;27:2030-7.
- Landi MT, Zhao Y, Rotunno M, Koshiol J, Liu H, Bergen AW, et al. MicroRNA expression differentiates histology and predicts survival of lung cancer. Clin Cancer Res 2010;16:430-41.
- Bishop JA, Benjamin H, Cholakh H, Chajut A, Clark DP, Westra WH. Accurate classification of non-small cell lung carcinoma using a novel microRNA-based approach. Clin Cancer Res 2010;16:610-9.
- Garfield D. Let-7 microRNA expression and the distinction between nonmucinous and mucinous bronchioloalveolar carcinomas. Lung Cancer 2008;60:307.
- Huang W, Hu J, Yang DW, Fan XT, Jin Y, Hou YY, et al. Two microRNA panels to discriminate three subtypes of lung carcinoma in bronchial brushing specimens. Am J Respir Crit Care Med 2012;186:1160-7.
- Buckingham L, Penfield Faber L, Kim A, Liptay M, Barger C, Basu S, et al. PTEN, RASSF1 and DAPK site-specific hypermethylation and outcome in surgically treated stage I and II nonsmall cell lung cancer patients. Int J Cancer 2010;126:1630-9.
- Mor?n A, Fern?ndez-Marcelo T, Carro J, De Juan C, Pascua I, Head J, et al. Methylation profiling in non-small cell lung cancer: clinical implications. Int J Oncol 2012;40:739-46.
- Salazar F, Molina MA, Sanchez-Ronco M, Moran T, Ramirez JL, Sanchez JM, et al. First-line therapy and methylation status of CHFR in serum influence outcome to chemotherapy versus EGFR tyrosine kinase inhibitors as second-line therapy in stage IV non-small-cell lung cancer patients. Lung Cancer 2011;72:84-91.
- Saito M, Schetter AJ, Mollerup S, Kohno T, Skaug V, Bowman ED, et al. The association of microRNA expression with prognosis and progression in early-stage, non-small cell lung adenocarcinoma: a retrospective analysis of three cohorts. Clin Cancer Res 2011;17:1875-82.
- Gallardo E, Navarro A, Vi?olas N, Marrades RM, Diaz T, Gel B, et al. MiR-34a as a prognostic marker of relapse in surgically resected non-small-cell lung cancer. Carcinogenesis 2009;30:1903-9.
- Zhu W, Liu X, He J, Chen D, Hunag Y, Zhang YK. Overexpression of members of the microRNA-183 family is a risk factor for lung cancer: a case control study. BMC Cancer 2011;11:393.
- Kodani M, Igishi T, Matsumoto S, Chikumi H, Shigeoka Y, Nakanishi H, et al. Suppression of phosphatidylinositol 3-kinase/Akt signaling pathway is a determinant of the sensitivity to a novel histone deacetylase inhibitor, FK228, in lung adenocarcinoma cells. Oncol Rep 2005;13:477-83.
- Kaminskyy VO, Surova OV, Vaculova A, Zhivotovsky B. Combined inhibition of DNA methyltransferase and histone deacetylase restores caspase-8 expression and sensitizes SCLC cells to TRAIL. Carcinogenesis 2011;32:1450-8.
- Yu XD, Wang SY, Chen GA, Hou CM, Zhao M, Hong JA, et al. Apoptosis induced by depsipeptide FK228 coincides with inhibition of survival signaling in lung cancer cells. Cancer J 2007;13:105-13.
- Woo HJ, Lee SJ, Choi BT, Park YM, Choi YH. Induction of apoptosis and inhibition of telomerase activity by trichostatin A, a histone deacetylase inhibitor, in human leukemic U937 cells. Exp Mol Pathol 2007;82:77-84.
- Doi S, Soda H, Oka M, Tsurutani J, Kitazaki T, Nakamura Y, et al. The histone deacetylase inhibit?r FR901228 induces caspase-dependent apoptosis via the mitochondrial pathway in small cell lung cancer cells. Mol Cancer Ther 2004;3:1397-402.
- Hascher A, Haase AK, Hebestreit K, Rohde C, Klein HU, Rius M, et al. DNA methyltransferase inhibition reverses epigenetically embedded phenotypes in lung cancer preferentially affecting polycomb target genes. Clin Cancer Res 2014;20:814-26.
- Zhu W, Shan X, Wang T, Shu Y, Liu P. MiR-181b modulates multidrug resistance by targeting BCL2 in human cancer cell lines. Int J Cancer 2010;127:2520-9.
- Zhong M, Ma X, Sun C, Chen L. MicroRNAs reduce tumor growth and contribute to enhance cytotoxicity induced by gefitinib in non-small cell lung cancer.? Chem Biol Interact 2010;184:431-8.
- Holleman A, Chung I, Olsen RR, Kwak B, Mizokami A, Saijo N, et al. MiR-135a contributes to paclitaxel resistance in tumor cells both in vitro and in vivo. Oncogene? 2011;30:4386-98.
- Oh JS, Kim JJ, Byun JY, Kim IA. Lin28-let7 modulates radiosensitivity of human cancer cells with activation of K-Ras. Int J Radiat Oncol Biol Phys 2010;76:5-8.
Yazışma Adresi (Address for Correspondence)
Dr. G?lbahar DARILMAZ Y?CE
Turgut ?zal ?niversitesi Tıp Fak?ltesi,
G?ğ?s Hastalıkları Anabilim Dalı,
Ankara - TURKEY
e-mail: yucegulbahar@yahoo.com.tr