REVIEW
Doi: 10.5578/tt.7882
Tuberk Toraks 2016;64(1):47-52

Kronik obstr?ktif akciğer hastalığında epigenetik ve g?ncel tedavi yaklaşımları
Serap DURU1
1 Dışkapı Yıldırım Beyazıt Eğitim ve Araştırma Hastanesi, G?ğ?s Hastalıkları Kliniği, Ankara, T?rkiye
1 Clinic of Chest Diseases, Diskapi Yildirim Beyazit Training and Research Hospital, Ankara, Turkey
?ZET
Kronik obstr?ktif akciğer hastalığında epigenetik ve g?ncel tedavi yaklaşımları
DNA metilasyonu, histon asetilasyonu ve kodlanmayan RNA gibi epigenetik mekanizmalar kronik obstr?ktif akciğer hastalığı (KOAH) patogenezinde rol oynayabilir. KOAH'ta epigenetik ile ilgili ?alışmalar patogeneze ışık tutabilir ve yeni hedef tedaviler geliştirilmesine yardımcı olabilir. Bu yazıda KOAH'ta epigenetik mekanizmalar ve g?ncel tedavi yaklaşımlarının sunulması ama?lanmıştır.
Anahtar kelimeler: Epigenetik, KOAH, tedavi
SUMMARY
Epigenetic and current treatment approaches in chronic obstructive pulmonary disease
Epigenetics mechanisms such as DNA methylation, histone acetylation and non-coding RNAs may play are a role in the pathogenesis of chronic obstructive pulmonary disease (COPD). Researchs with regard epigenetic in COPD can shed light on pathogenes and may be relevant in the development of novel targeted therapies. The aim of this article is to review epigenetic mechanisms new treatments approaches in COPD.
Key words: Epigenetic, COPD
Geliş Tarihi/Received: 10.11.2014 • Kabul Ediliş Tarihi/Accepted: 12.05.2015
GİRİŞ
Kronik obstr?ktif akciğer hastalığı (KOAH), g?n?m?zde ?zellikle gelişmekte olan ?lkelerde ?nde gelen sağlık sorunları arasındadır. T?m d?nyada mortalite nedenleri i?inde 3. sıraya yerleşen KOAH, Hastalık Y?k? ?alışmasına g?re 2010 yılında k?resel hastalık y?k?ne en ?ok katkıda bulunan hastalıklar sıralamasında 9. sırada yer almaktadır (1,2). 2020 yılına yaklaştık?a KOAH i?in d?nyadaki ?l?m oranının yıllık 6 milyonun ?zerinde olması beklenmektedir (3). Genetik yatkınlık ve ?evresel uyaranlar sonucunda gelişen KOAH'ın patogenezinde inflamasyon, oksidatif stres, proteaz-antiproteaz dengesi, apopitozis gibi pek ?ok mekanizma rol oynamaktadır. Gen-?evre etkileşimi, KOAH'taki prognozu belirlemede olduk?a ?nemlidir.? Genetik kodu yani DNA baz dizilimini değiştirmeksizin, gen ifadesinde uzun s?reli değişikliklere yol a?an farklı s?re?leri ifade etmekte kullanılan epigenetik mekanizmalarda KOAH'ın seyrine etki etmektedir (4). G?ncel ?alışmalar ile epigenetiğin yalnızca gelişim esnasında değil, erişkin yaşamda da gen ifadesinin akut olarak d?zenlenmesinde rol oynadığının ortaya konması KOAH gibi kompleks hastalıkların gerek oluşumunun a?ıklanmasında gerekse tedavisinde yeni ufuklar a?abilir (5,6).
Bu yazıda, KOAH'lı hastalarda epigenetik d?zenlemeler ve bunları hedef alan tedavi stratejileri değerlendirilmiştir.
Epigenetik Mekanizmalar
Epigenetik mekanizmalar, geri d?n?ş?ml? olmaları ve DNA baz dizilimini farklılaştırmamaları nedeniyle genetik değişimlerden ayrılırlar. Ancak genlerin sessizleşmesine (silencing) neden olup o geni inaktive edici bir mutasyon ve delesyon yapmış gibi davranarak nesilden nesile aktarılabilirler. Bu durumu doğrudan ve dolaylı olarak gen ifadesini değiştirerek yaparlar. DNA metilasyonu, histon modifikasyonları, RNA ile ind?klenen sessizleşmeden oluşan? (RNA-induced silencing) epigenetik mekanizmalar ?evresel koşulların değiştirilmesi, medikal tedaviler ile geri d?n?ş?ml? hale getirilebilir (7). Kromatin ve DNA d?zeyindeki modifikasyonlar doğrudan, post-transkripsiyonel (DNA'dan RNA elde edildikten sonraki) olanlar ise dolaylı gen ifadesi değişiklikleridir. Doğrudan modifikasyonlar, histon yapısındaki kovalent değişiklikler ya da DNA metillenmesi ile sağlanır. Epigenetik mekanizmalar ile kontrol edilen bir h?credeki DNA ve histon proteinlerinin bir araya gelmesi ile oluşan n?kleozomun sıkılığı ?ekirdekteki transkripsiyon fakt?rlerinin DNA'ya erişimini, dolayısıyla gen ifadesini belirler (8). Histon proteinlerinin amino terminal sonlarında yer alan amino asitlere asetilasyon, metilasyon, fosforilasyon, ubikitinasyon veya sumolasyon gibi grupların kovalent bağlanmasıyla olan doğrudan değişiklikler n?kleozom yapısının sıkılığını değiştirerek gen ifadesi d?zenlerler (9). Histona metil ve asetil grupları histon metil transferaz (HMT) ve histon asetil transferaz (HAT) enzimleri ile eklenirken histon demetilaz (HDM) ve histon deasetilaz (HDAC) ile uzaklaştırılır (10). Bu enzimler kromatin yapısını modifiye ederek inflamatuvar genlerin ekspresyonunu d?zenlerler (11,12). DNA'da oluşan genomik hiper ya da hipometilasyonlar h?cre d?zeyinde fonksiyonel bozukluklara yol a?maktadır. CpG adacıklarında g?r?len DNA metillenmesi transkripsiyon fakt?rlerin tanıma b?lgelerini değiştirir. Sonu?ta bu fakt?rlerin bağlanması engellenip gen ifadesi baskılanmaktadır. Gen ekspresyonunun kontrol?n? sağlayan en ?nemli histon modifikasyonu asetilasyondur. Geri d?n?ş?ml? histon asetilasyonunda negatif y?kl? asetil grubunun histon proteininin amino? kuyruk b?lgesindeki pozitif y?kl? lizin aminoasitine eklenmesi ile pozitif y?k n?tralize olarak kromatinde gevşeme meydana gelmektedir. B?ylece Nuklear Fakt?r kappa B (NF-κB)'nin de dahil olduğu transkripsiyon fakt?rlerinin hedef genlerin promotor b?lgelerine ulaşabilmesini sağlamakta ve transkripsiyonel aktivat?r proteinler i?in bağlanma b?lgesi oluşmaktadır. Deasetilasyon ise heterokromatin oluşturarak kromatinin tekrar sıkı sarılmasına ve transkripsiyonun baskılanmasına neden olmaktadır (13).
Diğer bir epigenetik mekanizma olan protein kodlamayan RNA'lar (miRNA) gen ifadesini post-transkripsiyonel par?alanma veya protein ekspresyonunun translasyonel baskılanması ile durdurmaktadır.
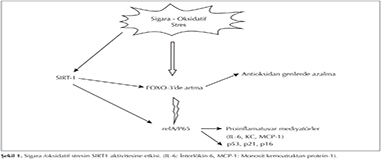
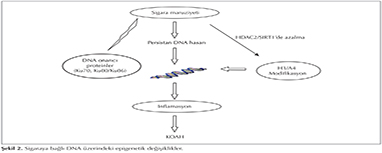
Son yıllarda, KOAH'lı olguların %1-2'sine yol a?tığı iyi bilinen genetik fakt?r alfa-1 antitripsin eksikliği dışındaki epigenetik mekanizmalar ile ilgili araştırmalar artmaktadır (14). Epigenetik bozuklukların KOAH'a neden olabilmesi i?in başta sigara dumanı olmak ?zere pek ?ok ?evresel etkene maruziyet gerekmektedir. ?evresel etkenler epigenetik değişikliklere yol a?arak KOAH patogenezini şekillendirmektedir. DNA ve histondaki modifikasyonlar sigara ve diğer kimyasal maddeler, beslenme durumu gibi ?evresel fakt?rler nedeniyle gelişebilir. Sigara i?enlerin %15-20'sinde KOAH g?r?lmektedir. Bu durum ?evresel etkenlere epigenetik yatkınlığı destekler niteliktedir. Histon asetilason-deasetilasyon dengesinde ?nemli rol oynayan HDAC2 enzimi KOAH'ta proin-flamatuvar sitokinlerin kontrol?nde anahtar enzimdir (15). KOAH'ta azalan HDAC aktivitesi, artan NF-κB aktivitesi ve gen ekspresyonu patogenezde rol almaktadır (16,17). Sigara i?en hastalarda i?meyenlerle karşılaştırıldığında HDAC2'da meydana gelen azalma dengenin asetilasyona doğru kaymasına neden olmaktadır (18). Yapılan bir ?alışmada steroid direncine yol a?tığı d?ş?n?len HDAC2 aktivitesininin KOAH'lı hastalarda hava yolları ve periferik akciğerde azaldığı saptanmıştır (17). Anti-aging molek?l? olan sirtuin ailesi NAD+ bağımlı bir histon desetilazdır.? Sirtuin 1 (SIRT1), histon proteinleri (H3 ve H4), transkripsiyon fakt?r gibi non histon proteinler, FOXO, p53, RelA/p65 gibi sinyal proteinleri deasetile eder. Yapılan ?alışmalarda sigara i?en KOAH'lı hastalarda SIRT1 aktivitesinin azaldığı g?sterilmiştir (12,19) (Şekil 1). İnsan monosit h?cre k?lt?r?nde sigara ile ilişkili SIRT1 gen ekspresyonunun azalması, NF-κB aktivasyonunda artış proinflamatuvar gen transkripsiyonu ile sonu?lanır (12). Şekil 2'de sigara maruziyetinin DNA ?zerindeki epigenetik etkisi g?sterilmiştir. ?zellikle nikotine akut ve kronik olarak maruz bırakılan deney hayvanlarında epigenetik değişiklikler olduğu, DNA'dan RNA sentezine etki eden fos-1, delta fos B ve Jun gibi transkripsyon fakt?rlerinin sentez hızının değiştiği g?sterilmiştir (20).? Ayrıca mukus hipersekresyonuna yol a?an musin genlerin metilasyonu (MUC2, MUC5B) KOAH'ta g?r?len epigenetik mekanizmalardan bir diğeridir (21). Proinflamatuvar cevapta rol alan oksidatif stres, kromatin remodelingini ve sinyal transd?ksiyonunu mod?le etmektedir. Sigara dumanının her bir puff'ında serbest oksijen radikal (ROS) kaynağı olan 1015 serbest radikal, 4700 farklı kimyasal bileşik bulunmaktadır. Bu ROS'lar oksidatif stresin temel kaynağıdır ve h?crede lipid ve n?kleik asitlerle etkileşime girerek h?crenin yapısını bozmaktadır.
Artan oksidatif stres nedeniyle azalan HDAC aktivitesi inhale steroide tam yanıt alınamama ile ilişkilendirilmektedir (22). KOAH'lı hastalarda tedavideki yanıtsızlık musk?ler disfonksiyona yol a?arak hastalığın prognozunu olumsuz y?nde etkilemektedir. Sonu?ta oksidatif stres KOAH'ta musk?ler disfonksiyona neden olabilir (23).
KOAH'ta Epigenetik Tedavi Yaklaşımları
G?n?m?zde sigara kullanımı ve KOAH'ın patogenezinde epigenetik mekanizmaların ?nemi giderek artmakta ve bu durum yeni tedavi se?enekleri i?in bize umut vermektedir. KOAH'ta gerek diyet gerekse medikal tedavi olarak alınan bazı kimyasal bileşikler epigenetik tedavi yaklaşımları olarak g?ndemdedir. Tablo 1'de KOAH'ta epigenetik tedavi yaklaşımları g?sterilmiştir. Eskiden bu yana kullanılan teofilin, fosfodiesteraz enzimini nonselektif olarak inhibe ederek h?cre i?inde cAMP ve cGMP d?zeylerini azaltıp bronkodilatasyon yapmaktadır. Teofilin transkripsiyon d?zeyinde, NF-κB'in n?kleusa translokasyonunu ?nlemektedir. Ayrıca terap?tik dozda HADC aktivitesini oksidan aktive fosfoinozitid 3 kinaz yoluyla (PI3Kδ) arttırarak inflamatuvar genlerin ekspresyonunu azaltmaktadır (24,25). D?ş?k doz teofilinin HADC aktivitesini arttırarak steroidlerin antiinflamatuvar etkilerini d?zenlediği g?sterilmiştir (26). Ford ve arkadaşları tarafından yapılan bir ?alışmada teofilin ve inhale steroid kombinasyonunun KOAH'lı hastalarda inflamasyonu azaltabileceği g?r?lm?şt?r (27). Curcumin (zerde?al), daha ?ok k?ri sosunda kullanılan bir polifenold?r. Oksidatif stres ve sigara nedeniyle azalan HADC aktivitesini normal bir seviyeye getirerek steroid etkisini arttırabilir (28). Teofilin ve curcumin, alveoler makrofajlarda sigara dumanı/oksidan-kaynaklı IL-8 salınımını baskılayarak glukokortikoid duyarlılığı azaltabilir (29). NF-κB-bağımlı pro-inflamatuar genlerin d?zenlenmesinde ?nemli bir rol alan Nrf2 aktivat?r? sulforan turp ve brokolide bulunur (30). HDAC2 nitrosizilasyon ve degradasyonunun inhibisyonunu ?nleyerek KOAH'ta alveoler makrofajlarda deksametazonun? direncini d?zeltir. Trisiklik antidepresan nortriptilin HDAC aktivitesini artırarak kortikosteroid etkisini geri kazandırır (31). Eritromisin, HDAC1, HDAC2 ve HDAC3 red?ksiyonunu,? NF-κB aktivitesini inhibe eder (32). Flavonoid olan baisalin HDAC2 fosforilasyonunun inhibisyonu ile steroid direncini ?nlemektedir (33). Uzun etkili bronkodilat?rler salmeterol, formoterol HDAC aktivitesini geri kazandırarak inflamatuvar cevabı inhibe ederler. (34).
SIRT1'in fosforilasyonunu inhibe eden yeni farmakolojik tedaviler KOAH'lı hastalarda inflamasyonu iyileştirebilir ancak steroid direncini d?zeltmedeki etkileri hen?z bilinmemektedir (35). KOAH'ta oksidatif stresle artan ve IL-1 tarafından uyarılan IL-6, IL-8 (KC) ekspresyonu bromodomain ve ekstraterminal proteinlerce (BET) baskılanarak antiinflamatuvar tedavi sağlanabileceği s?ylenmiştir (36).
Sonu?ta KOAH'ta epigenetik mekanizmalar ?evresel etkenlerle gen ifadesini değiştirmektedir. KOAH'ta epigenetik mekanizmaların patogenezdeki rol?n? anlamaya y?nelik ?alışmalar tedavisi stratejilerinin planlanmasına katkı sağlayacaktır. HDAC2 ekspresyonunu hedef alan tedavi yaklaşımları KOAH'lı hastalarda inflamasyonu ?nlemede umut vermektedir. DNA metilasyonu, histon modifikasyonlarını ve inflamatuvar gen ekspresyonlarını etkileyecek yeni geliştirilecek tedavilere ihtiya? bulunmaktadır.
?IKAR ?ATIŞMASI
Bildirilmemiştir.
KAYNAKLAR
- Lozano R, Naghavi M, Foreman K, Lim S, Shibuya K, Aboyans V, et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet 2012;380:2095-128.
- T?rk Toraks Derneği. Kronik obstr?ktif akciğer hastalığı koruma, tanı ve tedavi raporu. 2014;1-72.
- Yao Hongwei, Rahman I. Current concepts on oxidative/carbonyl stress, inflammation and epigenetics in pathogenesis of chronic obstructive pulmonary disease. Toxicol Appl Pharmacol 2011;254:72-85.
- Delcuve GP, Rastegar M, Davie JR. Epigenetic control. J Cell Physiol 2009;219:243-50.
- Kouzarides T. Chromatin modifications and their function. Cell 2007;128:693-705.
- Metivier R, Gallais R, Tiffoche C, Le P?ron C, Jurkowska RZ, Carmouche RP, et al. Cyclical DNA methylation of a transcriptionally active promoter. Nature 2008;452:45-50.
- Egger G, Liang G, Aparicio A, Jones AP. Epigenetics in Human disease and prospects for epigenetic therapy. Nature 2004;429:457-63.
- Felsenfeld G, Groudine M. Controlling the double helix. Nature 2003;421:448-53.
- Renthal W, Nestler EJ. Epigenetic mechanisms in drug addiction. Trends Mol Med 2008;14:341-50.
- Tsankova N, Renthal W, Kumar A, Nestler EJ. Epigenetic regulation in psychiatric disorders. Nat Rev Neurosci 2007;8:355-67.
- Urnov FD, Wolffe AP. Chromatin remodeling and transcriptional activation: The cast (in order of appearance). Oncogene 2001;20:2991-3006.
- Rajendrasozhan S, Yang SR, Edirisinghe I, Yao H, Adenuga D, Rahman I. Deacetylases and NF-kB in redox regulation of cigarette smoke-induced lung inflammation: epigenetics in pathogenesis of COPD. Antioxid Redox Signal 2008;10:799-811.
- Peterson LC, Laniel M. Histones and histone modifications. Curr Biol 2004;14:546-51.
- Tobin MJ, Cook PJL, Hutchison DCS. Alpha 1-antitrypsin deficiency: The clinical and physiological features of pulmonary emphysema in subjects homozygous for Pi type Z. Brit J Dis Chest 1983;77:14-27.
- Chen Y, Huang P, Ai W, Li X, Guo W, Zhang J, et al. Histone deacetylase activity is decreased in peripheral blood monocytes in patients with COPD. J Inflamm (Lond) 2012;9:10.
- Di Stefano A, Caramori G, Capelli A, Capelli A, Lusuardi M, Gnemmi I, et al. Increased expression of NF-kB in bronchial biopsies from smokers and patients with COPD. Eur Respir J 2002;20:556-63.
- Ito K, Ito M, Elliott WM, Cosio B, Caramori G, Kon OM, et al. Decreased histone deacetyase activity in chronic obstructive pulmonary disease. N Engl J Med 2005;352:1967-76.
- Szulakowski P, Crowther AJ, Jimenez LA Donaldson K, Mayer R, Leonard TB, MacNee W, et al. The effect of smoking on the transcriptional regulation of lung inflammation patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;174:41-50.
- Sundar IK, Yao H, Rahman I. Oxidative stress and chromatin remodeling in chronic obstructive pulmonary disease and smoking-related diseases. Antioxid Redox Signal 2013 20;18:1956-71.
- Taki FA, Pan X, Zhang B. Chronic nicotine exposure systemically alters microRNA expression profiles during post-embryonic stages in Caenorhabditis elegans. J Cell Physiol 2014;229:79-89.
- Vincent A, Perrais M, Desseyn JL, Aubert JP, Pigny P, Van Seuningen I. Epigenetic regulation (DNA methylation, histone modifications) of the 11p15 mucin genes (MUC2, MUC5AC, MUC5B, MUC6) in epithelial cancer cells. Oncogene 2007;26:6566-76.
- Barnes PJ, Adcock IM. Glucocorticoid resistance in inflammator diseases. Lancet 2009;373:1905-17.
- Barreiro E, Peinado VI, Galdiz JB, Ferrer E, Marin-Corral J, S?nchez F, et al. Cigarette smoke-induced oxidative stress: A role in chronic obstructive pulmonary disease skeletal muscle dysfunction. Am J Respir Crit Care Med 2010;182:477-88.
- Barnes PJ. Theophylline in Chronic Obstructive Pulmonary Disease. New Horizons. Proc Am Thorac Soc 2005;2:t334-9.
- Cosio BG, Tsaprouni L, Ito K, Jazrawi E, Adcock IM, Barnes PJ. Theophylline restores histone deacetylase activity and steroid responses in COPD macrophages. J Exp Med 2004;200:689-95.
- Ito K, Yamamura S, Essilfie-Quaye S, Cosio B, Ito M, Barnes PJ, et al. Histone deacetylase 2-mediated deacetylation of the glucocorticoid receptor enables NF-kappaB suppression. J Exp Med 2006;203:7-13.
- Ford PA, Durham AL, Russell RE, Gordon F, Adcock IM, Barnes PJ. Treatment effects of low-dose theophylline combined with an inhaled corticosteroid in COPD. Chest 2010;137:1338-44.
- Meja KK, Rajendrasozhan S, Adenuga D, Biswas SK, Sundar IK, Spooner G, et al. Curcumin restores corticosteroid function in monocytes exposed to oxidants by maintaining HDAC2. Am J Respir Cell Mol Biol 2008;39:312-23.
- Marwick JA, Caramori G, Stevenson CS, Casolari P, Jazrawi E, Barnes PJ, et al. Inhibition of PI3Kdelta restores glucocorticoid function in smoking-induced airway inflammation in mice. Am J Respir Crit Care Med 2009;179:542-8.
- Yang SR, Wright J, Bauter M, Seweryniak K, Kode A, Rahman I. Sirtuin regulates cigarette smokei nduced proinflammatory mediator release via RelA/p65 NF-kappaB in macrophages in vitro and in rat lungs in vivo: implications for chronic inflammation and aging. Am J Physiol Lung Cell? Mol? Physiol 2007;292:567-76.
- Mercado N, To Y, Ito K, Barnes PJ. Nortriptyline reverses corticosteroid insensitivity by inhibition of phosphoinositide-3-kinase-delta. J Pharmacol Exp Ther 2011;337:465-70.
- Li M, Zhong X, He Z, Wen M, Li J, Peng X, et al. Effect of erythromycin on cigarette-induced histone deacetylase protein expression and nuclear factor-kappaB activity in human macrophages in vitro. Int Immunopharmacol 2012;12:643-50.
- Li L, Wu J, Liu B, Sun J, Gong W, Sun J, et al. Baicalin is anti-inflammatory in cigarette smoke-induced inflammatory models in vivo and in vitro: A possible role for HDAC2 activity. Int Immunopharmacol 2012;13:15-22.
- Yao H, Rahman I. Role of histone deacetylase 2 in epigenetics and cellular senescence: implications in lung inflammaging and COPD. Am J Physiol Lung Cell Mol Physiol 2012;303:557-66.
- Sakao S, Tatsumi K. The importance of epigenetics in the development of chronic obstructive? pulmonary disease. Respirology 2011;16:1056-63.
- Khan YM, Kirkham P, Barnes PJ, Adcock IM. Brd4 is essential for IL-1β-induced inflammation in human airway epithelial cells. PLoS One? 2014;23;9:e95051.
Yazışma Adresi (Address for Correspondence)
Dr. Serap Duru
Dışkapı Yıldırım Beyazıt Eğitim ve Araştırma Hastanesi,
G?ğ?s Hastalıkları Kliniği,
ANKARA - TURKEY
e-mail: akcalis@hotmail.com