RESEARCH ARTICLE
Doi: 10.5578/tt.9854
Tuberk Toraks 2016;64(1):17-26

Kronik obstr?ktif akciğer hastalığı infektif alevlenmelerinde neb?l magnezyum s?lfatın etkinliği
Şule C?MERT1, Esen KIYAN2, G?lfer OKUMUŞ2, Orhan ARSEVEN2, Turhan ECE2, Halim İŞSEVER3
1 İzmir Tepecik Eğitim ve Araştırma Hastanesi, Allerji ve Klinik İmm?noloji Kliniği, İzmir, T?rkiye
1 Clinic of Allergy and Clinic Immunology, Izmir Tepecik Training and Research Hospital, Izmir, Turkey
2 İstanbul ?niversitesi İstanbul Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, İstanbul, T?rkiye
2 Department of Chest Diseases, Faculty of Istanbul Medicine, Istanbul University, Istanbul, Turkey
3 İstanbul ?niversitesi İstanbul Tıp Fak?ltesi, Halk Sağlığı Anabilim Dalı, İstanbul, T?rkiye
3 Department of Public Health, Faculty of Istanbul Medicine, Istanbul University, Istanbul, Turkey
?ZET
Kronik obstr?ktif akciğer hastalığı enfektif alevlenmelerinde neb?l magnezyum s?lfatın etkinliği
Giriş: Kronik obstr?ktif akciğer hastalığı (KOAH) alevlenmelerinde magnezyum s?lfat (MS) ile yapılan az sayıda klinik ?alışmada ?elişkili sonu?lar elde edilmiştir. Bu ?alışmayı hastanede yatırılarak tedavi edilmesi gereken KOAH alevlenmelerinde neb?l MS tedavisinin yararını incelemeye y?nelik olarak planladık.
Hastalar ve Metod: ?alışmaya dahil edilme kriterlerini karşılayan yirmi hasta randomize olarak iki gruba ayrıldı. T?m hastalara O2, antibiyotik ve oral kortikosteroid tedavileri uygulandı. Neb?l tedavi olarak gruplardan birine g?nde 4 kez 500 ?g ipratropiyum brom?rle (IB) birlikte 151 mg/doz MS, diğerine ise IB ile beraber 2.5 mL salin sol?syonu uygulandı. Hastalar 48 saat boyunca zorlu ekspiratuar vol?m birinci saniye (FEV1) ve viz?el analog skala dispne skorları y?n?nden takip edildiler. Ayrıca her doz neb?l tedavi ?ncesi ve sonrasında 10, 30, 60 ve 120. dakikalarda zirve ekspiratuar akım hızı (PEFR) değerleri ?l??ld?.
Bulgular: Başvurudaki ?zellikler y?n?nden iki grup arasında fark saptanmadı. Her iki grupta da 24 ve 48 saat sonunda ?l??len FEV1 değerlerinde bazal değerlere kıyasla anlamlı artış sağlanamadı. Birinci g?n?n sonunda her iki grupta da, ikinci g?n?n sonunda sadece MS grubunda dispne skorlarında anlamlı d?zelmeler elde edildi. İki grup ilk g?n?n sonunda elde edilen % dispne skoru değişiklikliği y?n?nden kıyaslandığında, neb?l MS tedavisi alan grupta [-%23.8 (13.6)], plasebo grubuna [-%9.4 (12.9)] kıyasla anlamlı ?st?nl?k saptandı (p= 0.002). Birinci g?nde MS grubunda plasebo grubuna kıyasla 10. dakika [4.7 (7.5) ve -3.5 (6.0), p= 0.005] ve 30. dakika [8.2 (6.7) ve 1.3 (5.5), p= 0.03] % PEFR değişiklikleri y?n?nden anlamlı ?st?nl?k tespit edildi. Neb?l MS kullanımına bağlı yan etki saptanmadı.
Sonu?: Ucuz, kolay ulaşılabilir ve g?venilir bir tedavi y?ntemi olan neb?l MS, KOAH alevlenmelerinde hastaların dispne semptomunda d?zelmeye neden olduğundan standart bronkodilat?r tedaviye ek olarak kullanılabilir. Konunun geniş ?aplı randomize kontroll? klinik ?alışmalarda araştırılmaya devam edilmesi gerekmektedir.
Anahtar kelimeler: Kronik obstr?ktif akciğer hastalığı alevlenmeleri, magnezyum s?lfat, neb?l tedavi, viz?el analog skala dispne skoru
SUMMARY
Efficiency of nebulised magnesium sulphate in infective exacerbations of chronic obstructive pulmonary disease
Introduction: Conflicting results has been achieved in a small number of clinical studies evaluating the efficiency of magnesium sulphate (MS) in COPD exacerbations. We aimed to investigate the efficiency of nebulised MS in COPD exacerbations.
Patients and Methods: Twenty patients who met the study criteria were randomized into two groups. All patients were treated with O2, antibiotics and oral corticosteroids. Additionally one group received ipratropium bromide (IB) 500 ?g together with MS 151 mg/dose, while the other group received IB together with placebo. The patients were followed-up with forced expiratory volume in 1 second (FEV1) and visual analogue scale dyspnea scores for 48 hours. Peak expiratory flow rates (PEFRs) were measured before and 10, 30, 60 and 120 minutes after each nebule treatment.
Results: The baseline characteristics of the patients in both groups were similar. The FEV1 values measured at 24 and 48 hours did not show significant changes compared to baseline in both groups. Dyspnea scores in both groups decreased significantly in the first day, and in only MS group in the second day. The % change in the dyspnea score at the end of first day was significantly more in the MS group [-23.8% (13.6)] compared with the placebo group [-9.4% (12.9)] (p= 0.002). The % changes in PEFRs at 10 minutes [4.7 (7.5) and -3.5 (6.0), p= 0.005] and 30 minutes [8.2 (6.7) and 1.3 (5.5), p= 0.03] were significantly greater in the MS group compared with the placebo group on the first day. No side effects developed due to MS.
Conclusion: Nebulised MS is a cheap, feasible and safe drug that can be added to the standart bronchodilator treatment since it provides additional relief of dyspnea in patients with COPD exacerbations. This needs to be evaluated in future clinical studies including greater number of patients.
Key words: Exacerbations of chronic obstructive pulmonary disease, magnesium sulphate, nebule treatment, visual analogue scale dyspnea score
Geliş Tarihi/Received: 18.06.2015 • Kabul Ediliş Tarihi/Accepted: 25.07.2015
GİRİŞ
D?nyada ?l?m nedenleri arasında ???nc? sırada yer alan kronik obstr?ktif akciğer hastalığı (KOAH), ?nemli bir morbidite ve mortalite kaynağıdır. Hastalığın seyri sırasında g?r?lebilecek alevlenmeler, hastaların yaşam kalitelerinde bozulmaya, semptomlar ve akciğer fonksiyonları ?zerinde haftalarca s?rebilecek negatif etkilere, akciğer fonksiyonlarındaki azalmanın hızlanmasına, sağlık harcalamalarında artışa ve belirgin mortaliteye neden olmaktadır (1).??
Sıklıkla infeksiyonlar ve hava kirliliği nedeniyle gelişebilen KOAH alevlenmeleri, hava yollarında artmış inflamatuvar aktivite ve k?t?leşen hava yolu obstr?ksiyonu ile ilişkilidir (2). Alevlenme tedavisinin ana hedefleri, mevcut alevlenmenin yarattığı etkilerin en aza indirgenmesini ve gelecekteki alevlenme riskinin azaltılmasını i?ermektedir. Bug?n i?in KOAH alevlenmelerinin tedavisinde kullanımı genel kabul g?ren ila?lar, kısa etkili bronkodilat?rler, sistemik kortikosteroidler ve antibiyotiklerdir (1). Alevlenmelerinin daha etkili bir bi?imde tedavisine y?nelik yeni modalitelerin geliştirilmesine olan ihtiya? ise halen devam etmektedir.
Magnezyum, kalsiyum aracılıklı bronş d?z kası kasılmasını, kolinerjik sinir u?larından asetilkolin ve mast h?crelerinden histamin salınımını engelleme gibi farklı mekanizmalarla bronkodilat?r etki g?sterebilen bir katyondur (3,4). Magnezyumun solunum kas fonksiyonları ?zerine faydalı etkileri olduğu da saptanmıştır (5). Bug?n i?in uluslararası klavuzlarda intraven?z (IV) yolla uygulanan magnezyum s?lfat (MS)'ın standart medikal tedaviye yanıt alınamayan ağır astım ataklarında ek tedavi y?ntemi olarak kullanılabileceği belirtilmektedir? (6). KOAH alevlenmelerinde kullanımıysa hen?z tavsiye edilmemektedir (1). KOAH alevlenmelerinde MS'nin etkinliğini inceleyen farklı metodolojilerin kullanıldığı az sayıda klinik ?alışmada ?elişkili sonu?lar elde edildiği g?r?lmektedir (Tablo 1).
Neb?l MS, ucuz ve kolay uygulanabilir olması, yan etkilerinin azlığı nedeniyle KOAH alevlenmelerinde ?mit verici yeni bir tedavi y?ntemi olabilir. Bu ?alışmayı hastanede tedavisi gereken KOAH alevlenmelerinde standart medikal tedaviye ek olarak neb?l yoluyla uygulanan MS'nin etkinliğini incelemeye y?nelik olarak planladık.
MATERYAL ve METOD
Hastaların Se?imi
?alışmaya Aralık 2004-Eyl?l 2005 tarihleri arasında İstanbul ?niversitesi İstanbul Tıp Fak?ltesi G?ğ?s Hastalıkları Anabilim Dalı polikliniğine, KOAH tanısı olan [nefes darlığı, kronik ?ks?r?k, balgam ?ıkarma yakınmaları, KOAH risk fakt?rlerine maruziyet ?yk?s?? ve stabil d?nemde dok?mante edilmiş bronkodilat?r sonrası zorlu ekspiratuar vol?m 1. saniye (FEV1)/zorlu vital kapasite (FVC) oranı < %70 olan], Anthonisen kriterlerine g?re infektif KOAH alevlenmesiyle uyumlu semptomlarla (nefes darlığı, balgam miktarı ve balgam p?r?lansında artıştan en az iki tanesinin varlığı) başvuran ve hastaneye yatış kriterlerini taşıyan (solunum sayısı > 25/dakika, nabız > 110/dakika, siyanoz varlığı, yardımcı solunum kaslarının kullanımı, uyuklama, zirve ekspiratuar akım hızı (PEFR)< 100 L/dakika, FEV1 < 1 L, arter kan gazı incelemesinde PaO2< 60 mmHg, PaCO2 ≥ 45 mmHg, SaO2 < %90) hastalar dahil edildiler (12,13,14). Başvuruda t?m hastaların akciğer grafileri ve elektrokardiyografileri değerlendirildi. Yoğun bakım ?nitesine sevk ?l??tlerini veya non-invaziv mekanik ventilasyon (NIMV) uygulanma kriterlerini taşıyan, pn?moni, pulmoner emboli veya pn?motoraks kuşkusu, bilinen ciddi kardiyak, renal, hepatik hastalık ?yk?s?, akciğer grafisinde ş?pheli kitle lezyonu olan, hastaneye başvuru ?ncesindeki d?nemde sistemik kortikosteroid tedavisi alan, kooperasyon g?stermeyen, ağır g?rme kusuru olan ve yazılı onam vermeyen hastalar ?alışma dışında tutuldular (12).
Uygulanan ?l??mler ve Takip Parametreleri
Hastalar 1:1 oranında iki gruba randomize edildiler. Randomizasyondan sonraki değerlendirmede hastaların demografik, KOAH ile ilişkili ve mevcut alevlenmeyle ilişkili ?zellikleri sorgulandı. Vital bulguları ve solunum sistemi bulguları kayıtlandı. Viz?el analog skala (VAS) kullanılarak dispne skorları belirlendi (15). FEV1 ?l??m? i?in "MIR Srl Spirobank" marka el spirometresi, PEFR ?l??m? i?in "Wright" marka zirve ekspiratuar akım hızı ?l?me cihazı kullanıldı. FEV1 ve PEFR ?l??mleri mevcut klavuzlardaki ?l??m tekniklerine uygun bi?imde yapılarak ?? ?l??m i?inden elde edilen en iyi değer kayıtlandı (16). Bazal serum Mg++ d?zeyi ?l??m? i?in hastalardan 5 cc ven?z kan ?rneği alındı. Serum magnezyum d?zeyleri, İstanbul ?niversitesi İstanbul Tıp Fak?ltesi Biyokimya Anabilim Dalı laboratuvarında kolorimetrik y?ntem (Mod?ler sistem-Roche diagnostic) kullanılarak ?l??ld?. Hastaların t?m?ne O2 sat?rasyonlarını %90'nın ?zerinde tutacak şekilde nazal oksijen tedavisi, 32 mg oral metilprednizolon, IV sulbaktam-ampisilin 4 g/g?n veya IV sefuroksim aksetil 1.5 gr/g?n tedavileri uygulandı. Gruplardan birine 500 ?g ipratropiyum brom?r (IB) ile birlikte 2.5 mL izotonik MS (250 mmol/L, 151 mg/doz) uygulanırken, diğer gruba 500 ?g IB ile birlikte 2.5 mL izotonik salin sol?syonu uygulandı. Neb?l tedaviler 6 saat arayla g?nde 4 doz şeklinde, jet neb?lizat?rler yoluyla (Porta-Neb Sidestream, akım hızı= 6 L/dakika, ortalama partik?l b?y?kl?ğ?= 5 mikron) uygulandı. MS neb?l doz ve konsantrasyonu i?in ?nceki bir klinik araştırmalarda kullanılan değerler baz alındı (17). Belirlenen konsantrasyondaki ??zeltiyi hazırlamak i?in MS ampullerin ticari formlarından (1.5 g MS/10 mL, Biofarma?) elde edilen 1 mL MS, 1.5 mL izotonik salin sol?syonu ile seyreltildi. Karışım neb?l tedavi uygulamasından hemen ?nce hazırlanarak bekletilmeden kullanıldı.
Hastaların 48 saat boyunca her neb?l tedavi ?ncesinde ve sonrasında 10, 30, 60 ve 120. dakikada PEFR değerleriyle 10, 30 ve 120. dakikalarda kan basıncı ve nabız değerleri ?l??ld?. Hastalar neb?l tedavi ile ilişkili olabilecek yan etkiler y?n?nden yakın takip altında tutuldular. Randomizasyondan sonraki 24. ve 48. saatte hastaların FEV1, arter kan gazı (PaO2, PaCO2, pH, SaO2), dispne skoru ve serum magnezyum d?zeyi ?l??mleri tekrarlandı. T?m ?l??mler tek bir araştırmacı tarafından yapıldı. Hastalar ve ?l??mleri yapan araştırmacı hastanın hangi grupta yer aldığını bilmiyordu. Hastaların almakta oldukları tedavilere taburculuklarına kadar devam edildi. Mevcut klavuzlara g?re taburculuk kriterlerine ulaşan hastalar hastaneden taburcu edildiler (12).
İstatistiksel Analiz
Grup i?i karşılaştırmalarda "Wilcoxon testi", gruplar arası karşılaştırmalarda ise "Mann-Whitney U test" kullanıldı. Sonu?lar s?rekli değişkenler i?in ortalama [standart sapma (SS)] olarak, kategorik değişkenler i?in ise sayı (%) olarak g?sterildi. İlk g?n ve ikinci g?nde neb?l tedaviler ?ncesi bazal ve sonrasındaki ?l??mler g?nl?k d?rt doz tedavi uygulamalarındaki ?l??mlerin ortalamaları alınarak hesaplandı. p< 0.05 anlamlı kabul edildi.
?alışma i?in İstanbul ?niversitesi İstanbul Tıp Fak?ltesi Yerel Etik Kurulundan onay alındı (Onay no: 855). ?alışmaya katılan t?m hastaların yazılı bilgilendirmiş onam formları alındı.??
BULGULAR
?alışma s?resi boyunca polikliniğimize KOAH infektif alevlenme tanımına uyan toplam 74 hasta başvurdu. Hastaneye yatış ?l??tlerini karşılamayan (n= 22), başvuruda NIMV başlama gereksinimi g?steren (n= 19), akciğer grafisinde pn?monik infiltrasyon (n= 1) ve kitle (n= 1) g?r?nt?s? olan, klinik olarak pulmoner emboli kuşkusu taşıyan (n= 1), ağır kalp yetmezliği ile uyumlu ?yk? ve fizik muayene bulguları olan (n= 3), başvurudan ?nce sistemik kortikosteroid tedavisi başlanmış olan (n= 2), kooperasyon kurulamayan (n= 2), ?alışmaya katılmayı kabul etmeyen (n= 3) hastalar ?alışma dışında tutuldu. ?alışmaya dahil edilen yirmi hastanın 10 tanesi grup 1'e (standart medikal tedavi + neb?l MS), 10 tanesi ise grup 2'ye (standart medikal tedavi + plasebo) randomize edildi. Hastalar başvurudaki ?zellikleri y?n?nden karşılaştırıldığında iki grup arasında anlamlı farklılık saptanmadı (Tablo 2).
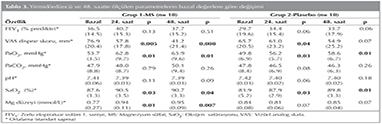
Her iki grupta da 24. ve 48. saatteki FEV1 değerlerinde bazal değerlere g?re anlamlı değişiklik saptanmadı. Her iki grupta da 24. saatteki dispne skorunda bazal değerlere kıyasla anlamlı farklılık tespit edilirken [24. saat ve bazal ortalama (SS) dispne skorları sırasıyla; MS grubu i?in 57.8 (17.8) ve 76.9 (20.4), p= 0.005, plasebo grubu i?in 61.0 (23.2) ve 65.7 (20.5), p= 0.04], 48. saatte sadece MS alan grubun dispne skorunda bazala g?re fark anlamlı bulundu [48. saat ve bazal ortalama (SS) dispne skorları sırasıyla; MS grubu i?in 41.2 (21.4) ve 76.9 (20.4), p= 0.008, plasebo grubu i?in 54.9 (25.2) ve 65.7 (20.5), p= 0.07]. Her iki grupta da 24. ve 48. saatte ?l??len PaO2 ve SaO2 d?zeylerinde bazala g?re anlamlı d?zelmeler saptandı. Yirmi d?rd?nc? ve 48. saatte ?l??len serum? Mg++ d?zeyleri plasebo grubunda bazala g?re anlamlı farklılık g?stermezken, MS grubunda anlamlı olarak y?kseldi (Tablo 3).
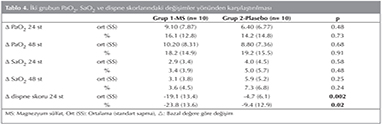
Bazala g?re anlamlı değişiklik g?steren parametreler y?n?nden iki grup arasında yapılan karşılaştırmada, 24. ve 48. saat PaO2 ve SaO2 artışları y?n?nden iki grup arasında anlamlı fark saptanmazken, 24. saatte dispne skorunda bazala g?re değişim MS alan grupta [-19.1 (13.4)],? plasebo alan gruba [-4.7 (6.1)]? kıyasla belirgin olarak fazla bulundu (p= 0.002). Yirmi d?rd?nc? saatte dispne skorundaki d?ş?ş y?zdesi y?n?nden bakıldığında da yine MS alan grupta [-%23.8 (13.6)] plasebo alan gruba [-%9.4 (12.9)] kıyasla belirgin ?st?nl?k saptandı (p= 0.02) (Tablo 4, Şekil 1).
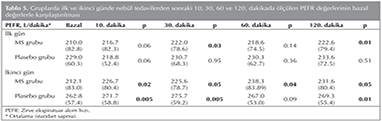
İlk g?nde her doz neb?l tedavi ?ncesinde yapılan bazal PEFR ?l??mlerinin ortalama (SS) değeri MS grubunda 210 (82.8) L/dakika, plasebo grubunda 229 (60.3) L/dakika olarak saptandı. MS grubunda neb?l tedaviler sonrasında 30. dakika [222 (78.6) L/dakika, p= 0.03] ve 120. dakika [222 (79.4) L/dakika, p= 0.01] PEFR değerlerinde bazal PEFR değerine g?re anlamlı artış saptanırken, plasebo alan grupta neb?l tedaviler sonrasındaki PEFR ?l??mleriyle bazal PEFR ?l??m? arasında anlamlı farklılık saptanmadı. İkinci g?ndeki ortalama (SS) bazal PEFR değerleri MS grubunda 212.1 (83.0) L/dakika, plasebo grubunda 262.8 (57.4) L/dakika idi. MS ve plasebo gruplarında sırasıyla neb?l tedaviler sonrasındaki 10. dakika [226.7 (80.4) L/dakika, p= 0.02 ve 271.7 (58.8) L/dakika, p= 0.005], 30. dakika [225.6 (78.7) L/dakika, p= 0.05 ve 275.7 (59.2) L/dakika, p= 0.005] ve 120. dakika [231.6 (80.4) L/dakika, p= 0.05 ve 269.3 (55.4) L/dakika, p= 0.01] PEFR ?l??mlerinde bazal değerlere kıyasla anlamlı artış saptandı (Tablo 5). MS alan grupta neb?l tedaviler sonrasında hastaların kan basıncı ve nabız değerleri anlamlı değişiklik g?stermedi.
İki grup PEFR değerlerinde bazala g?re değişiklik y?n?nden karşılaştırıldığında ilk g?nde MS grubunda plasebo grubuna kıyasla 10. dakika ortalama (SS) PEFR değişikliği [6.7 (10.4) ve -10.5 (13.0), p= 0.007],? 10. dakika % PEFR değişikliği [4.7 (7.5) ve -3.5 (6.0), p= 0.005] ve 30. dakika % PEFR değişikliği [8.2 (6.7) ve? 1.3 (5.5), p= 0.03] y?n?nden anlamlı ?st?nl?k tespit edildi. İkinci g?nde ise PEFR değişiklikleri y?n?nden iki grup arasında anlamlı farklılık saptanmadı (Tablo 6).
Her iki grupta da neb?l tedaviyle ilişkili yan etki saptanmadı. Hastaların hi?birinde non-invaziv veya invaziv mekanik ventilasyon gereksinimi doğmadı. MS alan grup ile plasebo alan grup arasında hastanede yatış s?releri y?n?nden fark saptanmadı [sırasıyla 9.4 (4.8) ve 10.2 (3.9) g?n, p= 0.63].??
TARTIŞMA
Bu ?alışmada hastanede yatırılarak tedavi edilmesi gereken ancak non-invaziv veya invaziv mekanik ventilasyon desteği gerektirmeyen KOAH alevlenmelerinde standart medikal tedaviye ek olarak uygulan neb?l MS'nin etkinliği incelendi. ?alışmanın en ?nemli sonu?ları neb?l MS tedavisinin KOAH alevlenmelerinde FEV1 değişikliği y?n?nden standart medikal tedaviye ek katkı sağlamadığı ancak dispne skorlarında azalma y?n?nden plaseboya kıyasla anlamlı ?st?nl?k g?sterdiğinin saptanmış olmasıdır. Ayrıca ?alışmanın ilk g?n?nde neb?l tedavilerden sonra 10. ve 30. dakika % PEFR değişikliği y?n?nden de MS grubunda ?st?nl?k tespit edilmiştir.
G?n?m?ze değin literat?rde KOAH alevlenmelerinde IV, neb?l veya her iki yolla birlikte uygulanan MS'nin etkinliğini değerlendiren yalnızca beş plasebo kontroll? ?alışma bulunmaktadır (7,8,9,10,11). Bu ?alışmaların ?? tanesinde, MS tedavisinin PEFR ve/veya FEV1 ile ?l??len hava yolu obstr?ksiyonu değişikliği y?n?nden standart medikal tedaviye ek katkı sağlamadığı saptanmıştır (9,10,11). Yalnızca bir ?alışmada 1.2 g IV MS veya plasebo inf?zyonundan? sonra? 30 ve 45. dakikada ?l??len PEFR değerlerinin ortalamasının bazala g?re değişikliği y?n?nden MS grubunda anlamlı ?st?nl?k tespit edilmiştir (7). Diğer bir ?alışmada ise, 1.5 g IV MS inf?zyondan sonra 15, 30 ve 45. dakikalarda ?l??len FEV1 değişiklikleri y?n?nden plaseboya ?st?nl?k saptanmazken, MS veya plasebo sonrasında salbutamol uygulaması yapıldığında elde edilen FEV1 artışının MS grubunda anlamlı olarak daha fazla olduğu g?r?lm?şt?r. Bu durumun, MS tedavisinin beta-2 agonistlerin etkilerini potansiyalize edici etkisiyle ilişkili olabileceği ?ne s?r?lm?şt?r (8).
Mevcut ?alışmaların sadece iki tanesinde hastaların dispne d?zeyindeki değişiklikler değerlendirilmiştir (8,10). Bu ?alışmaların ilkinde 1.2 g IV MS veya plasebo inf?zyonundan sonraki 45. dakikada bazala g?re dispne skorunun değişiminin MS grubunda daha fazla olma eğilimi g?sterdiği saptanmış, ancak fark istatistiksel anlamlılığa ulaşmamıştır (8). Diğer ?alışmada ise 1.5 g IV MS ve ardından d?rt doz neb?l terbutalin ile birlikte neb?l MS alan grupta, 180. dakikada VAS ile ?l??len dispne skoru değişikliğinin, plasebo inf?zyonu sonrasında d?rt doz neb?l terbutalin ile birlikte neb?l IB alan grupla kıyaslanabilir d?zeyde olduğu tespit edilmiştir (10). Bizim ?alışmamızın dispne skorlarının değerlendirildiği ?nceki ?alışmalardan en ?nemli farkı, dispne skorlarının MS tedavisi uygulamasından hemen sonra değil, ?alışmanın 24 ve 48. saatlerinde, son doz neb?l tedaviden sonraki altıncı saatte değerlendirilmiş olmasıdır. Bu şekilde hastaların alevlenme seyri sırasındaki klinik değişimlerini daha iyi yansıtabileceği d?ş?n?lebilir. Her iki grupta da 24. saatte ?l??len dispne skorlarında bazala g?re değişikliğin anlamlı olduğu, ancak MS grubunun plasebo grubuna kıyasla belirgin olarak daha fazla d?zelme g?sterdiği, 48. saatte ise sadece MS grubunun dispne skorunun bazale g?re anlamlı olarak azaldığı tespit edilmiştir. MS grubunda hem 24, hem de 48. saatlerde elde edilen VAS dispne skoru değişikliğinin, kronik akciğer hastalıklarında VAS i?in semptomlarda orta d?zeyde azalmayla ilişkili olduğu kabul edilen skor değişikliğinin (10,11,12,13,14,15,16,17,18,19,20) ?zerinde olduğu g?r?lmektedir (18).
KOAH alevlenmelerinde bronkodilat?rlerin ?zellikle FEV1 değişikliği y?n?nden astım ataklarına benzer ?l??de etki sağlayamadıkları, bununla beraber dispneyi ve arter kan gazı bulgularını d?zeltebildikleri bilinmektedir (19,20). Bu d?zelmeler bronkodilat?rlerin bronş d?z kası ?zerindeki etkilerinin yanı sıra, fonksiyonel rezid?el kapasiteyi azaltma yoluyla hiperinflasyonu ve neticede dinamik hava yolu kompresyonunu d?zeltici etkilerine bağlıdır (21,22). Ek olarak, astım ataklarında tedavi y?netimi i?in PEFR ve FEV1 gibi ekspiratuar hava akım kısıtlılığını ?l?en parametrelerdeki değişimlerin rolleri iyi tanımlanmış olmakla beraber, KOAH alevlenmelerinde spirometrik ?l??mlerde g?r?len değişiklikler değişkenlik g?sterirler. Bu fizyolojik parametrelerdeki iyileşme her zaman semptomlardaki iyileşmeyle birliktelik g?stermez (2).
Magnezyumun solunum kas fonksiyonları ?zerine faydalı etkileri olduğu bilinmektedir (5). Magnezyumun metabolik etkilerini araştırmaya y?nelik olarak y?r?t?len hayvan ?alışmalarında Mg++ uygulamasının dokulara glukoz sunumunu arttırdığı, laktat salınımını azalttığı ve piruvat ?retiminde artışa neden olduğu g?sterilmiştir (23,24,25,26). ATP molek?llerine bağlanan bir kofakt?r olarak? işlev g?ren Mg++, ATP ?retiminin ve glukoz kullanımının artmasını sağlayabilir (27). Stabil KOAH'lı olgularda? Mg++ inf?zyonunun solunum fonksiyonları ?zerindeki etkilerini değerlendiren ?alışmalarda, fonksiyonel rezid?el kapasite ve rezid?el vol?mde azalma, inspiratuar kapasite, maksimum inspiratuar ve ekspiratuar basın?larda artış elde edilebilmiştir. Mg++ inf?zyonu sonrasında stabil KOAH'lı olguların maksimum egzersiz performansında artış sağlanabilmiştir. Bu ?alışmalarda Mg++ inf?zyonunun FEV1, zorlu vital kapasite (FVC), FEV1/FVC oranına ise etki etmediği saptanmıştır (28,29). Bizim ?alışmamız ve KOAH alevlenmelerinde MS'nin etkinliğini değerlendiren ?nceki ?alışmalarda, alevlenme ile başvuran hastada akciğer vol?mlerinin ?l??m?ndeki zorluklar nedeniyle bu ?l??mler yapılamamıştır. Sadece bir ?alışmada 1.2 g MS IV inf?zyonu sonrasında bakılan maksimum inspiratuar ve ekspiratuar basın?larda değişiklik olmadığı g?r?lm?şt?r (7). Ne var ki bu ?alışmada MS alan hastaların bazal serum Mg++ d?zeylerinin [0.94 (0.16) mmol/L] bizim ?alışmamızdaki hastalardan [0.77 (0.27) mmol/L] daha y?ksek olduğu g?r?lmektedir. Dolayısıyla MS inf?zyonu solunum kas g?c?nde artış y?n?nde ek katkı sağlayamamış olabilir.
?alışmamızda MS grubundaki hastaların bazal serum Mg++ d?zeylerinin plasebo grubuyla kıyaslandığında daha d?ş?k olduğu ancak farkın istatistiksel olarak anlamlı olmadığı tespit edildi. MS grubunun bazal serum Mg++ d?zeyinin normal referans laboratuvar değerlerinin (0.8-1.2 mmol/L) biraz altında olduğu ve ?alışmanın 24 ve 48. saatlerinde yapılan ?l??mlerde istatistiksel olarak anlamlı artış g?sterdiği saptandı. Stabil veya alevlenme d?nemindeki KOAH'lı hastalarda hipomagnezeminin sık g?r?ld?ğ? ?nceki ?alışmalarda g?sterilmiş, bu durum steroid ve bronkodilat?r ila?larının kullanımıyla veya diyetteki alımın yetersizliği ile ilişkilendirilmiştir (30,31,32,33). D?ş?k serum Mg++ d?zeyinin artmış KOAH alevlenme riskiyle ilişkili olduğuna işaret eden ?alışmalar da mevcuttur (34,35). Literat?rde neb?l yolla MS uygulamasının serum Mg++ d?zeyine etkisinin incelendiği yalnızca bir ?alışma bulunabilmiştir. Bu ?alışmada 20 dakika arayla 3 kez 384 mg olarak uygulanan MS neb?l sol?syonu sonrasında MS grubundaki serum Mg++? d?zeyi değişikliğinin plasebo grubundan farklı olmadığı tespit edilmiştir (36). Bu bulgunun ?alışmamızda neb?l MS tedavilerinden sonra elde edilen serum Mg++ d?zeyi artışıyla uyumsuz olduğu g?r?lmektedir. ?alışmamızdaki bu bulgunun neb?l MS tedavisiyle mi, yoksa d?zelen nefes darlığı neticesinde diyetteki alımın arttırılması ile mi ilişkili olduğu net olarak s?ylenemez. Bu etkinin standardize diyetlerin uygulandığı kontroll? klinik ?alışmalarda araştırılmaya devam edilmesi gerekmektedir.
Hipo- veya hipertonik sol?syonların neb?l yoluyla uygulanmasının bronş aşırı duyarlılığını tetikleyici ?zelliklerinin olması nedeniyle ?alışmamızda MS neb?l sol?syonu izotonik formda hazırlandı (37). Her bir neb?l tedavi esnasında 151 mg MS uygulandı. Bu doz ?nceki bir astım ?alışması baz alınarak belirlendi (17). KOAH alevlenmelerinde neb?l MS tedavisinin etkinliğinin değerlendirildiği diğer ?alışmalarda da aynı dozun kullanıldığı g?r?lmektedir (9,10). KOAH alevlenmelerinde neb?l MS i?in optimum doz konusunda da hen?z yeterli veri bulunmamaktadır.
?alışmamızın birtakım kısıtlılıkları mevcuttur. Olgu sayısının az olması sonu?ların yorumunu ve net yargılarda bulunulmasını g??leştirmektedir. Non-invaziv veya invaziv mekanik ventilasyon ihtiyacı olan hastalar ?alışmaya dahil edilmemiştir. MS tedavisinin daha ağır astım ataklarında daha etkili olduğu bulgusundan yola ?ıkarak, daha ağır alevlenme ile başvuran ve MS tedavisinden daha fazla yarar g?rebilecek bir grup hastanın değerlendirilmemiş olabileceği s?ylenebilir (38). Akciğer vol?mlerinin ve solunum kas g?c?ne y?nelik ?l??mlerin yapılamamış olması da ?alışmamızın diğer bir dezavantajıdır.?
Sonu? olarak, neb?l yolla uygulanan MS'nin KOAH alevlenmelerindeki etkinliği hen?z net değildir. Ancak ucuz, kolay uygulanabilir ve g?venilir bir tedavi olarak g?r?nen neb?l MS'nin ?zellikle dispne skorlarında d?zelmeye neden olması y?n?nden standart tedaviye ek olarak uygulanması d?ş?n?lebilir. Konunun geniş ?aplı, randomize, kontroll? klinik ?alışmalarda araştırılmaya devam edilmesi gerekmektedir.
?IKAR ?ATIŞMASI
Bildirilmemiştir.
KAYNAKLAR
- The Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD), 2014. http://www.goldcopd.org
- O'Donnell DE, Parker CM. COPD exacerbations. 3: Pathophysiology. Thorax 2006;61:354-61.
- Spivey W, Skobeloff E, Levin R. Effect of magnesium chloride on rabbit bronchial smooth muscle. Ann Emerg Med 1990;19:1107-12.
- del Castillo J, Engbaek L. The nature of the neuromuscular block produced by magnesium. J Physiol 1954;124:370-84.
- Dhingra S, Solven F, Wilson A, McCarthy DS. Hypomagnesemia and respiratory muscle power. Am Rev Respir Dis 1984;129:497-8.
- Global Initiative for Asthma. Global Strategy For Asthma Management And Prevention (GINA), 2014. http://www.ginasthma.org
- Skorodin MS, Tenholder MF, Yetter B, Owen KA, Waller RF, Khandelwahl S, et al. Magnesium sulfate in exacerbations of chronic obstructive pulmonary disease. Arch Intern Med 1995;155:496-500.
- Abreu Gonz?lez J, Hern?ndez Garc?a C, Abreu Gonz?lez P, Mart?n Garc?a C, Jim?nez A. Effect of intravenous magnesium sulfate on chronic obstructive pulmonary disease exacerbations requiring hospitalization: A randomized placebo-controlled trial. Arch Bronconeumol 2006;42:384-7.
- Edwards L, Shirtcliffe P, Wadsworth K, Healy B, Jefferies S, Weatherall M, et al. Use of nebulised magnesium sulphate as an adjuvant in the treatment of acute exacerbations of COPD in adults: A randomised double-blind placebo-controlled trial. Thorax 2013;68:338-43.
- Nouira S, Bouida W, Grissa MH, Beltaief K, Trimech MN, Boubaker H, et al. Magnesium sulfate versus ipratropium bromide in chronic obstructive pulmonary disease exacerbation: a randomized trial. Am J Ther 2014;21:152-8.
- Solooki M, Miri M, Mokhtari M, Valai M, Sistanizad M, Kouchek M. Magnesium sulfate in exacerbations of COPD in patients admitted to internal medicine ward. Iran J Pharm Res 2014;13:1235-9.
- The Global Strategy for the Diagnosis, Management and Prevention of COPD, Global Initiative for Chronic Obstructive Lung Disease (GOLD), 2004. http://www.goldcopd.org
- Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding GK, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106:196-204.
- KOAH ?alışma Grubu. Toraks Derneği kronik obstr?ktif akciğer hastalığı tanı ve tedavi rehberi. Toraks Dergisi 2000;1 (Ek 2).
- Dyspnea. Mechanisms, assessment, and management: a consensus statement. American Thoracic Society. Am J Respir Crit Care Med 1999;159:321-40.
- Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J 2005;26:319-38.
- Hughes R, Goldkorn A, Masoli M, Weatherall M, Burgess C, Beasley R. Use of isotonic nebulised magnesium sulphate as an adjuvant to salbutamol in treatment of severe asthma in adults: randomised placebo-controlled trial. Lancet 2003;36:2114-7.
- Ries AL. Minimally clinically important difference for the UCSD Shortness of Breath Questionnaire, Borg Scale, and Visual Analog Scale. COPD 2005;2:105-10.
- Calverley PMA. Patient selection for COPD therapy. Eur Respir Rev 1999;9:179-83.
- O'Donnell DE. Assessment of bronchodilator efficacy in symptomatic COPD. Chest 2000;117:42S-47S.
- Tantucci C, Duguet A, Similowski T, Zelter M, Derenne JP, Milic-Emili J. Effect of salbutamol on dynamic hyperinflation in chronic obstructive pulmonary disease patients. Eur Respir J 1998;12:799-804.
- Guyatt GH, Townsend M, Pugsley SO, et al. Bronchodilator in chronic air-flow limitation. Effects on airway function, exercise capacity, and quality of life. Am Rev Respir Dis 1987;135:1069-74.
- Chen YJ, Chen HY, Wang MF, Hsu MH, Liang WM, Cheng FC. Effects of magnesium on exercise performance and plasma glucose and lactate concentrations in rats using a novel blood-sampling technique. Appl Physiol Nutr Metab 2009;34:1040-7.
- Cheng SM, Yang DY, Lee CP, Pan HC, Lin MT, Chen SH, et al. Effects of magnesium sulfate on dynamic changes of brain glucose and its metabolites during a short-term forced swimming in gerbils. Eur J Appl Physiol 2007;99:695-9.
- Cheng SM, Yang LL, Chen SH, Hsu MH, Chen IJ, Cheng FC. Magnesium sulfate enhances exercise performance and manipulates dynamic changes in peripheral glucose utilization. Eur J Appl Physiol 2010;108:363-9.
- Cinar V, Mogulkoc R, Baltaci AK, Polat Y. Adrenocorticotropic hormone and cortisol levels in athletes and sedentary subjects at rest and exhaustion:effects of magnesium supplementation. Biol Trace Elem Res 2008;121:215-20.
- Mooren FC, Golf SW, Lechtermann A, V?ler K. Alterations of ionized Mg2+ in human blood after exercise. Life Sci 2005;77:1211-25.
- do Amaral AF, Rodrigues-J?nior AL, Terra Filho J, Vannucchi H, Martinez JA. Effects of acute magnesium loading on pulmonary function of stable COPD patients. Med Sci Monit 2008;14:524-9.
- Amaral AF, Gallo L Jr, Vannucchi H, Cresc?ncio JC, Vianna EO, Martinez JA. The effect of acute magnesium loading on the maximal exercise performance of stable chronic obstructive pulmonary disease patients. Clinics 2012;67:615-22.
- Cerci-Neto A, Ferreira Filho F, Parreira JS. The relative frequency of hypomagnesemia in outpatients with chronic airfl ow limitation treated at a referral center in the north of the state of Parana, Brazil. J Bras Pneumol 2006;32:294-300.
- Ruljancic N, Popovic-Grle S, Rumenjak V, Sokolic B, Malic A, Mihanovic M, et al. COPD: magnesium in the plasma and polymorphonuclear cells of patients during a stable phase. COPD 2007;4:41-7.
- Fiaccadori E, Del Canale S, Coffrini E, Melej R, Vitali P, Guariglia A, et al. Muscle and serum magnesium in pulmonary intensive care units. Crit Care Med 1988;16:751-60.
- Singh JP, Kohli S, Devi A, Mahajan S. Serum magnesium level in COPD patients attending a tertiary hospital-a cross sectional study. JK Science 2012;14:185-9.
- Aziz HS, Blamoun AI, Shubair MK, Ismail MM, DeBari VA, Khan MA. Serum magnesium levels and acute exacerbation of chronic obstructive pulmonary disease:a retrospective study. Ann Clin Lab Sci 2005;35:423-7.
- Bhatt SP, Khandelwal P, Nanda S, Stoltzfus JC, Fioravanti GT. Serum magnesium is an independent predictor of frequent readmissions due to acute exacerbation of chronic obstructive pulmonary disease. Respir Med 2008;102:999-1003.
- Bessmertny O, DiGregorio RV, Cohen H, Becker E, Looney D, Golden J, et al. A randomized clinical trial of nebulized magnesium sulfate in addition to albuterol in the treatment of acute mild-to-moderate asthma exacerbations in adults. Ann Emerg Med 2002;39:585-91.
- Beasley R, Rafferty P, Holgate S. Adverse reactions to the non-drug constituents of nebuliser solutions. Br J Clin Pharmacol 1988;25:283-7.
- Rowe BH, Bretzlaff JA, Bourdon C, Bota GW, Camargo CA Jr. Magnesium sulfate for treating exacerbations of acute asthma in the emergency department. Cochrane? Database Syst Rev 2000;(2):CD001490.
Yazışma Adresi (Address for Correspondence)
Dr. Şule C?MERT
İzmir Tepecik Eğitim ve Araştırma Hastanesi,
Allerji ve Klinik İmm?noloji Kliniği, İZMİR - TURKEY
e-mail: sulesunmez@yahoo.com