REVIEW
Doi: 10.5578/tt.9181
Tuberk Toraks 2015;63(4):278-290

İdiopatik pulmoner fibroziste g?ncel tedavi yaklaşımı
Zehra YAŞAR1, Erdoğan ?ETİNKAYA2
1 Abant İzzet Baysal ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Bolu, T?rkiye
1 Department of Chest Diseases, Faculty of Medicine, Abant Izzet Baysal ?niversity, Bolu, Turkey
2 Yedikule G?ğ?s Hastalıkları ve G?ğ?s Cerrahisi Eğitim ve Araştırma Hastanesi, G?ğ?s Hastalıkları Kliniği, İstanbul, T?rkiye
2 Clinic of Chest Diseases, Yedikule Chest Diseases and Chest Surgery Training and Research Hospital, Istanbul, Turkey
?ZET
İdiopatik pulmoner fibroziste g?ncel tedavi yaklaşımı
İdiopatik intersitisyel fibrozis (İPF), sebebi bilinmeyen ilerleyici, geri d?n?ş?ms?z, histolojik ve radyolojik olarak olağan interstisyel pn?moni ile uyumlu, akciğerlerle sınırlı kronik interstisyel pn?monilerin bir formudur. Etyolojisi tam olarak aydınlatılamamıştır. Hastalığın gelişmesinde rol oynayan risk fakt?rleri sigara, ilerlemiş yaş, ?evresel fakt?rler, viral infeksiyonlar, gastro?sefajiyal refl?, ila? maruziyeti ve genetik fakt?rler olarak sayılabilir. Hastalığın ortalama yaşı 65 olup, erkeklerde kadınlara g?re daha sık g?r?l?r.Etyopatogenezinde daha ?nceleri ?n planda kabul edilen inflamasyon teorisi son yıllarda yerini fibrozisle sonu?lanan yara iyileşmesi teorisine bırakmıştır. Tanı, interstisyel akciğer hastalığının bilinen diğer nedenlerinin dışlanması, y?ksek ??z?n?rl?kl? bilgisayarlı tomografi (Y?BT)'de olağan interstisyel pn?moni (UIP) paterninin g?r?lmesi ve biyopsi uygulanan hastalarda Y?BT ve biyopsi paternlerinin spesifik kombinasyonları ile konulur. Hastalığın şiddeti ve hasta tercihi tedavi yaklaşımının temelini oluşturur. Hastalar semptomlara, radyolojik ve solunum fonksiyon testlerine g?re hafif, orta ve ağır olarak değerlendirilir. Hastalığın seyrinin ?ng?r?lmesi zordur uzun s?ren stabil d?nemden sonra hastanın kliniğini k?t?leştiren alevlenmeler g?r?lebilir. Ortalama median sağkalım 3 yıldır. İleri yaşta tanı alma, sigara kullanımı, d?ş?k v?cut kitle indeksi, yaygın radyolojik tutulum, eşlik eden hastalıklar ve komplikasyonlar (pulmoner hipertansiyon, amfizem, bronkojenik kanser) sağkalımı azaltan nedenlerdir. Tedavide son yıllarda İPF patogenezinde ?ne s?r?len mekanizmalara y?nelik olarak ?zellikle de patolojik yolakta fibroblast birikimi ve myelofibroblastlara d?n?ş?m basamağını hedef alan ila?lar olan pirfenidon ve nintedanib ile yapılan Faz 2 ve 3 ?alışmalarında umut vadeden başarılı sonu?lar bildirilmiştir. Hafif ve orta şiddette İPF olarak değerlendirilen hastalar altta yatan karaciğer hastalığı yoksa ve bu ajanlara ulaşılabiliyorsa ilk tedavi olarak gecikmeden başlanması ?nerilmektedir. Nintedanib ile diare ve karaciğer fonksiyon testlerinde bozulma daha sık izlenirken pirfenidon da bulantı ve d?k?nt? daha sık izlenir. Hasta g?venli klinik ?alışmalara katılmak isterse y?nlendirilmelidir ve ge? kalınmadan transplantasyon programına alınmalıdır.
Anahtar kelimeler: İdiopatik interstisyel fibrozis, g?ncel tedavi
SUMMARY
Current management of idiopathic pulmonary fibrosis
Idiopathic pulmonary fibrosis (IPF) is a progressive, irreversible and eventually fatal chronic interstitial pneumonia limited to the lung and associated with the histological and/or radiological pattern of usual interstitial pneumonia.The mean age of the disease is 65 and it is more frequent in men than women. The disease was historically considered as an inflammatory disease, but currently this has shifted towards a prominent role of impaired wound healing process. The diagnosis of disease requires exclusion of other known causes of interstitial lung disease, the presence of a usual interstitial pneumonia pattern on high -resolution computed tomography (HRCT) in patients or specific combinations of HRCT and surgical lung biopsy patterns. The patients are considered as mild, moderate and severe according to the symptoms, radiological and pulmonary function tests. It is difficult to predict the course of the disease; clinical exacerbation can be seen after a long stable period. Average median survival is approximately 3 years. Advanced age, smoking, low body mass index, widespread radiological involvement, comorbidities and complications (pulmonary hypertension, emphysema, and bronchogenic cancer) are considered as poor prognostic factors. The treatment approach is the basis on the severity of the disease and patient preference. The recent positive result of the pirfenidone and nintedanib phase II and III clinical trials based on the prevailing mechanism of İPF pathogenesis particularly targeted fibroblast activation and myofibroblast differentiation have currently been reported. Initiating therapy with pirfenidone and nintedanib is recommended for the patients with mild and moderate İPF who do not have underlying liver disease and who live in area where these drugs are available. Nausea and rashes are more common in treatment with pirfenidone while diarrhea and deterioration in liver function tests are seen more frequently in nintedanib. The information regarding participation in randomized trials should be given to all patients and also early referral for transplantation should be considered.
Key words: Idiopathic pulmonary fibrosis, treatment
GİRİŞ
İdiopatik interstisyel fibrozis (İPF), sebebi bilinmeyen ilerleyici, geri d?n?ş?ms?z, histolojik ve radyolojik olarak olağan interstisyel pn?moni ile uyumlu, akciğerlerle sınırlı kronik intersitisyel pn?monilerin bir formudur (1). Amerika Birleşik Devletleri (ABD)'nde prevelansı 14-63/100.000 arasında değişirken, Avrupa'da 11.5-26/100.000 olarak bildirilmiştir. Hastaların ortalama yaşı 65 olup erkeklerde kadınlardan daha sık g?r?lmektedir (1,2). Hastalığın prognozu pek ?ok kanserden daha k?t?d?r. Median sağkalım ortalama tanıdan sonra 3 yıldır ve 5 yıllık sağkalım oranı %20-30 olduğu bildirilmektedir (3,4). Sağkalımı azaltan nedenler arasında ileri yaşta tanı alma, sigara kullanımı, d?ş?k v?cut kitle indeksi, yaygın radyolojik tutulum, eşlik eden hastalıklar ve komplikasyonlar (pulmoner hipertansiyon, amfizem, bronkojenik kanser) sayılabilir (5,6,7).
Etyoloji tam olarak aydınlatılamamasına rağmen hastalığın gelişmesinde rol oynayan risk fakt?rleri sigara, ilerlemiş yaş, ?evresel fakt?rler, viral infeksiyonlar, gastro?sefajial refl?, ila? maruziyeti ve genetik fakt?rlerdir. Etyolojide rol oynayabileceği d?ş?n?len saptanmış gen mutasyonları ve polimorfizmler mevcuttur. TERT, TERC, SFTPC, SFTPA mutasyonları ailesel pulmoner fibrozisli olguların %20'sinde saptanmıştır (8,9).
İPF tanısı, intersitisyel akciğer hastalığının bilinen diğer nedenlerinin dışlanması, y?ksek ??z?n?rl?kl? bilgisayarlı tomografi (Y?BT)'de olağan interstisyel pn?moni (UIP) paterninin g?r?lmesi ve biyopsi uygulanan hastalarda Y?BT ve biyopsi paternlerinin spesifik kombinasyonları ile konulur (1). Spesifik olmayan semptomlar, bazı hastalarda tanı i?in invaziv girişimlerin gerekliliği, İPF tecr?besi az olan merkezlerde hastanın takibi tanıyı geciktirebilmekte yanlış tanılarla hastanın takibine yol a?abilmektedir. Tanının erken konması, gereksiz ve hastaya zarar verebilecek tedavilerden ka?ınılması i?in İPF ş?phesi olan hastalar, multidisipliner yaklaşımın yapılabileceği tecr?beli merkezlere y?nlendirilmelidir.
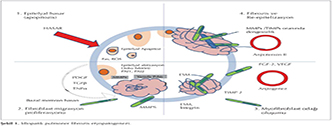
Etyopatogenezinde daha ?nceleri ?n planda kabul edilen inflamasyon teorisi son yıllarda yerini fibrozisle sonu?lanan yara iyileşmesi teorisine bırakmıştır. Tekrarlayan epitelyal hasar alveoler epitel h?crelerini uyarır. Bu h?crelerde fibroblastları aktive ederek proliferasyonlarının ve myofibroblastalara d?n?ş?mlerinin artmasına neden olur. Fibroblastlar ve myelofibroblastlar ekstrasell?ler matriks (ESM) salgılarlar. ESM i?inde fibroblastlar, myelofibroblastlar, makrofajlar ve diğer h?creler prolifere olarak granulasyon dokusunu oluşturur. S?re? normal yara iyileşmesinden ?ıkarak alveoler kollaps ve reepitelizasyon ile fibrozise gider (Şekil 1) (10). Daha ?nce yapılan ?alışmalarda antiinflamatuvar tedavi ile fibrozisin ?nlenmesi ya da sınırlanması beklenirken bu yanıtın alınamaması da bu teoriyi g??lendirmektedir (1,11). Sonu? olarak hava yolu inflamasyonunun bir neden değil fibrozisin bir sonucu olduğu d?ş?n?lmektedir. Araştırmacılar İPF'nin yeni d?nem tedavisinde, antiinflamatuvar ve imm?ns?presif tedavilerden ziyade fibroproliferatif cevabı sınırlayan ve normal alveoler re-epitelizasyonu d?zenleyen ila?lara y?nlenilmesi gerekliliği ?zerinde durmaktadır (10). Bu derlemede İPF'de g?ncel tedavi yaklaşımlarının literat?r eşliğinde g?zden ge?irilmesi ama?lanmıştır.
Genel Yaklaşım
İPF tanılı hastaya uygun yaklaşımın planlanabilmesi i?in ?ncelikle tanının doğruluğundan emin olmak gerekmektedir. Multidisipliner yaklaşımla kılavuzlar doğrultusunda hasta değerlendirilmelidir. İPF'de tedavi se?enekleri sınırlıdır ve tamamen k?r şansı yoktur. Uygun tedavi yaklaşımı i?in hastalığın şiddetini belirlemek ?nemlidir. Hastalığın şiddeti ve hasta tercihi İPF'de tedavi yaklaşımının temelini oluşturur. Hastalar belirli bir evreleme sistemi olmamasına rağmen semptomlara, radyolojik ve solunum fonksiyon testlerine g?re hafif, orta ve ağır olarak değerlendirilir (Tablo 1). Hastalığın seyrinin ?ng?r?lmesi zordur uzun s?ren stabil d?nemden sonra hastanın kliniğini k?t?leştiren akut ataklar izlenebilir. Klinik ?alışmaların tedavi almayan plesebo kollarının incelenmesi ile yıllık FVC kaybının 150-200 mL olduğu bildirilmektedir (12). Hastalığın saptanmasından itibaren klinik gidişi ve hızlı progrese olan hastaları belirlemek, hastalığın şiddeti hakkında bilgi sahibi olmak i?in semptomları, zorlu vital kapasite (FVC)'yi, total akciğer kapasitesi (TLC)'ni, dif?zyon kapasitesi (DLCO)'ni ve oksijenizasyonu d?zenli olarak değerlendirmek gerekir. Tedavi başlangıcında daha sık olmak ?zere tedavi cevabının değerlendirilmesinde 3-6 ay aralarla bu değerlerin takibi ?nerilmektedir (6,13,14,15). Destek tedavi (O2 desteği, pulmoner rehabilitasyon, aşılama, palyatif bakım), medikal tedavi, akciğer transplantasyonu i?in değerlendirme, komplikasyonlar (hipoksemi, pulmoner hipertansiyon, pulmoner emboli) ve komorbiditelerin (KOAH, kalp yetmezliği, OSAS, anksiyete depresyon) tespiti ve tedavisi t?m İPF tanılı hastalarda planlanmalı ve multidisipliner olarak y?netilmelidir.
Destek Tedaviler
İPF tanılı hastalarda tedavinin en ?nemli b?l?m? olup, her hastada ?ncelikle d?ş?n?lmelidir. Hasta tedavi se?enekleri ve prognoz a?ısından mutlaka bilgilendirilmelidir. Hasta ile birlikte tedavi planı yapılmalı, t?m se?enekler tartışılmalıdır. ?zellikle hastalık d?zeyi hafif ve orta d?zeyde olan hastaları iyi d?zenlenmiş g?venli klinik ?alışmalara y?nlendirmek i?in hastayla konuşulmalı ve alternatif olarak sunulmalıdır. Bunun yanında gen? ve komorbiditesi olmayan ağır hastalıkta akciğer transplantasyonu erken d?nemde planlanmalıdır.
Oksijen tedavisi başlangı?ta egzersiz anında daha sonra istirahatte olmak ?zere normal aktivitelerin s?rd?r?lmesini kolaylaştırır ve pulmoner hipertansiyon oluşumunu geciktirir. Semptomlarda iyileşme, yaşam kalitesinde ve egzersiz kapasitesinde artış sağlar. Artan dispne ile hasta rutin g?nl?k aktivitelerini bırakma eğilimindedir. Pulmoner rehabilitasyon İPF'li hastalarda ?nerilmektedir. Pulmoner rehabilitasyon ile dispnede anlamlı azalma ve 6 dakika y?r?me testinde d?zelme bildirilmiştir. Pulmoner rehabilitasyon egzersiz eğitimi, beslenme d?zenlenmesi ve psikolojik destek basamaklarını i?erir (16).
İnfluenza ve pn?mokok aşıları bu infeksiyonlara karşı toleransın azalması nedeni ile ?nerilmelidir. İPF gelişimi ve progresyonunda gastro?sefagial refl? (G?R) ?nemli bir risk fakt?r?d?r. İPF hastalarının % 90'ında tespit edilmiştir (17). ?? randomize ?alışmanın verileri kullanılarak yapılan ?alışmada proton pompa inhibit?r? veya H2 resept?r blok?r? alan hastalarda FVC ve DLCO daki d?ş?ş tedavi almayanlara g?re daha az olarak bildirilmektedir (18). Son d?nem hastada aşırı ?ks?r?k ve dispne i?in opiatlar ve anksiyete i?in anksiyolitikler ?nerilir. Mekanik ventilat?r desteği olabildiğince ertelenmelidir. ??nk? bu hastaların hastane mortaliteleri ?ok y?ksektir ve ventilat?rden ayırma olduk?a zordur (19).
Medikal Tedavi
İPF'de medikal tedavi se?enekleri sınırlıdır. Son yıllara kadar İPF'nin inflamatuvar ve otoimm?n bir hastalık olduğu d?ş?n?ld?ğ? i?in kortikosteroidler, imm?ns?presifler ve sitotoksik ila?lar yeterli kanıtlanmış veriler olmamasına rağmen kullanılmaktaydı. Tedavide kullanılan bir?ok bileşiğin Faz 2 ve 3 ?alışmalarla etkinliğinin olmadığı bildirilmiştir (Tablo 2). Son yıllarda İPF patogenezinde ?ne s?r?len mekanizmalara y?nelik olarak Faz 2 ve 3 ?alışmaları epitel h?cre hasarı ve ?l?m?, imm?n sistem degranulasyonu, fibroblast birikimi ve myelofibroblasta d?n?ş?m?, ESM birikimini gibi anormal yara iyileşmesi komponentlerini hedef alan ajanlar ?zerinde yapılmaktadır (Şekil 1). ?zellikle bu patolojik yolakta fibroblast birikimi ve myelofibroblastlara d?n?ş?m basamağını hedef alan pifenidon ve nintedanibin Faz 2 ve 3 calışmalarında umut vadeden? başarılı sonu?lar bildirilmiştir (20,21,22,23,24,25,26)
Hafif ve orta şiddette İPF olarak değerlendirilen hastalar altta yatan karaciğer hastalığı yoksa ve bu ajanlara ulaşılabiliyorsa ilk tedavi olarak gecikmeden başlanması ?nerilmektedir. İki ajan arasında hangisinin tercih edilmesi gerektiği hakkında yeterli veri bulunmamaktadır. Hasta tercihi ya da yan etkilere tolere edilebilirlik g?z ?n?ne alınarak karar verilebilir. Nintedanib ile diare ve karaciğer fonksiyon testlerinde bozulma daha sık izlenirken pirfenidonda bulantı ve d?k?nt? daha sık izlenir.
Pirfenidon
Pirfenidon veya 5-Methyl-1-phenyl-2-(1H) ağızdan alınabilen antifibrotik, antiinflamatuvar ve antioksidan ?zellikleri hayvan deneyleri ile in vitro ve in vivo g?sterilmiş piridon bileşiğidir. Antifibrotik aktivitesinin TGF-β ve fibroblast b?y?me fakt?r? (bFGF) gibi profibrotik sitokinlerin ?retimini azaltarak kollajen sunumu, sentezi ve birikimini, ekstrasell?ler matriks ?reten h?crelerin inhibisyonunu ve myofibroblastlara d?n?ş?m?n azaltılmasına bağlı olduğu d?ş?n?lmektedir. Ayrıca pirfenidonun antiinflamatuvar ?zelliğinin TNF-α gibi bir?ok proinflamatuvar sitokinleri azaltmasına, antioksidan ?zelliğinin ise oksidatif stresin mod?lasyonuna bağlı olduğu ?zerinde durulmaktadır (27,28,29,30,31,32,33,34,35).
Klinik ?alışmalar
Pirfenidonla ilk ?alışma 54 ciddi fibrozisi olan İPF hastaları ?zerinde yapılmış ve iyi tolere edildiği, solunum fonksiyonlarını stabilize ettiği bildirilmiştir (36). Azuma ve arkadaşlarının yaptığı ?ok merkezli randomize ?ift k?r plasebo kontroll? Faz 2 ?alışmasında %80 ?zerinde SpO2 değerini koruyan subgrupta 6 ve 9 aylık tedavi sonunda 6 dakika y?r?me testinde anlamlı iyileşme g?sterilmiştir. Dokuz aylık tedavi sonunda vital kapasite (VC) ve İPF alevlenmesinde tedavi grubu lehine değişiklik saptanmıştır. Tedavinin etkisinin d?ş?k ve orta şiddette hastalarda daha etkili olabileceği vurgulanmıştır. Plasebo grubunda alevlenme %40 oranında saptanması nedeni ile ?alışma erken sonlandırılmıştır (20). Bunu takip eden Tanguichi ve arkadaşları yaptığı y?ksek doz pirfenidon (1800 mg/g?n), d?ş?k doz pirfenidon (1200 mg/g?n) ve plasebo grubunun olduğu Faz 3 ?alışmada, vital kapasite değişiminde y?ksek doz alan grup ile plasebo arasında 52 haftada anlamlı fark izlenmiştir. İkincil sonlanım noktası olan progresyonsuz sağkalım oranında da anlamlı farklılık bildirilmiştir (25).
Japon ?alışmalarından ?ıkan bu sonu?ların doğrulanması i?in ?ok merkezli, randomize, ?ift k?r, plasebo kontroll? ikiz ?alışma (CAPACITY 004 ve CAPACİTY 006) planlanmıştır. 72 hafta sonunda FVC değişiminin araştırılması planlanmıştır. Hafif-orta şiddette İPF olarak değerlendirilen hastalar (FVC ≥ %50 ve DLCO ≥ %35) ?alışma 004 te 2403 mg/g?n pirfenidon, 1197 mg/g?n pirfenidon ve plasebo, ?alışma 006'da ise 2403 mg/g?n pirfenidon ve plasebo olarak randomize edilmiştir. 72 hafta sonunda ?alışma 004?te y?ksek doz pirfenidon ile plasebo arasında FVC'deki kaybın azaltılmasında anlamlı fark izlenirken 006'da 6 dakika y?r?me testinde kayıpta anlamlı d?zelme izlenmiştir. Bu veriler İPF'de pirfenidonun daha yaygın bir şekilde kullanılmasını destekler nitelikte idi (23). Bu ?alışmaların sonu?ları birlikte değerlendirildiğinde pirfenidonun pleseboya g?re hastalık progresyonunu ve solunum fonksiyonlarındaki kaybı yavaşlattığı sonucuna varıldı. T?m bu ?alışmaların sonu?lar ile Amerikan Gıda ve İla? Dairesi (FDA) pirfenidonun kullanımına izin vermemesine rağmen ila? Japonya, Hindistan ve hafif orta hastalar i?in Avrupa'da? lisans almıştır.
Pirfenidonun uzun d?nem etkisini araştıran a?ık etiketli 603 hastada yapılan RECAP ?alışmasında, y?ksek doz pirfenidonun plaseboyla kıyaslandığında 60. haftada tespit edilen FVC'deki d?ş?ş?n CAPACITY ?alışmasıyla benzer olduğunu bildirilmiştir (21). Pirfenidonun etkisini araştırmada solunum fonksiyon testleri dışında başka parametrelerinde kullanılabileceği ?zerinde durulmuştur. Iwasava ve arkadaşlarının pirfenidonun solunum fonksiyonları ?zerindeki etkisini bilgisayarlı tomografi (BT) bulguları ile karşılaştırdıkları ?alışmada, BT bulgularındaki değişikliklerin VC'deki değişikliklerle korele olduğunu ve BT g?r?nt?lemenin pirfenidonun sonu?larını değerlendirmede yararlı bir ara? olabileceğini bildirmişlerdir (37).
Pirfenidonun etkinlik ve g?veniliğini araştıran ?alışmalar s?rd?r?lm?ş ve ASCEND ?alışmasında 555 hasta 52 hafta 2403 mg/g?n oral pirfenidon ve plasebo almak ?zere randomize edilmiştir. Pirfenidon tedavisi ile bir yıllık FVC'deki d?ş?ş oranının belirgin olarak azaldığı, plasebo ile karşılaştırıldığında FVC'de %10 ve ?zerindeki d?ş?ş?n ve ?l?m oranlarının istatistiksel a?ıdan anlamlı olarak azaldığı bildirilmiştir. 52. haftada plasebo alan grupta FVC'de %10 d?ş?ş saptanmasına karşın pirfenidon alan %23 hastada? FVC kaybı izlenmemiştir. Aynı zamanda ikincil sonlanım noktası olarak belirlenen 6 dakika y?r?me mesafesindeki kaybın azaldığı ve progresyonsuz sağkalımın arttığı fakat dispnede azalmanın izlenmediği bildirilmiştir. CAPACITY ?alışmasının verileri ile birlikte değerlendirildiğinde, pirfenidon ile herhangi bir nedene bağlı ?l?mlerin 52 haftalık değerlendirmede plasebo grubuna g?re daha d?ş?k olduğuda vurgulanmıştır. FDA tarafından bu ?alışmanın olumlu sonu?larının yayınlanmasından sonra kullanımı i?in onay verilmiştir.
Pirfenidondan ?nce hi?bir tedavinin? İPF'de? sağkalımı arttırdığı bildirilmemiştir. FVC'deki %10'luk azalma mortalitenin bir belirteci olduğu bilinmektedir (22,38). Bunun i?in İPF'nin erken tanısı ve tedavinin solunum fonksiyon testlerindeki kayıp ?ok fazla ilerlemeden erken evrede başlanması ?nemlidir. Tedavinin ne kadar devam edileceği konusunda fikir birliği yoktur. Tedavinin hastaya g?re en uygun başlama zamanı ve tedavi s?resi hakkında g?venilir verilere? ve klinik ?alışmalara ihtiya? vardır.
Doz ve uygulama
Pirfenidon, oral alımı, hızlı absorsorbsiyon, y?ksek biyoyararlanım ve geniş bir dağılıma sahiptir. Yemeklerle birlikte alındığında yavaş absorbe olur maksimum plazma konsantrasyonuna 2.5-4 saatte ulaşır (39). Sağlıklı erişkinde yarılanma ?mr? 2.4 saattir. Genel olarak CYP1A2 ile metabolize olur. Oral alınan pirfenidonun %80'i 5-karboksipirfenidon şeklinde, %20'si ise değişmeden 24 saat i?inde atılır. Pirfenidon 40 mg/kg/g?n (g?nde maksimum doz 2403 mg) ?? b?l?nm?ş doz şeklinde, doz titrasyonu yapılarak verilir. İlk hafta g?nde 3 kez 267 mg (1 kaps?l) olarak başlanır, ikinci hafta g?nde 3 kez? 2 kaps?le verilir ve ???nc? hafta 801 mg (3 kaps?l) verilerek tam doza ?ıkılır. Mutlaka ila? yan etkilerini azaltmak i?in yemeklerle beraber alınmalıdır.
Pirfenidon şiddetli ve son d?nem karaciğer yetmezliklerinde kontrendikedir. Hafif ve orta karciğer hastalıklarında %60 oranında ila? konsantrasyonu artacağı i?in dikkatli olunmalıdır. Hafif ve orta d?zeyde renal hastalıklarda doz ayarlanmasına gerek yok iken, kreatin klirensinin 30 mL/dakika'nın altında olduğu renal yetmezliklerde kontrendikedir (40). Ayrıca CYP1A2 inhibit?r? kullanan hastalar toksisite a?ısından yakın takip edilmelidir. Fluvoksamin gibi kuvvetli inhibit?r ajanlarla birlikte kullanımı kontrendikedir. CYP1A2 inhibit?r? ile birlikte kullanımı zorunlu ise pirfenidon dozu 801 mg/g?n'e d?ş?lebilir ve hasta yakın takibe alınır. Ciprofloksasin g?nde 2 doz şeklinde 750 mg verilmesi zorunlu ise, doz 1602 mg/g?n'e d?ş?l?r. Amiodron, propefenon gibi ajanlar kullanıyorsa mutlaka dikkatli olunmalıdır. Rifampisin gibi hem CYP1A2 hem diğer CYP izoenzimleri ile metabolize olan ila?lardan da? m?mk?n olduğunca ka?ınmak gerekmektedir. Sigaranın CYP1A2 ind?kleyici etkisi olduğu i?in tedavi başlamadan ve tedavi s?resince sigara bırakılmalıdır.
Yan etki ve g?venlik
Pirfenidonun klinik g?venliği geniş, ?ift k?r, plasebo kontroll? ?alışmalarda g?sterilmiştir (20,23,25).Valeyre ve arkadaşları pirfenidonun g?venlik profilini 8 yıla kadar tedavi alan 789 hastada ?alışmışlardır. CAPACITY ?alışmasında pirfenidon hastalar tarafından? iyi tolere edilmiştir. Daha ?nce yapılan ?alışmalardan edinilen yan etkilere karşı ?nerilen doz ayarlama stratejileri uygulanarak tedavi devamlılığı sağlanmıştır. En sık izlenen yan etkiler gastrointestinal yan etkiler ve deri reaksiyonlarıdır. Gastrointestinal yan etkileri bulantı (%36), diare (%29), dispepsi (%19) ve kusma (%14) ve cilt reaksiyonları d?k?nt? (%30) ve fotosensitivite (%9)'dir. Bu yan etkiler hafif ve orta şiddette? ve tolere edilebilir nitelikte olup tedavinin erken d?neminde ortaya ?ıktığı ve zamanla gerileme eğiliminde olduğu bildirilmiştir (26). Sadece 6 hasta gastrointestinal sistem (GİS) yan etkisi ve 8 hasta cilt yan etkileri nedeni ile tedaviyi bırakmak zorunda kalmıştır. Hi? bir hasta ciddi yan etkiler ile hastaneye yatarak tedavi almak zorunda kalmadığı belirtilmiştir. Aynı zamanda karaciğer fonksiyon testlerinde? bozukluk pirfenidon kullanan grubun %4'?nde izlenmiştir. Karaciğer fonksiyon testleri tedavi başlangıcında, 6 ay boyunca her ay ve sonrasında 3 ayda bir kontrol edilmelidir (40).
Gis yan etkileri ve y?netimi
Hayvan ?alışmalarında pirfenidonun GİS yan etkilerinin gastrik boşalma ve intestinal ge?iş oranını azaltmasına bağlı olduğu g?sterilmiştir (41). Farelerde yapılan deneylerde bu etkinin prokinetik ajanlarla birlikte alındığında azaldığı bildirilmiştir. Sağlıklı erişkinlerde yapılan ?alışmalarda pirfenidonun yemeklerle birlikte alınmasının GİS yan etkilerini azalttığı ve tolere edilebilirliği arttırdığı g?sterilmiştir.
GİS yan etkilerini azaltmak i?in pirfenidon yemeklerle ?zellikle yemek sırasında tercihen sonrasında alınmalıdır.Tedavinin b?l?nm?ş dozlarda verilmesi pirfenidonun gastrik motilite ?zerindeki inhibit?r etkisini azaltır. Chaudkuri ve arkadaşları yemek başlangıcı, ortası ve sonunda? b?l?nm?ş olarak alınmasının yan etkileri azalttığını bildirmişlerdir (42). Bunun yanında, tolerabiliteyi arttırmak i?in daha uzun zamanda doz titrasyonu yapılabilir. G?nde 3 doz şeklinde 2 haftada yerine 4 haftada istenen doza ?ıkılabilir. T?m bunlara rağmen ila? tolere edilemiyorsa, g?nde 3 doz şeklinde yemekle 1 veya 2 kaps?l olarak doz azaltılabilir. Tolere edilebildiği g?nl?k doza kadar ?ıkılması hedeflenir. Yan etkilerin ?ıktığı zamana g?re de doz ayarı yapılabilir. Mesela bulantı sadece sabah oluyorsa yanlızca sabah dozu d?ş?r?l?r. Hastanın yeme alışkanlıkları da yan etkilerin y?netiminde dikkate alınmalıdır.
GİS yan etkileri doz azaltılmasına rağmen kaybolmuyorsa tedavi hastanın semptomları kaybolana kadar tamamen kesilir. Semptomlar tamamen kaybolduğunda tekrar başlanır ve bazı hastalarda g?nl?k doza daha uzun s?rede ?ıkılacak şekilde tedavi planlanır. Ayrıca domperidon, metoklopromid gibi prokinetik ajanlarda yan etkileri azaltmak i?in kullanılabilir. Metoklopromid maksimum 5 g?n, domperidon s?re kısıtlaması olmadan g?nde 3 kez 10 mg olarak verilebilir (41). Proton pompa inhibit?rleri de yan etkileri azaltmada kullanılabilirler (43).
Cilt yan etkileri
Cilt yan etkileri d?k?nt? ve fotosensitivite olarak v?cudun g?neş g?ren yerlerinde ortaya ?ıkar ve bu ?zelliği ile allerjik reaksiyonlardan ayrılır. CAPACITY ?alışmasında fotosensitivite 3 hastada, d?k?nt? ise 5 hastada tedavinin kesilmesine neden olmuştur (23). İlaca bağlı fotosensitivite reaksiyonları ilacın UVA ve UVB olmak ?zere UV ışınlarını absorbe etmesine bağlıdır. İn vitro ?alışmalar UV ışınların absorbsiyonu ile reaktif oksijen radikallerinin ve lipid peroksidasyonunun ortaya ?ıktığını g?stermiştir (44). Bu yan etkiler UV maruziyeti ve ila? dozu ile orantılı ve ge?icidir. Y?ksek koruma fakt?rl? g?neş koruyucular ile yan etkiler azalabilir. İlacı aldıktan 1-2 saat sonrasına kadar g?neş maruziyetinden ka?ınılmalıdır. Hastaya direkt g?neş ışığından ve fl?resan lambalardan ka?ınması, y?ksek fakt?rl? g?neş koruyucu kullanması, g?neşten koruyucu kıyafet giymesi ve fotosensitivite yapan ajanlardan uzak durması ?nerilmelidir. G?neş g?ren alanlarda y?zeyel ve ağrılı eritemin g?r?ld?ğ?, ?demin, eks?dasyonun olmadığı? hafif ve orta d?zeyde fotosensitivitede semptomlarda kendiliğinden azalma yoksa 7 g?n? veya kızarıklık ge?ene kadar g?nde 3 kez 1 kaps?l verilir. Eğer bulgular kaybolmaz ise 15 g?n tedaviye ara verilir. Semptomlar d?zeldikten sonra tedavi yeniden başlanır istenen ya da tolere edilebilen g?nl?k doza daha uzun zamanda ?ıkılır. Şiddetli reaksiyonlarda semptomlar d?zelene kadar ila? kesilir ve topikal tedavi (g?m?ş s?lfadiazin veya steroidler) kullanılabilir. Yan etkliler tamamen kaybolunca tekrar başlanır basamaklı olarak doz arttırılır. Eğer g?neş ışığına maruz kalınacak d?nem g?n ortasına geliyorsa o doz atlanabilir ya da doz azaltılabilir. Allerjik temelli reaksiyonlarda pirfenidon kalıcı olarak kesilir, antihistaminik ve oral steroid verilir. Bu y?zden allerjik reaksiyonla dikkatli olarak ayrımı yapılmalıdır. T?m alınan ?nlemlere rağmen fotosensitivite oluşuyorsa vit D eksikliğide g?z ?n?nde bulundurulmalı ve uygun hastalarda oral vitamin D takviyesi yapılmalıdır. Yan etki y?netimi Tablo 3'te ?zetlenmektedir.
Hasta eğitimi ve takibi yan etkilerle başa ?ıkılmasını kolaylaştırır ve hastanın tedavi uyumunu ve devamlılığı arttırır. T?m bu kapsamlı ?alışmalar yanında ?ks?r?k ve diğer yaşam kalitesi ?l??tleri ?zerinde pirfenidonun etkisinin araştırıldığı ?alışmalar da devam etmektedir. Dozu ve doz sıklığını azaltabilecek yeni pirfenidon form?lleri hastaların tedavi uyumunu arttırabilir. Trivedi ve arkadaşları pirfenidon nonopartik?llerinin intratrakeal uygulanmasının direkt olarak akciğere ila? verilmesini sağladığını ve pirfenidonun etki ve g?venlik profilini arttırdığını bildirmişlerdir (45). Diğer bir preklinik ?alışmada fareler ?zerinde inhaler olarak uygulanan pirfenidonun azalmış yan etkilerle ilişkili olduğu g?sterilmiştir (46). Tabiki bu bulguların doğrulanabilmesi i?in geniş ?apta klinik ?alışmalara ihtiya? vardır.
Nintedanib (Tirozin kinaz inhibit?r?)
Tirozin kinaz ve resept?rlerinin fibrinogenezde rol oynadıkları bilinmektedir. Kanser tedavisinde değişik tirozin kinaz inhibit?rleri kullanılmıştır (47). Aynı mekanizma ile İPF'de fibroblast proliferasyonunu engelleyerek etkili olabileceği d?ş?n?lerek imatinib mesilat ile yapılan Faz 3 klinik ?alışmada FVC azalması ?zerine? ve survi ?zerine yararlı etkisi g?sterilememiştir (48). Daha sonra Richeldi ve arkadaşları tarafından yapılan TOMORROW ?alışmasında, platelet k?kenli b?y?me fakt?r? resept?r? (PDGFR), vask?ler endotelyal b?y?me fakt?r? resept?r? (VEGFR) ve fibroblast b?y?me fakt?r? resept?r? (FGFR) ?zerine etkili potent bir tirozin kinaz inhibit?r? olan Nintedanib (BIBF 1120)'in İPF tedavisi ?zerindeki yararlı etkileri bildirilmiştir. G?nde 150 mg olarak 2 doz halinde verilmesinin plasebo alan gruba? g?re FVC'deki? azalmayı d?ş?rd?ğ? ve akut atak oranını anlamlı? olarak azalttığı bulunmuştur (49). Ayrıca nintedanibin antifibrotik ve antiinflamatuvar etkisi hayvan modellerinde g?sterilmiş ve in vitro olarak fibroblastların proliferasyonu, myelofibroblastlara d?n?ş?m?n?n inhibe ettiği g?sterilmiştir (49). Bu olumlu sonu?ların doğrulanması i?in planlanan INPULSIS 1 ve INPULSIS 2 ?alışmasında 52 hafta sonunda 150 mg g?nde 2 doz? nintedanib ve plasebo grubu karşılaştırılmıştır (24). Bu iki ?alışmada FVC'deki kaybın plaseboya g?re daha az olduğu g?sterilmiştir. INPULSIS 2 ?alışmasında akut atağa kadar olan s?renin uzadığı bildirilmiştir.
Nintedanib oral olarak g?nde 2 kez 150 mg olarak alınır. Karaciğerde hızla metabolize olur maksimum konsantrasyona 2.5 saatte ulaşır. B?y?k b?l?m? karaciğerde metabolize olurken idrarla ?ok az bir miktarı atılır. CYP 450'den bağımsız olarak metabolize edildiği i?in ila? ekileşimi bildirilmemiştir. P-glikoprotein ve CYP 3A4 inhibit?r ve ind?kleyicileri ile etkileşebilir ve antikoagulanlara bağlı kanama riski artabilir. Karaciğer fonksiyon testleri başlangı?ta, 3 ay boyunca her ay, daha sonra 3 ayda bir veya klinik ş?phe olduğunda istenmelidir. Karaciğer fonksiyon testlerinde y?kseklik saptandığında ila? kesilebilir ya da doz azaltılarak tolerasyon sağlanır.
En sık g?zlenen yan etkiler ishal (%62), bulantı (%24), kusma (%12) ve karaciğer fonksiyon testlerinde y?kselme (%14)'dir. Klinik ?alışmalarda diare hidrasyon ve antidiaretik ila?lar ile tedavi edilmiş ve bazı hastalarda g?nde 2 kez 100 mg olarak doz ayarı yapılmıştır. Bunlara rağmen yan etkiler devam ediyorsa tedavinin sonlandırılması gerekebilir.
Fosfodiesteraz İnhibit?rleri
İleri evre İPF hastaları i?in ?zellikle DLCO < %35, ekokardiografide sağ ventrik?l disfonksiyonu var ise ve fosfodiesteraz inhibit?rleri i?in risk fakt?r? yok ise bu hastalarda fosfodiesteraz inhibit?r? kullanımı d?ş?n?lebilir. İPF ilerledik?e hastaların ?nemli bir kısmında pulmoner hipertansiyon gelişir. PHT fosfodiesteraz inhibit?rleri ile tedavi edildiğinde idiopatik PHT'de olduğu gibi egzersiz toleransında iyileşme bildirilmektedir (50,51). Collard ve arkadaşları yaptıkları ?alışmada 6 dakika y?r?me mesafesinde iyileşme, ortalama 49 metre artış saptandığını bildirmişlerdir (50). İlk doz 20 mg olarak hastanın semptomları, kan basıncı, O2 saturasyonu 60 dakika? monitorize edilerek başlanır ve hasta tolere edebilirse g?nde 3 kez 20 mg dozda tedaviye devam edilir. Uzun s?re kullanımında etkinlik ve g?venilirliğinin saptanması i?in geniş ?aplı ?alışmalara ihtiya? vardır.
TRANSPLANTASYON
İPF akciğer transplantasyonu i?in en sık başvuru nedenlerindendir. Ayrıca İPF transplantasyon bekleme listesinde hayatını kaybeden en sık hasta grubudur. Bunun i?in transplantasyon i?in hasta referansı tanı konulduğu zaman yapılmalıdır. Ayrıca transplantasyon i?in histolojik veya radyolojik olarak UIP paterni olmasının yanında, DLCO < %39, son 6 ayda FVC'deki azalmanın > %10 olması, 6 dakika y?r?me testi boyunca O2 saturasyonunun %88 altına d?şmesi ve HRCT'de bal peteği g?r?n?m?nden birinin olması gerekmektedir (52). Beş yıllık sağkalım oranı yaklaşık %50'dir. Bekleme s?recindeki ge?irilen akut ataklar ve mekanik ventilasyon ?yk?s? transplantasyon sonrası birinci yılda mortaliteyi arttırmaktadır (53).
Tek akciğer transplantasyonu standart prosed?r olarak kabul edilmektedir (54). Diğer akciğerde vask?ler rezistansın armış olması ve transplant yapılmış akciğerin kompliansı az olması nedeni ile ventilasyon ve perf?zyon bu akciğerde olur. Kist, b?l ve bronşektazi bilateral mevcut ise bu akciğer infeksiyon odağı olacağından bilateral akciğer transplantasyonu tercih edilmelidir. Transplantasyon bekleyen hastalarda beklerken gelişen mortaliteleri azaltmak i?in? canlıdan lober akciğer transplantasyonu da d?ş?n?lebilir. Hastada uygulanan lober transplantasyon sonrası? bir hasta dışında sekiz tanesi yaklaşık 10-48 aydır takiptedir (55).
Transplantasyon sonrası bir yıllık takipte bilateral akciğer transplantasyonunda tek taraflı transplantasyona g?re ortalama FEV1 daha y?ksektir. Daha ?nce hastanın steroid kullanmasının transplantasyon sonu?ları ?zerindeki etkisi kesinleşmiş değildir. D?ş?k doz kullanımın sonuca etkisinin olmadığı ancak y?ksek dozların transplantasyon sonrası sağkalımın azalması ile ilişkili olabileceği d?ş?n?lmektedir (56).
İPF AKUT ATA⁄A YAKLAŞIM
İPF tanılı hastalarda infeksiyona, pulmoner ?deme, pn?motoraksa ve kalp yetmezliğine bağlı klinik k?t?leşmeler g?zlenebilir. Aynı zamanda nedeni bilinmeyen akut ataklar izlenebilir ve ataklar k?t? prognozla bağlantılıdır. İPF tanısı ile takip edilen %10-57 hastada? akut atak g?r?lebilir. Viral infeksiyonun etyolojide ?nemli olabileceği d?ş?n?lmektedir. Eğer bu d?nem biyopsi yapılırsa UIP ?zerine s?perpoze olmuş dif?z alveol hasar tespit edilebilir.
Akut atak tanı kriterleri arasında, daha ?nce İPF tanısının olması, 30 g?n i?inde nefes darlığında a?ıklanamayan bir k?t?leşme olması, Y?BT'de balpeteği ve retik?ler g?r?nt? ?zerine eklenmiş yeni bilateral buzlu cam ve/veya konsolidasyonun eklenmesi, endotrakeal aspirasyon ve BAL'da infeksiyon bulgusu olmaması ve diğer nedenlerin dışlanması sayılabilir. Bu kriterleri karşılamıyor ise ş?pheli akut alevlenme olarak tanımlanabilir.
Hasta akut alevlenmede 30 g?nden kısa olmak ?zere nefes darlığında k?t?leşmeden yakınır, ?ks?r?k, ateş, grip benzeri semptomlar g?r?lebillir. En sık izlenen ve gaz alış verişinin bozulduğunu g?steren bulgu PaO2/FIO2? oranının 225 mmHg'nın altında olması ve PaO2'nın %10 veya daha fazla d?ş?ş?d?r. Y?BT'de periferik tutulum iyi prognozu, multifokal tutulum orta ve dif?z tutulum k?t? prognozu g?sterir.
Akut alevlenmeye yol a?an diğer nedenler dışlandıktan sonra hastaya geniş spektrumlu antibiyotik ve y?ksek doz steroid (prednison 1 mg/kg veya metilprednizolon 1-2 gr/g?n)? başlanır. Akut atağı zamanında teşhis etmek ve tedavi planlamak İPF'de mortaliteyi azaltır. Mekanik ventilasyon gerekebilir fakat mortalite oranı y?ksektir.
İPF TEDAVİSİNDE GELECEKTE BEKLENTİLER
İPF patogenezinde ortaya konulan yeniliklerden sonra bu farklı yolakları etkileyen antifibrotik ila? ?alışmaları devam etmektedir (Tablo 4). Bu ?alışmalar sonunda tedavi sonu?larını daha da iyiye g?t?ren pirfenidon ve nintedanibe yeni tedavilerin ekleneceği beklenmektedir. İPF tanısının heterojenitesi g?z ?n?ne alındığında tek bir ajanın tedavide yetersiz kalabileceği d?ş?n?lebilir. Onkolojik ila?larda olduğu gibi patogenez, tanı ve tedavideki gelişmeler sonunda, İPF'de kişiselleştirilmiş tedavilerin g?ndeme geleceği hem tedavi cevabını arttıracağı hemde yan etki ve maliyeti azaltacağı beklenmektedir.
İPF patogenezi? kompleks mekanizmaları i?ermektedir. Hastalığın tanısını, prognozunu ve altta yatan patogenezi ?ng?rd?recek biyomarkerler tedavinin planlanmasında rol oynayabilir. Patogenezde rol oynayan inflamatuvar ve fibrojenik mekanizmaları hedefleyen kombinasyon tedavileri de yakın gelecekte g?ndeme gelecektir.
Sonu? olarak, İPF d?ş?nd?ğ?m?z hastalarda tanı tam olarak netleştirildikten sonra hasta g?venli klinik ?alışmalara katılmak isterse y?nlendirilmelidir. Fonksiyonel parametrelerde kayıp artmadan FEV1 kaybını azaltan? ve? progresyonsuz sağkalımı arttıran ulaşılabileceğimiz kanıtlanmış tedavilerden birini se?erek tedavi başlanmalıdır. Hastayı transplantasyona y?nlendirmek i?in ge? kalınmamalıdır. Komplikasyonlar ve ek hastalıklar multidisipliner bir ekiple değerlendirilmeli, tedaviler d?zenlenmelidir. Pulmoner rehabilitasyon ve hastanın eğitimi İPF tanılı hasta y?netiminin ayrılmaz bir par?asıdır. Gelecekte İPF'de bulunacak olan genetik farklılıklar, hasta subgrupları, etkili olan patofizyolojinin netleşmesi ile uygulanacak kişiselleştirilmiş tedaviler ile k?r sağlanması umut edilmektedir.
KAYNAKLAR
- Raghu G, Collard HR, Egan JJ, Martinez FJ, Behr J, Brown KK, et al. An official ATS/ERS/JRS/ALAT statement: idiopathic pulmonary fibrosis: evidence-based guidelines for diagnosis and management. Am J Respir Crit Care Med 2011;183:788-824.
- American Thoracic Society. Idiopathic pulmonary fibrosis: diagnosis and treatment. International consensus statement. American Thoracic Society (ATS), and the European Respiratory Society (ERS). Am J Respir Crit Care Med 2000;161:646-64.
- Bjoraker JA, Ryu JH, Edwin MK, Myers JL, Tazelaar HD, Schroeder DR, et al. Prognostic significance of histopathologic subsets in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 1998;157:199-203.
- Flaherty KR, Toews GB, Travis WD, Colby TV, Kazerooni EA, Gross BH, et al. Clinical significance of histological classification of idiopathic interstitial pneumonia. Eur Respir J 2002;19:275-83.
- du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al. Ascertainment of individual risk of mortality for patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011;184:459-66.
- King TE Jr, Tooze JA, Schwarz MI, Brown KR, Cherniack RM. Predicting survival in idiopathic pulmonary fibrosis: scoring system and survival model. Am J Respir Crit Care Med 2001;164:1171-81.
- Nadrous HF, Pellikka PA, Krowka MJ, Swanson KL, Chaowalit N, Decker PA, et al. The impact of pulmonary hypertension on survival in patients with idiopathic pulmonary fibrosis. Chest 2005;128(Suppl 6):S616-S7.
- Garcia CK. Idiopathic pulmonary fibrosis: update on genetic discoveries. Proc Am Thorac Soc 2011;8:158-62.
- Lawson WE, Loyd JE, Degryse AL. Genetics in pulmonary fibrosis--familial cases provide clues to the pathogenesis of idiopathic pulmonary fibrosis. Am J Med Sci 2011;341:439-43.
- Selman M, King TE, Pardo A. Idiopathic pulmonary fibrosis: prevailing and evolving hypotheses about its pathogenesis and implications for therapy. Ann Intern Med 2001;134:136-51.
- Maher TM, Wells AU, Laurent GJ. Idiopathic pulmonary fibrosis: multiple causes and multiple mechanisms? Eur Respir J 2007;30:835-9.
- Martinez FJ, Safrin S, Weycker D, Starko KM, Bradford WZ, King TE Jr, et al. The clinical course of patients with idiopathic pulmonary fibrosis. Ann Intern Med 2005;142:963-7.
- du Bois RM, Weycker D, Albera C, Bradford WZ, Costabel U, Kartashov A, et al. Forced vital capacity in patients with idiopathic pulmonary fibrosis: test properties and minimal clinically important difference. Am J Respir Crit Care Med? 2011;184:1382-9.
- Lama VN, Flaherty KR, Toews GB, Colby TV, Travis WD, Long Q, et al. Prognostic value of desaturation during a 6-minute walk test in idiopathic interstitial pneumonia. Am J Respir Crit Care Med 2003;168:1084-90.
- Walter N, Collard HR, King TE Jr. Current perspectives on the treatment of idiopathic pulmonary fibrosis. Proc Am Thorac Soc 2006;3:330-8.
- Spruit MA, Janssen DJ, Franssen FM, Wouters EF. Rehabilitation and palliative care in lung fibrosis. Respirology 2009;14:781-7.
- Raghu G, Freudenberger TD, Yang S, Curtis JR, Spada C, Hayes J, et al. High prevalence of abnormal acid gastro-oesophageal reflux in idiopathic pulmonary fibrosis. Eur Respir J 2006;27:136-42.
- Lee JS, Collard HR, Anstrom KJ, Martinez FJ, Noth I, Roberts RS, et al. Anti-acid treatment and disease progression in idiopathic pulmonary fibrosis: an analysis of data from three randomised controlled trials. Lancet Respir Med 2013;1:369-76.
- Stern JB, Mal H, Groussard O, Brugiere O, Marceau A, Jebrak G, et al. Prognosis of patients with advanced idiopathic pulmonary fibrosis requiring mechanical ventilation for acute respiratory failure. Chest 2001;120:213-9.
- Azuma A, Nukiwa T, Tsuboi E, Suga M, Abe S, Nakata K, et al. Double-blind, placebo-controlled trial of pirfenidone in patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2005;171:1040-7.
- Costabel U, Albera C, Bradford WZ, Hormel P, King TE Jr, Noble PW, et al. Analysis of lung function and survival in RECAP: An open-label extension study of pirfenidone in patients with idiopathic pulmonary fibrosis. Sarcoidosis Vasc Diffuse Lung Dis 2014;31:198-205.
- King TE Jr, Safrin S, Starko KM, Brown KK, Noble PW, Raghu G, et al. Analyses of efficacy end points in a controlled trial of interferon-gamma1b for idiopathic pulmonary fibrosis. Chest 2005;127:171-7.
- Noble PW, Albera C, Bradford WZ, Costabel U, Glassberg MK, Kardatzke D, et al. Pirfenidone in patients with idiopathic pulmonary fibrosis (CAPACITY): two randomised trials. Lancet 2011;377:1760-9.
- Richeldi L, du Bois RM, Raghu G, Azuma A, Brown KK, Costabel U, et al. Efficacy and safety of nintedanib in idiopathic pulmonary fibrosis. N Engl J Med 2014;370:2071-82.
- Taniguchi H, Ebina M, Kondoh Y, Ogura T, Azuma A, Suga M, et al. Pirfenidone in idiopathic pulmonary fibrosis. Eur Respir J 2010;35:821-9.
- Valeyre D, Albera C, Bradford WZ, Costabel U, King TE Jr, Leff JA, et al. Comprehensive assessment of the long-term safety of pirfenidone in patients with idiopathic pulmonary fibrosis. Respirology 2014;19:740-7.
- Carter NJ. Pirfenidone: in idiopathic pulmonary fibrosis. Drugs 2011;71:1721-32.
- Iyer SN, Gurujeyalakshmi G, Giri SN. Effects of pirfenidone on procollagen gene expression at the transcriptional level in bleomycin hamster model of lung fibrosis. J Pharmacol Exp Ther 1999;289:211-8.
- Iyer SN, Hyde DM, Giri SN. Anti-inflammatory effect of pirfenidone in the bleomycin-hamster model of lung inflammation. Inflammation 2000;24:477-91.
- Kakugawa T, Mukae H, Hayashi T, Ishii H, Abe K, Fujii T, et al. Pirfenidone attenuates expression of HSP47 in murine bleomycin-induced pulmonary fibrosis. Eur Respir J 2004;24:57-65.
- Liu H, Drew P, Gaugler AC, Cheng Y, Visner GA. Pirfenidone inhibits lung allograft fibrosis through L-arginine-arginase pathway. Am J Transplant 2005;5:1256-63.
- Nakazato H, Oku H, Yamane S, Tsuruta Y, Suzuki R. A novel anti-fibrotic agent pirfenidone suppresses tumor necrosis factor-alpha at the translational level. Eur J Pharmacol 2002;446:177-85.
- Oku H, Nakazato H, Horikawa T, Tsuruta Y, Suzuki R. Pirfenidone suppresses tumor necrosis factor-alpha, enhances interleukin-10 and protects mice from endotoxic shock. Eur J Pharmacol 2002;446:167-76.
- Oku H, Shimizu T, Kawabata T, Nagira M, Hikita I, Ueyama A, et al. Antifibrotic action of pirfenidone and prednisolone: different effects on pulmonary cytokines and growth factors in bleomycin-induced murine pulmonary fibrosis. Eur J Pharmacol 2008;590:400-8.
- Zhou H, Latham CW, Zander DS, Margolin SB, Visner GA. Pirfenidone inhibits obliterative airway disease in mouse tracheal allografts. J Heart Lung Transplant 2005;24:1577-85.
- Raghu G, Johnson WC, Lockhart D, Mageto Y. Treatment of idiopathic pulmonary fibrosis with a new antifibrotic agent, pirfenidone: results of a prospective, open-label Phase II study. Am J Respir Crit Care Med 1999;159:1061-9.
- Iwasawa T, Ogura T, Sakai F, Kanauchi T, Komagata T, Baba T, et al. CT analysis of the effect of pirfenidone in patients with idiopathic pulmonary fibrosis. Eur J Radiol 2014;83:32-8.
- Collard HR, King TE Jr, Bartelson BB, Vourlekis JS, Schwarz MI, Brown KK. Changes in clinical and physiologic variables predict survival in idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2003;168:538-42.
- Rubino CM, Bhavnani SM, Ambrose PG, Forrest A, Loutit JS. Effect of food and antacids on the pharmacokinetics of pirfenidone in older healthy adults. Pulm Pharmacol Ther 2009;22:279-85.
- European Medicine Agency. Esbriet? (pirfenidone) Summary of product characteristics. http://www.ema.europa.eu/docs/en_GB/document_library/EPAR_-Product_Information/human/002154/WC500103049.pdf (last accessed Feb 2014).
- Itoh T KK, Morimoto A. Ameliorative effects of mosapride or Rikkunshi to on the suppression of gastrointestinal motility by pirfenidone in rats. Jpn Pharmacol Ther 2012;45:405-11.
- Chaudhuri N, Duck A, Frank R, Holme J, Leonard C. Real world experiences: pirfenidone is well tolerated in patients with idiopathic pulmonary fibrosis. Respir Med 2014;108:224-6.
- Lee JS, Ryu JH, Elicker BM, Lydell CP, Jones KD, Wolters PJ, et al. Gastroesophageal reflux therapy is associated with longer survival in patients with idiopathic pulmonary fibrosis. Am J Respir Crit Care Med 2011;184:1390-4.
- Seto Y, Inoue R, Kato M, Yamada S, Onoue S. Photosafety assessments on pirfenidone: photochemical, photobiological, and pharmacokinetic characterization. J Photochem Photobiol B 2013;120:44-51.
- Trivedi R, Redente EF, Thakur A, Riches DW, Kompella UB. Local delivery of biodegradable pirfenidone nanoparticles ameliorates bleomycin-induced pulmonary fibrosis in mice. Nanotechnology 2012;23:505101.
- Onoue S, Yamada S. Pirfenidone in respirable powder form for the treatment of pulmonary fibrosis: a safer alternative to the current oral delivery system? Ther Deliv 2013;4:887-9.
- Grimminger F, Schermuly RT, Ghofrani HA. Targeting non-malignant disorders with tyrosine kinase inhibitors. Nat Rev Drug Discov 2010;9:956-70.
- Daniels CE, Lasky JA, Limper AH, Mieras K, Gabor E, Schroeder DR. Imatinib treatment for idiopathic pulmonary fibrosis: Randomized placebo-controlled trial results. Am J Respir Crit Care Med 2010;181:604-10.
- Richeldi L, Costabel U, Selman M, Kim DS, Hansell DM, Nicholson AG, et al. Efficacy of a tyrosine kinase inhibitor in idiopathic pulmonary fibrosis. N Engl J Med 2011;365:1079-87.
- Collard HR, Anstrom KJ, Schwarz MI, Zisman DA. Sildenafil improves walk distance in idiopathic pulmonary fibrosis. Chest 2007;131:897-9.
- Jackson RM, Glassberg MK, Ramos CF, Bejarano PA, Butrous G, Gomez-Marin O. Sildenafil therapy and exercise tolerance in idiopathic pulmonary fibrosis. Lung 2010;188:115-23.
- Orens JB, Estenne M, Arcasoy S, Conte JV, Corris P, Egan JJ, et al. International guidelines for the selection of lung transplant candidates: 2006 update--a consensus report from the Pulmonary Scientific Council of the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2006;25:745-55.
- Weiss ES, Allen JG, Merlo CA, Conte JV, Shah AS. Lung allocation score predicts survival in lung transplantation patients with pulmonary fibrosis. Ann Thorac Surg 2009;88:1757-64.
- Yusen RD, Edwards LB, Kucheryavaya AY, Benden C, Dipchand AI, Dobbels F, et al. The registry of the International Society for Heart and Lung Transplantation: thirty-first adult lung and heart-lung transplant report--2014; focus theme: retransplantation. J Heart Lung Transplant 2014;33:1009-24.
- Date H, Tanimoto Y, Goto K, Yamadori I, Aoe M, Sano Y, et al. A new treatment strategy for advanced idiopathic interstitial pneumonia: living-donor lobar lung transplantation. Chest 2005;128:1364-70.
- McAnally KJ, Valentine VG, LaPlace SG, McFadden PM, Seoane L, Taylor DE. Effect of pre-transplantation prednisone on survival after lung transplantation. J Heart Lung Transplant 2006;25:67-74.
Yazışma Adresi (Address for Correspondence)
Dr. Zehra yaŞar
Abant İzzet Baysal ?niversitesi Tıp Fak?ltesi,
G?ğ?s Hastalıkları Anabilim Dalı,
BOLU - TURKEY
e-mail: zehraasuk@hotmail.com