REVIEW
Doi: 10.5578/tt.9885
Tuberk Toraks 2015;63(4):265-277

Astım-KOAH overlap Sendromu
Elif ŞEN1, Kıvılcım OĞUZ?LGEN2, Sevim BAVBEK3, Hakan G?NEN4, Esen KIYAN5, Haluk T?RKTAŞ2, Arzu YORGANCIOĞLU6, Mehmet POLATLI7, F?sun YILDIZ8, G?lfem ?ELİK3, Tun?alp DEMİR9, Bilun GEMİCİOĞLU9, Dilşad MUNGAN3, Sevgi SARYAL1, Abdullah SAYINER10, Nurhayat YILDIRIM9
1 Ankara ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Ankara, T?rkiye
1 Department of Chest Diseases, Faculty of Medicine, Ankara University, Ankara, Turkey
2 Gazi ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Ankara, T?rkiye
2 Department of Chest Diseases, Faculty of Medicine, Gazi University, Ankara, Turkey
3 Ankara ?niversitesi Tıp Fak?ltesi, İmm?noloji ve Allerji Bilim Dalı Ankara, T?rkiye
3 Division of Immunology and Allergy, Faculty of Medicine, Ankara University, Ankara, Turkey
4 S?reyyapaşa G?ğ?s Hastalıkları ve G?ğ?s Cerrahisi Eğitim ve Araştırma Hastanesi, G?ğ?s Hastalıkları Kliniği,
İstanbul, T?rkiye
4 Clinic of Chest Diseases, Sureyyapasa Chest Diseases and Chest Surgery Training and Research Hospital,
Istanbul, Turkey
5 İstanbul ?niversitesi İstanbul Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, İstanbul, T?rkiye
5 Department of Chest Diseases, Faculty of Istanbul Medicine, Istanbul University, Istanbul, Turkey
6 Celal Bayar ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Manisa, T?rkiye
6 Department of Chest Diseases, Faculty of Medicine, Celal Bayar University, Manisa, Turkey
7 Adnan Menderes ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Aydın, T?rkiye
7 Department of Chest Diseases, Faculty of Medicine, Adnan Menderes University, Aydın, Turkey
8 Kocaeli ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, Kocaeli, T?rkiye
8 Department of Chest Diseases, Faculty of Medicine, Kocaeli University, Kocaeli, Turkey
9 İstanbul ?niversitesi Cerrahpaşa Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, İstanbul, T?rkiye
9 Department of Chest Diseases, Faculty of? Cerrahpasa Medicine, Istanbul University, Istanbul, Turkey
10 Ege ?niversitesi Tıp Fak?ltesi, G?ğ?s Hastalıkları Anabilim Dalı, İzmir, T?rkiye
10 Department of Chest Diseases, Faculty of Medicine, Ege University, Izmir, Turkey
?ZET
Astım-KOAH overlap sendromu
Astım ve kronik obstr?ktif akciğer hastalığı (KOAH), kronik hava yolu inflamasyonu ve hava yolu obstr?ksiyonu ile karakterize olan ve toplumda sık g?r?len akciğer hastalıklarıdır. KOAH ve astımlı olgular arasında her iki hastalık i?in hava yolu inflamasyonunun ve dolayısıyla klinik, fonksiyonel ?zelliklerin ?rt?şt?ğ? "Astım-KOAH Overlap Sendromu" (AKOS) olarak tanımlanan hastalar bulunmaktadır. AKOS; persistan hava akımı kısıtlaması (postbronkodilat?r FEV1/FVC < %70) ve reverzibilite ile karakterize, hem astım hem KOAH'ın bazı ?zelliklerini taşıyan bir sendromdur. Kırk yaş ?zeri, sigara i?miş ve ?ocukluğunda astım ?yk?s? veya doktor tanılı astımı olan ve persistan hava akımı kısıtlaması ile birlikte reverzibl hava yolu obst?ksiyonu (400 mcg salbutamol veya 1000 mcg terbutalin inhalasyonu sonrasında FEV1'de bazal değere g?re > %12 ve > 200 mL artış) olan hastada AKOS d?ş?n?lmelidir. AKOS prevalansı farklı hasta serilerinde %11-55 oranlarında bildirilmektedir. Yaşla birlikte AKOS oranı artmakta ve her yaş diliminde kadınlarda daha sık g?r?lmektedir. AKOS'lu hastaların; KOAH'a g?re gen? ama astıma g?re daha ileri yaşta hastalar olduğu ve daha semptomatik oldukları g?sterilmiştir. Sık ve ağır atak ge?irme, bu nedenle hastaneye yatış veya acile başvuru AKOS'ta sıktır ve bu durum hastaların yaşam kalitelerini olumsuz y?nde etkilemektedir. Rehberlerde AKOS'un farmakolojik tedavisi astım ve KOAH i?in var olan en uygun tedavi se?eneklerinin kombinasyonundan oluşmaktadır. Gelecekte ortaya ?ıkacak tedaviler endotipe dayalı olmalıdır. Klinik fenotip ve altta yatan endotipe y?nelik yapılacak klinik ?alışmalar gelecekte yazılacak AKOS rehberlerinin temelini oluşturacaktır.
Anahtar kelimeler: Astım-KOAH overlap sendromu, tanı, rehberler, tedavi
SUMMARY
Asthma-COPD overlap syndrome
Asthma and chronic obstructive pulmonary disease (COPD) are common lung diseases characterized by chronic airway inflammation and airway obstruction. Among patient with COPD and asthma; there is a group of patients with an overlap between clinical, functional characteristics and airway inflammation patterns, named "Asthma-COPD Overlap Syndrome" (ACOS). ACOS is a syndrome characterized by reversible but persistant airflow limitation (postbronchodilator FEV1/FVC < 70%) which has some features of both asthma and COPD. ACOS should be suspected in a patient > 40 years, with smoking history, previous asthma diagnosis or history of childhood asthma who has persistant airflow limitation and reversible ariway obstruction (defined by an increase of? > %12 of FEV1 pred or increase of FEV1 > 200 mL after inhalation of 400 mcg salbutamol or 1000 mcg terbutaline). The prevalence for ACOS has been reported 11-55% in different case series to date and increases by age and is more frequent in females in different age groups. Patients with ACOS are younger than COPD patients and older than asthma patients. Frequent and severe exacerbations and related hospitalization and emergency room visits are common in ACOS and this causes an impaired quality of life. Current recommendations of guidelines for pharmacologic treatment of ACOS have been composed of a combination with optimal COPD and asthma treatment. Future therapeutic approaches should be based on endotypes. Clinical phenotype and underlying endotype driven clinical studies may be the base of ACOS guidelines.
Key words: Asthma-COPD overlap syndrome, diagnosis, guidelines, treatment
GİRİŞ
Astım ve kronik obstr?ktif akciğer hastalığı (KOAH), kronik hava yolu inflamasyonu ve hava yolu obstr?ksiyonu ile karakterize olan ve toplumda sık g?r?len akciğer hastalıklarıdır. Hava yolu obstr?ksiyonu; astımda değişken, KOAH'ta ise ilerleyici olup persistan niteliktedir. Ancak kronik hava yolu hastalıklarına ait semptomlarla başvuran hastaların bir kısmı klinik olarak hem astım hem de KOAH ?zelliklerini taşımaktadır. Ayrıca her iki hastalıkta patolojik ve fonksiyonel olarak ?rt?şen ?zellikler bulunmaktadır (1,2). Bu ?zellikleri taşıyan hastaların tanımlanması gereksinimi ile "Astım-KOAH Overlap Sendromu" (AKOS) kavramı oluşmuştur. Kavramın ortaya ?ıkışı ve tanımlanmasına rağmen, tedavi yaklaşımında her iki hastalığa ?zg? klinik araştırmalarda, AKOS ?zelliklerine sahip hastaların metodolojik olarak dışlanması nedeniyle kanıta dayalı ?neriler yapılması i?in yeterli veri yoktur.
Bu derlemenin amacı kronik obstr?ktif hava yolu hastalığı spektrumunda varlığı her zaman bilinen, ancak yakın zamanda yeni bir kavram olarak g?ndeme gelen AKOS'u t?m y?nleriyle ve g?ncel bilgiler ışığında ele almaktır. Bu nedenle ?ncelikle genel tanımlar, ardından AKOS tanımı, genetik ?zellikler, epidemiyolojisi, risk fakt?rleri ve patogenez, klinik ?zellikler, tanısal incelemeler, inflamasyon ve biyobelirte?lerden s?z edilecektir. Son olarak da uluslararası rehberlerin AKOS'a bakışı ve tedavi yaklaşımları tartışılacaktır.
Genel TanImlar
Overlap: S?zl?k anlamı iki şeyin kısmen ?rt?şmesi veya ortak noktalarının/alanlarının olmasıdır. Tıp literat?r?nde overlap sendromunun net bir tanımı yoktur. Solunum sistemi hastalıklarında overlap sendromu i?in en sık rastlanan ?rnekler; KOAH-obstruktif uyku apne birlikteliği ve astım-KOAH overlap sendromudur (3,4).
Komorbidite: Bir kişide iki veya daha fazla bozukluk/hastalık olması başka bir deyişle primer hastalığa eşlik eden en az bir hastalık veya bozukluğun olmasıdır. Hastalıklar aynı zamanda olabilir veya biri diğerini takip edebilir (5).
Komorbidite varlığında klinik daha ağırdır, yaşam kalitesi daha k?t?d?r, tedavi daha zordur, sağlık harcamaları daha fazladır ve mortalite daha y?ksektir. Komorbidite y?k? ?eşitli indekslerle (Charlson komorbidite indeksi, COTE indeksi gibi) değerlendirilebilir (6).
Fenotip: Bir hastalığın izlenebilir, g?zlenebilir ve ?l??lebilir morfolojik, gelişimsel, biyokimyasal ve fizyolojik ?zellikleridir. Fenotip, genetik ?zelliklerin ?evresel fakt?rlerle etkileşimiyle oluşur. Fenotipler; sıklıkla semptomlara, fizyolojik ?zelliklere, radyolojik bulgulara veya biyobelirte?lere g?re belirlenmiştir. En iyi tanımlanmış fenotipler astım fenotipleridir (7). Literat?rde astım fenotipleri klinik ?zelliklere (yaş, hastalık ağırlığı, v?cut kitle indeksi, başlangı? zamanı, reverzibilite), tetikleyicilere (allerjen, aspirin, egzersiz, meslek, menstruasyon) ve patolojik ?zelliklere (eozinofilik, n?trofilik, pausi-granulositik) g?re tanımlanmıştır. KOAH'ta da fenotipleme ?alışmaları vardır ancak astımdaki kadar net tanımlanmamıştır (8).
Endotip: Bir hastalığın farklı fonksiyonel veya patobiyolojik/patofizyolojik mekanizmalarla tanımlanmış alt grubudur (9,10). Endotipler fenotip k?meleri i?erisinde yer alır.
Fenotipler klinik ?zelliklere g?re, endotipler mekanizmalara g?re oluşturulan alt gruplardır. Astımda endotiplerle ilgili bir?ok ?alışma olmasına karşın KOAH?ta endotipler hen?z ?alışılmamıştır (11).
TanImI ve Epİdemİyolojİsİ
AKOS son yıllarda ?zerinde en ?ok tartışılan obstr?ktif akciğer hastalığı fenotiplerinden birisi haline gelmiştir. Bununla birlikte AKOS'un tanımı ?zerinde fikir birliği hen?z oluşmamıştır. AKOS i?in, Astım&KOAH fenotipi, spastik bronşit, mikst KOAH&Astım, fiks hava yolu obst?ksiyonlu astım, astmatik komponenti olan KOAH, eozinofilik KOAH fenotipi, hiperreaktif KOAH fenotipi gibi değişik tanımlamalar ?nerilmiştir.
AKOS; persistan hava akımı kısıtlaması (postbronkodilat?r FEV1/FVC< %70)? ile karakterize, hem astım hem KOAH'ın bazı ?zelliklerini taşıyan bir sendromdur (1). Yani, 40 yaş ?zeri, sigara ?yk?s? olan, ?ocukluğunda astım ?yk?s? veya doktor tanılı astımı olan ve persistan hava akımı kısıtlaması ile birlikte, reverzibl hava yolu obstr?ksiyonu olan hastada AKOS d?ş?n?lmelidir (12).
AKOS'un, astımın KOAH ?zellikleri kazanması sonucu mu oluştuğu, KOAH'ta astım ?zelliklerinin de bulunması mı olduğu veya AKOS'un en başından itibaren AKOS olarak mı ortaya ?ıktığı gibi konular tartışılmaktadır.
"AKOS" tanımlaması rehberlerde 2000'li yılların başında kullanılmaya başlanmıştır. Avusturalya-Yeni Zelanda G?ğ?s Derneklerinin, Kanada G?ğ?s Derneğinin, Japon Solunum Derneği'nin rehberlerinde konuya değinilmiş, İspanyol G?ğ?s Hastalıkları ve G?ğ?s Cerrahisi Derneğinin 2014 KOAH Rehberi (GesEPOC)'nde daha geniş olarak vurgulanmış ve ana tedavi şeması ve algoritmasında yer almıştır (13,14,15,16).
AKOS ilk defa GINA ve GOLD 2014 rehberlerinde objektif olarak "persistan hava akımı kısıtlaması olan olgularda astım ve KOAH ?zelliklerinin birbirine yakın oranlarda eşlik etmesidir" şeklinde tanımlanmış ve tanı i?in kriterler belirlenmiştir (Tablo 1).
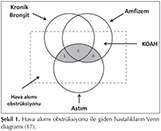
Hava akımı kısıtlaması ile seyreden hastalıklar Şekil 1'de Venn diyagramı ile g?sterildiğinde AKOS'lu hastalar, 1,2,3 nolu alanlara uymaktadır (17). Başka bir anlatımla; persistan hava akımı kısıtlaması g?steren, aynı zamanda? kronik bronşit ve amfizemden biri ya da ikisi olan astımlılar ile değişkenlik ve bronş hiperreaktivitesi (BHR) g?steren KOAH'lılar bu gruba girmektedir. GINA-GOLD ortak kılavuzunda da astım veya KOAH ?zelliklerinden benzer sayıda ?zelliğe sahip olanların AKOS olarak tanımlanabileceği belirtilmektedir (Tablo 1) (1).
Değişik serilerde AKOS prevalansı %11-55 oranlarında bildirmektedir. Gene environment interactions in respiratory diseases (GEIRD) ?alışmasında (n=8360); doktor tanılı astım-KOAH overlap oranı 20-44 yaş arasında %1.6, 45-64 yaş aralığında %2.1 ve 65-84 yaş arasında %4.5'tir. Her yaş diliminde kadınlarda daha sık bulunmuştur (OR:1.63; 95% CI: 1.15?2.31)? (18). KOAH'ın genetik temeli ve fenotiplerini araştıran ?ok merkezli COPD Gene ?alışmasına alınan 915 KOAH'lı hasta i?inde 119 (%13) olgu AKOS olarak tanımlanmıştır? (19). İki yıl sonra yapılan? ?ok merkezli, kesitsel, ilk pop?lasyon ?alışmasında 3885 kişi arasında spirometrik ?l??mler ve ?yk?ye dayanarak? olguların %17.4'?ne AKOS tanısı konmuştur? (20). Soriano'nun ?alışmasında ise 50-59 yaş arasında %23, 70-79 yaş arasında %52 oranı verilmektedir (17). The UC Davis Asthma Network (UCAN) ağır astım kliniğinde AKOS prevalansı ağır astım olgularının yarısı kadardır (%24.3 vs %52.9, p = 0.0009), astımlı hastalar da ortalama yaş 51.3 iken, KOAH'lılarda 72.4, AKOS i?in 66.7'dir. Yaşla birlikte AKOS oranı artmaktadır (21).
Risk Fakt?rleri ve Patogenez
Astım, KOAH ve AKOS gibi kronik hava yolu hastalıkları genetik ve ?evresel risk fakt?rlerinin etkileşimi sonrası oluşur. Akciğerlerin uygun ve yeterli gelişmemesi bu hastalıklar i?in en başta gelen risk fakt?rlerinden biridir. Akciğerler insanlarda fetusun d?rd?nc? haftasından itibaren belirmeye başlar, ?nce fetal iletici hava yolları, sonra k???k hava yolları ve daha sonra da alveoller gelişir. Akciğerlerin gelişimi postnatal d?nemde de devam ederek yedi yaşlarında tamamlanır, hatta ergenliğe kadar devam edebilir. Akciğerlerin bu gelişim s?resince maruz kaldıkları risk fakt?rleri; gebe annenin sigara i?mesi, premat?r doğum, d?ş?k doğum ağırlığı, erken doğum gibi "prenatal" ve ?ocukluk ?ağı infeksiyonları, beslenme bozuklukları, ?evresel sigara maruziyeti gibi "postnatal" risk fakt?rleri akciğerlerin tam gelişimini engeller. D?ş?k solunum fonksiyonları ile erişkinliğe ulaşan kişilerde; sigara, hava kirliliği, allerjenler gibi ?evresel risk fakt?rleri ile karşılaşmanın zaten d?ş?k olan solunum fonksiyonlarında hızlı azalmalara neden olduğu g?sterilmiştir. Bu durum kronik hava yolu hastalıklarının klinik bulgularının ortaya ?ıkması ile sonu?lanır (22,23,24).
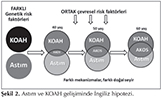
Ortak risk fakt?rleri ile karşılaşılmasına rağmen neden bazı kişilerde astım, bazılarında KOAH? ya da bir kısmında AKOS ortaya ?ıktığı net bilinmemekte olup, iki farklı hipotez ile bu durum a?ıklanmaya ?alışılmaktadır: Bunlar Hollanda (Dutch) hipotezi ve İngiliz hipotezidir. Dutch hipotezine g?re astım, KOAH, AKOS hepsi tek bir hastalıktan k?ken almaktadır ve tablo "kronik nonspesifik akciğer hastalığı" olarak tanımlanmaktadır (25). Her ?? hastalığın genetik alt yapısının ortak olduğu ve ?evresel risk fakt?rlerinin de ?ok benzer olduğu kabul edilmektedir. Aile ?yk?s?, sigara, hava kirliliği, biyomass maruziyeti, allerjenler, infeksiyonlar gibi risklerin her ?? hastalığın gelişmesinde de rol oynadığı bilinmektedir.
Ortak genetik yapı ile doğan bu kişilerde yıllar i?erisinde karşılaşılan ?evresel risk fakt?rlerinin zamanlaması (hangi yaşlarda karşılaşıldığı) ve t?r?n?n (allerjen mi, infeksiyon mu, sigara mı, birden fazla mı) ortaya ?ıkacak klinik tabloyu belirlediği d?ş?n?lmektedir. Bu hipotezin kabul edilmesi ve ge?erli kılınması, ancak her ?? hastalık i?in ortak genetik risk fakt?rlerinin g?sterilmesi ile m?mk?n olabilir. Bu ama?la bir?ok genetik ?alışma yapılmıştır. Bunlardan Avrupa ve ABD'de yapılan iki GWAS (Genome Wide Association) ?alışmasında astım ve KOAH'lı hastaların gen haritalarında ortak genler araştırılmıştır: 2, 5, 8, 11, 14 numaralı kromozomlarda her iki hastalıkla ilişkili genler saptanmış ancak ilişki istatistiksel olarak anlamlı bulunmamıştır (4,26). Bu araştırmaların sonucunda ortak genetik altyapı g?sterilmemiştir. Bu nedenle g?n?m?zde var olan kanıtların ışığında Dutch hipotezi tam ge?erli kabul edilmemektedir.
İkinci hipotez ise İngiliz hipotezidir. Bu hipoteze g?re astım ve KOAH'ın farklı genetik altyapıların neden olduğu, farklı mekanizmalarla oluşan, ancak benzer risk fakt?rlerinin rol oynadığı ayrı hastalıklar olduğu varsayılmaktadır (Şekil 2).
Yıllar i?erisinde bu iki hastalığın ?zelliklerinin birbirleri ile ?rt?şmeye başladığı ve her iki hastalığın ?zelliklerini taşıyan bir hasta grubunun oluştuğu, bu grup hastaya da AKOS denildiği kabul edilmektedir. Bu hastaların temel ?zelliği KOAH'lı hastalarda g?r?len persistan hava akımı kısıtlaması ile astımlı hastalarda g?r?len reverzibl hava yolu obstr?ksiyonu kriterlerinin her ikisini birlikte taşımalarıdır. Yukarıda s?z? edilen risk fakt?rlerinin yanı sıra astım varlığı ve BHR, KOAH gelişmesinde rol oynayan ?nemli risk fakt?rleridir. Uzun d?nem izlemde KOAH gelişimi;? asemptomatik BHR'si olan kişilerde, BHR'si olmayanlara g?re d?rt bu?uk kat daha fazla saptanmıştır (27). ?ocukluktan elli yaşlarına kadar izlendiğinde, ağır astımlı ?ocukların erişkin yaşta KOAH olma olasılığı dokuz kat daha fazla bulunmuştur? (28). Ortalama 11 yıl izlenen gen? erişkin astımlılarda KOAH olma riskinin on iki kat daha fazla olduğu g?r?lm?şt?r (29).
Burada yanıtlanması gereken temel soru hangi astımlı hastalarda persistan hava akımı kısıtlanmasının gelişeceğidir. Diğer bir deyişle hangi astımlı hastalarda AKOS oluşacağıdır.? Yapılan ?alışmalar ?zellikle hızlı FEV1 kaybı olan astımlı hastalarda persistan hava akımı kısıtlamasının geliştiğini g?stermiştir. Sigara i?en, sık atak ge?iren, uzun s?redir astım ?yk?s? olan, non-atopik, erkek, ağır astımlı ve kalıcı yapısal değişiklikleri yoğun olan hastalarda FEV1 kaybının daha hızlı olduğu ve persistan hava akımı kısıtlaması geliştiği g?sterilmiştir (30,31,32,33,34). Bu ?zellikleri taşıyan astım hastaları genellikle AKOS i?in aday olan hastalardır.
Klİnİk Bulgular
AKOS prevalansı ile ilgili pop?lasyon ?alışmalarının ?okluğuna karşın hastalığın klinik ?zellikleri hakkında veriler olduk?a kısıtlıdır.? Yaş ?ok temel bir ?zelliktir ve AKOS kliniğine bakıldığında ?yk?de astımı olan ve sigara i?miş/i?mekte olan ileri yaş hastalarda olduğu g?r?l?r. KOAH'ta progresyon ka?ınılmaz olmakla birlikte uzun s?reli astımı olan, erkek, sık atak ge?iren, sigara i?en astımlılarda, akciğer yaşlanmasına sekonder FEV1'deki fizyolojik azalma hızlanır ve bu durum reverzibl ve persistan hava akımı kısıtlaması ile sonlanır? (35). Ortaya ?ıkan bu fonksiyonel kayıplara semptomlar eşlik eder.
Fonksiyonel bozukluklar temel alındığında AKOS, "artmış hava yolu duyarlılığı, reverzibl hava yolu obstr?ksiyonu ve persistan hava akımı kısıtlanmasına eşlik eden semptomlar" olarak da tanımlanabilir. Semptomlar bir solunum hastalığı olduğunu g?sterir ama astım, AKOS veya KOAH ayırıcı tanısında semptomlar ve niteliklerinin sensitivite ve spesifisitesi d?ş?kt?r.
KOAH'ın genetik temeli ve fenotiplerini araştıran kesitsel ve ?ok merkezli COPD Gene ?alışmasına; 10 paket/yıl'dan fazla sigara i?en, 45-80 yaşlarında, 915 KOAH'lı hasta alınmıştır. ?yk?de; 40 yaşından ?nce doktor tanılı astımı olan 119 (%13) olgu AKOS olarak tanımlanmış ve bu grubun KOAH'lılara g?re daha gen?, daha az sigara i?miş oldukları ve bir ?nceki yıla g?re ?? kat fazla atak, iki kat fazla da ağır atak ge?irdikleri g?r?lm?şt?r (19). Benzer bir bulgu 2 yıl sonra yapılan bir ?alışmada da g?sterilmiştir (20). ?ok merkezli, kesitsel, ilk pop?lasyon ?alışması olan bu değerlendirmede (EPI-SCAN), 40-80 yaş arası 3885 kişi arasında spirometrik ?l??mler sonucu 385 kişi (%10.1), FEV1/FVC< 0.70 bulunarak KOAH tanısı almış ve bunlar i?inde ?yk?de 40 yaşından ?nce astım tanısı alan 67 kişi (%17.4) de AKOS grubuna alınmıştır. Her iki grubun karşılaştırılmasında AKOS tanılı hastaların daha ?ok kadın, daha az sigara i?miş, daha ?ok komorbiditesi ve daha y?ksek BMI olan hastalar olduğu g?r?lm?şt?r. Ayrıca AKOS tanılı hastalarda? dispne ve wheezing gibi semptomların daha sık ve atakların daha fazla olduğu g?zlemlenmiştir. T?m bu veriler son olarak ?ok merkezli bir başka pop?lasyon ?alışmasıyla da desteklenmiştir ve AKOS'un KOAH'a g?re atak riskini iki kat, hastaneye yatışları d?rt kat arttırdığı bulunmuştur (36). AKOS?lu hastaların astımlılara g?re daha ileri yaşta, daha ?ok sigara i?en/i?miş hastalar olduğu bildirilmiştir (37). Hastalar a?ısından ?nemli bir parametre yaşam kalitesidir. Bu a?ıdan yapılan bir değerlendirmede astım, KOAH ve AKOS karşılaştırmasında yaşam kalitesinin en bozulduğu hastalar AKOS'lu hastalar olmuştur (38). Bu sonu?lar daha yeni ?alışmalarla da desteklenmiştir ve hem genel hem de solunumsal yaşam kalitesi bozukluğu, hastaların genel sağlıklarını k?t? algılamaları en yoğun olarak AKOS grubunda dikkati ?ekmiştir (20,39,40). Bu durum artmış solunumsal yakınmalar, sık ataklar ve hastane başvuruları ile ilişkilendirilmiştir.
Az sayıda ?alışma olmakla birlikte AKOS'un y?ksek sağlık harcamalarına neden olduğu g?r?lm?şt?r. Mevcut veriler AKOS'taki artmış ek hastalık prevalansı, sık ataklar ve sık hastane başvurularına uygun olarak astımlı ve KOAH'lı hastalardan ?ok daha y?ksek oranda tıbbi olanakları kullandıklarını, hem yıllık hem de hasta başına d?şen maliyetlerin anlamlı y?ksek olduğunu g?stermiştir (40,41).
AKOS'ta hastalığın doğal seyri ve uzun d?nem prognozu ?ok iyi bilinmemektedir.? Uzun d?nem izlem ?alışmalarında hava yolu obstr?ksiyonundan bağımsız olarak AKOS varlığının artmış mortalite ile birlikte olduğu g?r?lm?şt?r (42). Yine uzun izlem ?alışmalarında FEV1, 6 dakika y?r?me testi,? Saint George Respiratory Questionnaire (SGRQ) skorları ve BODE indeksinde en anlamlı bozulmalar KOAH grubunda olmakla birlikte AKOS grubunda astımlılara g?re daha anlamlı k?t?leşmeler olmuştur (43). Sonu? olarak mevcut veriler AKOS'lu hastaların; KOAH'a g?re gen? ama astıma g?re daha ileri yaşta hastalar olduğunu, daha semptomatik olduklarını ve eşlik eden hastalıklarının sık olduğunu g?stermiştir. Bu hastalar daha sık ve ağır atak ge?irmektedir, bu nedenle hastaneye yatış veya acile başvuru da sıktır ve t?m bunlar hastaların yaşam kaliteleri ve iş performansları olduk?a olumsuz etkilemektedir. ?nemli bir başka sonu? ise t?m bunlara artmış maliyet ve y?ksek mortalitenin eşlik etmesidir.
Astım, KOAH ve AKOS farklı fenotipik ?zellikler g?stermektedir. Ancak bu fenotiplerin altında yatan fonksiyonel ve patolojik mekanizmalar yani endotipler hen?z bilinmemektedir. AKOS'ta endotipi/endotipleri tanımlamadan ?nce astım ve KOAH'ta endotipin/endotiplerin tamamen aydınlatılmış olması gereklidir. Bu yapıldığında bunu izleyen AKOS endotipik ?zellikleri, tedavi yaklaşımları a?ısından yol g?sterici olacaktır (44,45).
Fonksİyonel ?zellİkler
AKOS'lu olgularda solunum fonksiyon testleri ile ilgili ?zellikler aslında hastalığa ait farklı tanı kriterlerinin i?inde tanımlanmıştır (21). KOAH'lı bir hastada reverzibl hava yolu obstr?ksiyonu (400 mcg salbutamol veya 1000 mcg terbutalin sonrası FEV1'de bazal değere g?re > %12 ve > 200 mL artış) varsa, astımlı bir hastada ise persistan hava akımı kısıtlaması varsa AKOS akla getirilmelidir. (44,45). Bu olgularda DLCO d?ş?kl?ğ?, statik hiperinflasyon bulguları, bronş hiperreaktivitesi ve PEF varyasyonu fonksiyonel duruma eşlik edebilir, ancak şart değildir. (12,17,21,35,44,46,47).
Kauppi ve arkadaşlarının Finlandiya'da yaptıkları 1546 olgunun dahil edildiği, astım, KOAH ve AKOS'lu olguları karşılaştıran bir ?alışmada, FEV1 değerinin astımlı olgularda diğer iki gruba g?re anlamlı olarak y?ksek olduğu, post bronkodilat?r FEV1 değerinin ise yine diğer iki grupla karşılaştırıldığında KOAH'lı olgularda anlamlı olarak d?ş?k olduğu g?sterilmiştir (pre ve post bronkodilat?r FEV1 değerleri, astım, AKOS ve KOAH'lı olgularda sırasıyla %85.7-86.5, %62.9-67.4, %59.5-61.4) (38), PEF ve FEV1/FVC değerlerinin de AKOS ve KOAH'lı olgularda birbirine benzer ancak astımlı olgulardan anlamlı d?ş?k oldukları g?sterilmiştir. Avustralya'da yapılan sağlıklı kontrol, astım, KOAH ve AKOS'lu olguları değerlendiren başka bir ?alışmada da FEV1, FEV1/FVC a?ısından ?nceki ?alışma sonu?larına ?ok yakın değerler elde edilmiştir (48). Aynı grubun bu hastalarda yaptığı uzun d?nem izlemde astım, KOAH ve AKOS'lularda 4 yıllık takipte FEV1 kaybının ortalama yıllık 19 mL olduğu ve gruplar arası fark olmadığı g?sterilmiştir (43). Ancak gruplar kendi i?lerinde değerlendirildiğinde hastalık progresyonunun KOAH'lı grupta, astım ve AKOS'a g?re daha fazla olduğu g?sterilmiştir. Başka bir ?alışmada ise AKOS'lu olgularda yıllık FEV1 kaybının sigara i?meyen astımlı veya astımı olmayan sigara i?en olgulardan daha fazla olduğu g?sterilmiştir (35).
AKOS'un radyolojik ?zellikleriyle ilgili ?ok az veri vardır. Bunlara g?re AKOS'lu olgularda ?zellikle erken evrelerde radyolojik bulgularda ?zellik saptanmayabilir. Ancak hastalık ağırlığı arttık?a hiperinflamasyon, hava yolu duvar kalınlığında artış, hava hapsi, saydamlık artışı, b?ller veya amfizemat?z değişiklikler de g?r?lebilmektedir (47,48). Sonu?ta radyolojik bulgular ağır astım ve KOAH'taki radyolojik bulgulara benzerdir.
İnflamasyon, Bİyobelİrte? ve Genetİk ?zellİkler
AKOS'ta inflamasyon hakkında yeterli veri olmaması nedeniyle astımda KOAH'a ?zg? ve KOAH'ta astıma ?zg? inflamasyon saptanan durumlar ve araştırmalardan, elde edilen bulgulardan bahsedilecektir. Astımda kronik inflamasyon ?oğunlukla eozinofiliktir ve CD4 h?creler tarafından y?nlendirilir. KOAH'ta inflamasyon n?trofiliktir, y?nlendiren ise CD8 h?crelerdir. Ancak her iki hastalıktaki kronik inflamasyon heterojendir ve astımlı hastalarda KOAH ile benzer, KOAH'lılarda ise astıma benzer inflamatuvar h?cresel ?zellikler saptanmıştır (49). Steroidlere diren?li, non-eozinofilik, n?trofilik astım olguları bildirilmiş olup, sigara i?en veya ciddi astım olup fiks hava yolu obstr?ksiyonu olan astımlıların hava yollarında n?trofil artışı g?sterilmiştir (50). Hem astım hem de KOAH'ta, sigara n?trofilik inflamasyonu tetikler ve steroid direncine yol a?ar (51,52). KOAH'ta eozinofilik inflamasyon bazı hastaların hava yollarında saptanmakta ve bu hastalar kortikosteroid tedaviyle daha fazla reverzibl olmaktadır (53). Astım semptomları olan KOAH'lı hastalarda periferik kanda ve ind?kte balgamda eozinofil sayılarının arttığı g?r?lm?ş ve inhale kortikosteroid (İKS) tedavisine FEV1 yanıtı ile balgam eozinofil sayısı arasında anlamlı korelasyon saptanmıştır (54). Yine bazı KOAH hastalarında Th2 inflamasyonla ilişkili gen ekspresyonunun astımlı hastalarla overlap yaptığı g?sterilmiştir. Bu KOAH'lı hastaların Th2 inflamasyonla ilişkili gen ekspresyonu olmayan KOAH'lılara g?re solunum fonksiyonlarının daha bozuk olduğu, hava yolu duvarında ve serumda anlamlı olarak daha fazla eozinofiliye sahip oldukları, reverzibilitenin fazla olduğu ve steroid tedavisiyle hiperinflasyonda belirgin d?zelmelerinin olduğu g?sterilmiştir (55). Yukarıda bahsedilen araştırmalarda tanımlanan hastaların en azından bir kısmının AKOS tanımı ile uyumlu ?zellikte hastalar olma olasılıkları bulunmaktadır ve dolayısıyla AKOS'ta inflamasyon hakkında fikir vermektedir.
Astım ve KOAH'ta tipik inflamatuvar ?zellikten sapmaların g?r?ld?ğ? bir başka durum da astım ve KOAH ataklarıdır. Ataklar sıklıkla viral infeksiyonlarla ortaya ?ıkan, akciğer fonksiyonlarında azalmayla ilişkili ve semptomatik k?t?leşmeye yol a?an durumlardır. Kronik astımda atakta n?trofiller artmaktadır. Fatal astımda eozinofiller olmaksızın daha ?ok n?trofilik inflamasyon g?r?lmekte ve status astmatikusta n?trofil sayıları artmaktadır (56). KOAH'ta ataklar sırasında allerjik inflamasyona benzer ?zellikler saptanabilir. Kronik bronşit ataklarında hava yollarında eozinofili ve hava yolu epitelinde RANTES artışı olduğu g?sterilmiştir (57). Eozinofilik hava yolu inflamasyonunun azaltılması ile ağır KOAH ataklarında? azalma sağlanmaktadır (58). Sonu? olarak, astım ve KOAH'ta inflamatuvar ?zelliklerin değişebildiği g?r?lmektedir. Bu bulgular ışığında her iki hastalık i?in hava yolu inflamasyonunun ve dolayısıyla klinik, fonksiyonel ?zelliklerin ?rt?şt?ğ? AKOS olarak tanımlanan hastalar bulunmaktadır.
Astımda hava yolu remodelingi ve KOAH'ta amfizem, inflamasyonun diğer ?nemli sonu?larıdır. Amfizemat?z değişiklikler KOAH'ın bulgusudur, ancak ağır astımda amfizemdekine benzer şekilde değişikliklerin g?r?lebildiği bildirilmiştir. Alveolar tutamakların etkilendiği, elastik liflerde azalma olduğu ve bu bulguların ?zellikle peribronşiyoler alanlara lokalize olduğu g?sterilmiştir (59). Ayrıca astım patogenezinde ?nemli bir rol? olan IL-13'?n farelerde aşırı ekspresyonunun amfizem gelişimini ortaya ?ıkardığı ve matriks metalloproteinaz salınımını arttırdığı saptanmıştır (59). Hava yolu remodelingi astımın karakteristik ?zelliğidir, ancak KOAH'ta epitel, retik?ler bazal membran, hava yolu d?z kası, mukoz glandları i?ine alan hava yolu duvarında kalınlaşma g?r?lmektedir. Eozinofili, hava yolu aşırı duyarlılığı gibi astım ?zelliklerini taşıyan KOAH'lı hastalarda, bazal membran kalınlaşması, k???k hava yollarında d?z kas artışının olduğu saptanmıştır (53). Tanımlanan bu bulgular AKOS'taki olası patolojik değişiklikler y?n?nden dikkat ?ekicidir.
Iwamoto ve arkadaşlarının KOAH ve AKOS'ta pn?mositler tarafından ?retilen s?rfaktan protein A (SP-A)'nın plazma d?zeylerinin, balgamda n?trofillerin ?rettiği miyeloperoksidaz (MPO)?ın arttığını, pn?mosit kaynaklı "plazma soluble receptor for advanced glycation end products (sRAGE)" d?zeylerinin ise d?ş?k olduğunu bildirmiştir. ?alışma da bu ?? biyobelirte? AKOS ve KOAH'ı astımdan ayırt etmede yardımcı bulunmuştur. AKOS'ta n?trofil kaynaklı balgam "n?trofil jelatinaz ilişkili lipokalin (NGAL)" d?zeyleri KOAH'tan y?ksektir.? KOAH ve AKOS'ta ortak patolojik s?recin hava yollarında n?trofilik inflamasyon ve periferik akciğer hasarı olduğuna işaret eden bu ?alışmada, AKOS'ta NGAL d?zeylerinin daha y?ksek oluşu n?trofilik hava? yolu inflamasyonu ve epitelyal hasarın artmış olduğunu d?ş?nd?rmektedir (60).
AKOS'ta sistemik inflamasyon KOAH'a benzemektedir (61). KOAH ile karşılaştırıldığında AKOS'ta; serum nitrik oksit d?zeylerinin daha d?ş?k, CRP, IL-6, IL-8, fibrinojen, TNF- d?zeylerinin ise benzer olduğu g?zlenmektedir. Bu bulgular AKOS'ta oksidan aktivitenin azaldığını d?ş?nd?rmektedir (20). Balgamda sitokinlerin ?l??m?yle ağır astım ve KOAH arasında ayrım yapmayı sağlayan ?? hasta k?mesi belirlenmiştir; birinci grupta astımlılar, eozinofilik inflamasyon, y?ksek Th2 sitokinler, ikinci grupta KOAH'lılar, eozinofil-n?trofil karışık hava yolu inflamasyonu, ???nc? Grupta ise AKOS, n?trofilik inflamasyon, balgamda IL-1, IL-8, IL-10, TNF- d?zeylerinin y?ksek olduğu saptanmıştır. Bu bulgulara g?re balgamda mediat?rlere, h?cresel ?zelliklere bakarak overlap grubu tanımlamak m?mk?n olabilir (62).
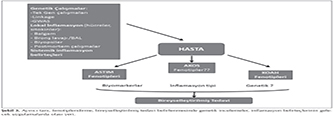
COPD Gene kohortunda, AKOS olarak tanımlanan hastalar ve KOAH'lılarda t?m genomun analizinde istatistiksel olarak anlamlı fark g?steren bir SNP (single nucleotide polymorphism) saptanmamıştır. Aynı ?alışmada AKOS'ta beyaz ırktan hastalarda 8. kromozomda yer alan CSMD1 ve 12. kromozomda bulunan SOX5 geninde SNP'ler ve t?m grupta (beyaz ırk ve Afrika k?kenli Amerikalı) 14. kromozomda bulunan GPR65 geninde SNP'lerin olduğu belirlenmiştir. CSMD1 geni amfizemle ilişkilidir. SOX5 geni KOAH ile ilişkili, akciğer gelişiminde rol? olan bir gen olabilir. GPR65 geni ise eozinofil aktivasyonunda rol? olan, proinflamatuvar sitokinlerin inhibisyonunda rol alan bir gendir (4). Astım ve KOAH'ta fonksiyonel ve d?zenleyici yolaklarda rol alan ortak genleri belirlemek ?zere yapılan bir başka analizde ise astım ve KOAH ile ilişkili olan 58 gen belirlenmiş ve yatkınlık genlerinin fonksiyonel ?zelliklerine g?re astımda 12 gen, KOAH'ta 11 gen saptanmıştır. İki hastalık arasında bağlantı analizi yapıldığında 229 ?rt?şen molek?l olduğu ve bu molek?llerin ise "aril hidrokarbon resept?r sinyalizasyonu", "sitokin aracılı imm?n h?creler arası bağlantı iletimi", "glukokortikoid resept?r sinyalizasyonu" ve "makrofajlarda IL-12 sinyalizasyonu ve ?retimi" yolaklarında yer aldıkları g?sterilmiştir. Sonu?ta bu iki hastalık arasında bağlantılarda ?rt?şme g?steren ve hastalıkların patobiyolojisiyle ilişkili ortak ?zellikler olabilir (63). Kronik inflamatuvar akciğer hastalıklarında ?ok sayıda gen farklı fonksiyonel yolları kullanarak ve etkileşimde bulunarak hastalık gelişimine katkıda bulunmaktadır. ?evresel fakt?rler (allerjenler, infeksiyonlar, sigara), bu genlerin ekspresyonu ve aralarındaki bağlantıların d?zenlenmesine etki edebilir.? Obstr?ktif akciğer hastalıklarının ortaya ?ıkışına neden olan gen-?evre etkileşimleri, gelişen lokal ve sistemik inflamasyona ait belirte?ler hem ayırıcı tanıda ve fenotiplerin belirlenmesinde hem de bireyselleştirilmiş tedavilerin oluşturulması i?in gelecek yıllarda araştırmalardan klinik uygulamaya yansıma potansiyeli taşımaktadır (Şekil 3).
Rehberlerde AKOS Tedavİsİ
Aslında belli bir tanımı olsun veya olmasın AKOS, g?ğ?s hastalıkları ve allerji ve klinik imm?noloji uzmanlarının ?ok sık karşılaştıkları ve teşhis-tedavi aşamalarında da sorun yaşadıkları sendromlardan biridir. Astım, KOAH ayırıcı tanısı yapılması ve tanı koymak i?in yeterince ?aba g?sterilmemesi durumunda; bazı astım hastalarına yeterli tedavi verilmemesi, bazı KOAH hastalarına ise rehberlerin ?nerilerine uygun olmayan tedavilerin verilmesi s?z konusu olabilir.
AKOS tedavisinin amacı semptomları kontrol altına almak veya azaltmak ve atak, solunum fonksiyon kayıpları ve ila? yan etkilerinden oluşan riskleri azaltmaktır. AKOS morbiditesi, ?ks?r?k, balgam, egzersiz dispnesi ve bunun klinik yansımaları ile ila?ların yan etkileridir. Mortalite ise sık ataklar ve bununla ilişkili akut solunum yetmezliği sonucu g?r?l?r. Ataklar hem morbiditeyi, hem de mortalite ve hastalık maliyetini artırır. Tedavi hedeflerine g?venli ve iyi tolere edilebilen yaklaşımlar ile ulaşılmalıdır (44).
AKOS'ta tedavi yaklaşımı ile ilgili en erken veriler Avusturalya-Yeni Zelanda G?ğ?s Derneklerinin TSANZ 2002 rehberinde yer almıştır. Bu rehberde; astım olduğu d?ş?n?lmeyen KOAH hastaları arasında tam olmasa da anlamlı bronkodilat?r yanıtı olanların? İKS'den fayda g?rebileceği belirtilmiştir. Bu hastalardan uzun s?reli bronkodilat?rlerle ve/veya İKS'lerle tedavi sonrası hava yolu fonksiyonlarında belirgin d?zelmesi olanlarında İKS kullanımının devamı ?nerilmiştir (13).
Daha sonra 2007 Kanada G?ğ?s Derneğinin rehberinde, kombine KOAH ve astım i?in tedavi olarak ilk etapta uzun etkili beta agonist (LABA) + uzun etkili muskarinik resept?r antagonisti (LAMA) kombinasyonu ve eğer astım bileşeni belirginse İKS başlanması ve daha da ?nemlisi, bu tip hastalarda eğitim ve tedavinin kişiye ?zel hale getirilmesi ve tedavi hedeflerinin ve beklentilerin tek başına astım veya KOAH'tan farklılaştırılması ?nerilmektedir (14).
Japon Solunum Derneğinin? 2009 tedavi rehberinde astımla komplike olan KOAH hastalarında KOAH'ın ağırlığından bağımsız olarak İKS başlanması ?nerilmektedir (15). Bu rehberde İKS'ye ek olarak LAMA veya LABA başlanmasından sonra semptomlar kontrol altına alınamazsa İKS + LAMA + LABA'nın birlikte kullanılması gerektiği ve bu tip hastalarda l?kotrien resept?r antagonistleri (LTRA) kullanımının da etkili olduğu vurgulanmıştır (16). Bu a?ıdan yeni ve ayrıntılı veri sunan rehberlerden birisi olan İspanyol G?ğ?s Hastalıkları ve G?ğ?s Cerrahisi Derneğinin KOAH rehberinde, AKOS'ta solunum fonksiyonlarını d?zeltmek ve atakları azaltmak amacıyla İKS + LABA kombinasyonu kullanılması ?nerilmektedir.? İlerleyen evrelerde daha etkili olma adına bu ikili tedaviye LAMA'nın eklenebileceği belirtilmektedir. Bu ??l? tedavinin KOAH'lı hastalarda sağladığı yararların, klinik gidişin daha ağır olduğu AKOS'lu hastalarda da g?r?leceği d?ş?n?lmektedir. Yine İKS kesilmesi noktasında ?ok dikkatli olunması gerektiği ??nk? bu durumun ataklara yol a?abileceği ?zerinde durulmuştur. Son olarak da sık atak ge?iren ve balgam ?ıkaran daha ağır olgulara teofilin veya fosfodiesteraz-4 inhibit?r? (PDE4-I)'n?n tedaviye eklenebileceği belirtilmiştir (16).
Bug?ne kadar en kapsamlı AKOS tanı ve tedavi ?nerilerine sahip rehberler 2014 GINA ve GOLD rehberleridir (1,47). GINA ve GOLD rehberleri AKOS i?in ilk defa basit ve ?nc?l tedavi ?nerileri getirmiştir (Tablo 1).? GINA ve GOLD, astım ve KOAH karmaşası yaşanan hastaların ?ok iyi incelenmesi gerektiğini ve aslında bir?oğunda astım ve KOAH ayırımının yapılabileceğini belirtmektedir. AKOS'un tanısı birinci basamakta konabilirse de, klinik gidişinin tek başına KOAH ve astımdan k?t? olduğu d?ş?n?lerek bu olguların ileri bir merkeze tanının doğrulanması ama?lı g?nderilmesi ?nerilmektedir. Bu rehberlerdeki algoritmik ve basitleştirilmiş AKOS tanımlaması ?ok sık g?r?len bu sendromu daha iyi anlamayı ve tedavi etmeyi hedefleyen yeni ve ileri araştırmaları cesaretlendirmeyi ama?lamaktadır.
GINA ve GOLD 2014 rehberlerinde AKOS'a basamaklı tanı yaklaşımı sunulmuştur (1). Bu basamakları izleyerek tanı konulduktan sonra tedavi yaklaşımı da basamaklandırılmıştır. Buna g?re;
- Sendrom bazlı ilk değerlendirmede AKOS, astım veya KOAH ayırımı yapılamıyorsa başlangı? tedavisi astım gibi olmalıdır.? Bunun nedeni kontrols?z astımı olan hastalarda İKS'lerin morbidite ve hatta mortaliteyi azaltıcı etkisinin dikkate alınmasıdır.
- Benzer şekilde ilk değerlendirme AKOS veya astımı d?ş?nd?r?yor veya KOAH olma olasılığı d?ş?kse yine tedavi astım gibi olmalıdır. Bu durumda ilk tedavi se?eneği? semptomların ağırlığına g?re d?ş?k-orta doz İKS olmalıdır. Bu tedaviye LABA eklenmeli veya hasta kullanıyorsa buna devam etmelidir.? Unutulmaması gereken nokta LABA'nın tek başına yani monoterapi olarak verilmemesi gerektiğidir.
- Eğer sendrom bazlı ilk değerlendirme KOAH d?ş?nd?r?yorsa başlangı? tedavisi bronkodilat?rlerle ve gerekiyorsa İKS'yle kombine tedavi ile yapılmalıdır. Tedaviye tek başına İKS'yle başlanmamalıdır.
- AKOS tedavisi t?m bu farmakolojik tedavilerin yanı sıra diğer tedavi stratejilerini de kapsamalıdır. Bunlar; sigaranın bıraktırılması, pulmoner rehabilitasyon, aşılar, GINA ve GOLD rehberlerinde? belirtildiği gibi komorbiditelerin belirlenmesi, tedavisi ve kontrol?d?r (1).
- Tedaviye rağmen persistan semptomlar ve ataklar, tanıda belirsizlik ve başka tanı olasılığı varsa ve bunların dışlanması gerekiyorsa, astım veya KOAH olan hastada ateş, kilo kaybı gece terlemesi, hemoptizi gibi atipik semptomlar varsa ve tedaviyi etkileyen yoğun komorbiditeler varsa, hastalar bir ?st merkeze sevk edilmelidirler.
Bug?ne kadar ?ok az sayıda rehberde AKOS tanım, tanı ve tedavi yaklaşımına yer verildiği a?ık?a g?r?lmektedir. Başta GINA ve GOLD olmak ?zere t?m rehberler AKOS i?in hen?z yolun başındadırlar. ?nerilerin bir?oğu zaman zaman ya kendi i?inde veya diğer rehberlerdeki ?nerilerle ?elişmektedir. Şimdilik t?m bu bilgileri AKOS i?in sadece başlangı? olarak kabul etmek faydalı olacaktır. Bu konuda yapılacak ?alışmalar ve bunların sonu?ları, AKOS'a bakışı b?y?k oranda geliştirecek ve etkileyecektir.
KAYNAKLAR
- Diagnosis of Diseases of Chronic Airflow Limitation: Asthma, COPD and asthma-COPD overlap syndrome (ACOS) GINA, GOLD. Available from: http://www.goldcopd.org
- Nakawah MO, Hawkins C, Barbandi F. Asthma, chronic obstructive pulmonary disease (COPD), and the overlap syndrome. Am Board Fam Med 2013;26:470-7.
- Steveling EH, Clarenbach CF, Miedinger D, Enz C, D?rr S, Maier S, et al. Predictors of the overlap syndrome and its association with comorbidities in patients with chronic obstructive pulmonary disease. Respiration 2014;88:451-7.
- Hardin M, Cho M, McDonald ML, Beaty T, Ramsdell J, Bhatt S, et al. The clinical and genetic features of COPD-asthma overlap syndrome. Eur Respir J 2014;44:341-50.
- Jakovljevic M, Ostojic L. Comorbidity and multimorbidity in medicine today: challenges and opportunities for bringing separated branches of medicine closer to each other. Psychiatr Danub 2013;25(Suppl 1):S18-S28.
- Divo M, Cote C, de Torres JP, Casanova C, Marin JM, Pinto-Plata V, et al. Comorbidities and risk of mortality in patients with chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012;186:155-61.
- Wenzel SE. Asthma phenotypes: the evolution from clinical to molecular approaches. Nat Med 2012;18:716-25.
- Vestbo J. COPD: definition and phenotypes. Clin Chest Med 2014;35:1-6.
- Agust? A. Phenotypes and disease characterization in chronic obstructive pulmonary disease. Toward the extinction of phenotypes? Ann Am Thorac Soc 2013;(Suppl 10):S125-S30.
- Anderson GP. Endotyping asthma: new insights into key pathogenic mechanisms in a complex, heterogeneous disease. Lancet 2008;372:1107-19.
- L?tvall J, Akdis CA, Bacharier LB, Bjermer L, Casale TB, Custovic A, et al. Asthma endotypes: a new approach to classification of disease entities within the asthma syndrome. J Allergy Clin Immunol 2011;127:355-60.
- Bujarski S, Parulekar AD, Sharafkhaneh A, Hanania NA. The Asthma COPD overlap syndrome (ACOS) Curr Allergy Asthma Rep 2015;15:6-10.
- The Asthma Foundation. Available from: www.asthmafoundation.org.nz/wp-content/uploads/2012/03/COPD. Available date: 26.03.2015.
- O'Donnell DE, Aaron S, Bourbeau J, Hernandez P, Marciniuk DD, Balter M, et al. Canadian Thoracic Society recommendations for management of chronic obstructive pulmonary disease-2007 update. Can Respir J 2007;14(Suppl B):5B-32B.
- Committee for the Third Edition of the COPD Guidelines of the Japanese Respiratory Society. Guidelines for the Diagnosis and Treatment of COPD 3rd ed. Available date: 26.03.2015. Medical Review Co, Tokyo, 2009.
- Miravitlles M, Soler-Cataluna JJ, Calle M, Molina J, Almagro P, Quintano JA, et al. Spanish Guideline for COPD (GesEPOC). Update 2014. Arch Bronconeumol 2014;50(Suppl 1):S1-S16.
- Soriano JB, Davis KJ, Coleman B, Visick G, Mannino D, Pride NB. The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003;124:474-81.
- de Marco R, Pesce G, Marcon A, Accordini S, Antonicelli L, Bugiani M, et al. The coexistence of asthma and chronic obstructive pulmonary disease (copd): prevalence and risk factors in young, middle-aged and elderly people from the general population. PLoS One 2013;10;8:e62985.
- Hardin M, Silverman EK, Barr RG, Hansel NH, Schroeder JD, Make? BJ, et al. The clinical features of the overlap between COPD and asthma. Respir Research 2011;12:127.
- Miravitlles M, Soriano JB, Ancochea J, Munoz L, Duran-Tauleria E, S?nchez G, et al. Characterisation of the overlap COPD asthma phenotype. Focus on physical activity and health status. Respir Med 2013;107:1053-60.
- Zeki AA, Schivo M, Chan A, Albertson TE, Louie S. The asthma-COPD overlap syndrome: a common clinical problem in the elderly. J Allergy (Cairo) 2011; 2011:861926.
- Shi W, Bellusci S, PhD, Warburton D. Lung development and adult lung diseases. Chest 2007;132:651-6.
- Postma DS, Kerkhof M, Boezen HM, Koppelman G. Asthma and chronic obstructive pulmonary disease common genes, common environments? Am J Respir Crit Care 2011;183:1588-94.
- Stocks J, Sonnappa S. Early life influences on the development of chronic obstructive pulmonary disease. Ther Adv Respir Dis 2013;7:161-73.
- Postma DS, Boezen HM. Rationale for the Dutch Hypothesis allergy and airway hyperresponsiveness as genetic factors and their interaction with environment in the development of asthma and COPD. Chest 2004;126:96S-104S.
- Smolonska J, Koppelman GH, Wijmenga C, Vonk JM, Zanen P, Bruinenberg M, et al. Common genes underlying asthma and COPD? Genome-wide analysis on the Dutch Hypothesis. Eur Respir J 2014;44:860-8.
- Brutsche MH, Downs SH, Schindler C, Gerbase MW, Schwartz J, Frey M, et al. Bronchial hyperresponsiveness and the development of asthma and COPD in asymptomatic individuals: SAPALDIA Cohort Study. Thorax 2006;61:671-7.
- Tai A, Tran H, Roberts M, Clarke N, Wilson J, Robertson CF. The association between childhood asthma and adult chronic obstructive pulmonary disease. Thorax 2014; 69:805-10.
- Silva GE, Sherrill DL, Guerra S, Barbee RA. Asthma as a risk factor for COPD in a longitudinal study. Chest 2004;126:59-65.
- Matsunaga K, Ichikawa T, Oka A, Morishita Y, Kanai K, Hiramatsu M, et al. Changes in forced expiratory volume in 1 second over time in patients with controlledasthma at baseline. Respir Med 2014;108:976-82.
- Bai TR, Vonk JM, Postma DS, Boezen HM. Severe exacerbations predict excess lung function decline in asthma. Eur Respir J 2007;30:452-6.
- Amelink M, de Nijs SB, Berger M, Weersink EJ, ten Brinke A, Sterk PJ, et al. Non-atopic males with adult onset asthma are at risk of persistent airflow limitation. Clin Exp Allergy 2012;42:769-7.
- Contoli M, Baraldo S, Marku B, Casolari P, Marwick JA, Turato G, et al. Fixed airflow obstruction due to asthma or chronic obstructive pulmonary disease: 5-year follow-up. J Allergy Clin Immunol 2010;125:830-7.
- Bumbacea D, Campbell D, Nguyen L, Carr D, Barnes PJ, Robinson D, et al. Parameters associated with persistent airflow obstruction in chronic severe asthma. Eur Respir J 2004;24:122-8.
- Gibson PG, Simpson JL. The overlap syndrome of asthma and COPD: what are its features and how important is it? Thorax 2009;64:728-35.
- Menezes AM, Montes de Oca M, P?rez-Padilla R, Nadeau G, Wehrmeister FC, Lopez-Varela MV, et al; PLATINO Team. Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype COPD-Asthma. Chest 2014;145:297-304.
- Lee HY, Kang JY, Yoon HK, Lee SY, Kwon SS, Kim YK, et al. Clinical characteristics of asthma combined with COPD feature. Yonsei Med J 2014;55:980-6.
- Kauppi P, Kupiainen H, Lindqvist A, Tammilehto L, Kilpel?inen M, Kinnula VL, et al; Overlap syndrome of asthma and COPD predicts low quality of life. J Asthma 2011;48:279-85.
- Chung JW, Ae Kong K, Lee JH, Lee SJ, Ryu YJ, Chang HJ.? Characteristics and self-rated health of overlap syndrome.? Int J COPD 2014;9:795-804.
- Shaya FT, Dongyi D, Akazawa MO, Blanchette CM, Wang J, Mapel DW, et al. Burden of concomitant asthma and COPD in a Medicaid population. Chest 2008;134:14-9.
- Rhee CK,? Yoon HK,? Yoo KH, Kim YS,? Lee SW,? Park YB, et al. Medical utilization and cost in patients with overlap syndrome of chronic obstructive pulmonary disease and asthma. COPD 2014;11:163-170.
- Diaz-Guzman E, Khosravi M, Mannino DM. Asthma, chronic obstructive pulmonary disease, and mortality in the U.S. population. COPD 2011;8:400-7.
- Fu JJ, Gibson PG, Simpson JL, McDonald VM.? Longitudinal changes in clinical outcomes in older patients with asthma, COPD and asthma-COPD overlap syndrome. Respiration 2014;87:63-74.
- Louie S, Zeki AA, Schivo M, Chan AW, Yoneda KY, Avdalovic M, et al. The astma- COPD overlap syndrome: pharmacotherapeutic considerations. Expert Rev Clin Pharmacol 2013;6:197-219.
- Soler-Cataluna JJ, Cosio B, Izguierdo JL, Lopez-Campos JL, Marin JM, Aguero R, et al. Consensus document on the Overlap Phenotype COPD-Asthma in COPD. Arch Bronconeumol 2012;48:331-7.
- Papaiwannou A, Zarogoulidis P, Porpodis K, Spyratos D, Kioumis I, Pitsiou G, et al. Asthma-chronic obstructive pulmonary disease overlap syndrome (ACOS): current literature review. J Thorac Dis 2014;6:S146-S51.
- Global Initiative for Asthma. Accesed date: 2015. Available from: www.ginasthma.org.
- Yoshida M, Nakano T, Fukuyama S, Matsumoto T, Eguchi M, Moriwaki A, et al. Effects of tiotropium on lung function in severe asthmatics with or without emphysematous changes. Pulm Pharmacol Ther 2013;26:159-16.
- Kim SR, Rhee YK. Overlap between asthma and COPD: Where the two diseases converge. Allergy Asthma Immunol Res 2010;2:209-14.
- Douwes J, Gibson P, Pekkanen J, Pearce N. Non- eosinophilic asthma: importance and possible mechanisms. Thorax 2002;57:643-8.
- Chalmers GW, Macleod KJ, Little SA, Thomson LJ, McSharry CP, Thomson NC. Influence of cigarette smoking on inhaled corticosteroid treatment in mild asthma. Thorax 2002;57:226-30.
- Chaudhuri R, Livingston E, McMahon AD, Thomson L, Borland W, Thomson NC. Cigarette smoking impairs the therapeutic response to oral corticosteroids in chronic asthma. Am J Respir Crit Care Med 2003;168:1308-11.
- Chanez P, Vignola AM, O'Shaugnessy T,? Enander I, Li D, Jeffery PK, et al. Corticosteroid reversibility in COPD is related to features of asthma. Am J Respir Crit Care Med 1997;155:1529-34.
- Siva R, Green RH, Brightling CE, Shelley M, Hargadon B, McKenna S, et al.? Eosinophilic airway inflammation and exacerbations of COPD: a randomised controlled trial. Eur Respir J 2007;29:906-13.
- Christenson SA, Steiling K, van den Berge M, Hijazi K, Hiemstra PS, Postma DS, et al. Asthma-COPD overlap. clinical relevance of genomic signatures of type 2 inflammation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2015;191:758-66.
- Fahy JV, Kim KW, Liu J, Boushey HA. Prominent neutrophilic inflammation in sputum from subjects with asthma exacerbation. J Allergy Clin Immunol 1995;95:843-52.
- Zhu J, Qiu YS, Majumdar S, Gamble E, Matin D, Turato G, et al. Exacerbations of bronchitis: bronchial eosinophilia and gene expression for interleukin-4, interleukin-5, and eosinophil chemoattractants. Am J Respir Crit Care Med 2001;164:109-16.
- Mauad T, Silva LF, Santos MA, Grinberg L, Bernardi FD, Martins MA, et al. Abnormal alveolar attachments with decreased elastic fiber content in distal lung in fatal asthma. Am J Respir Crit Care Med 2004;170:857-62.
- Zheng T, Zhu Z, Wang Z, Homer RJ, Ma B, Riese RJ Jr, et al. Inducible targeting of IL-13 to the adult lung causes matrix metalloproteinase- and cathepsin-dependent emphysema. J Clin Invest 2000;106:1081-93.
- Iwamoto H, Gao J, Koskela J, Kinnula V, Kobayashi H, Laitinen T, et al. Differences in plasma and sputum biomarkers between COPD and COPD-asthma overlap. Eur Respir J 2014;43:421-9.
- Fu JJ, McDonald VM, Gibson PG, Simpson JL. Systemic inflammation in older adults with asthma-COPD overlap syndrome. Allergy Asthma Immunol Res 2014;6:316-24.
- Ghebre MA, Bafadhel M, Desai D, Cohen SE, Newbold P, Rapley L, et al. Biological clustering supports both "Dutch" and "British" hypotheses of asthma and chronic obstructive pulmonary disease. J Allergy Clin Immunol 2015;135:63-72.
- Kaneko Y, Yatagai Y, Yamada H, Iijima H, Masuko H, Sakamoto T, et al. The search for common pathways underlying asthma and COPD. Int J Chron Obstruct Pulmon Dis 2013;8:65-78.
Yazışma Adresi (Address for Correspondence)
Dr. Elif ŞEN
Ankara ?niversitesi Tıp Fak?ltesi,
G?ğ?s Hastalıkları Anabilim Dalı,
ANKARA - TURKEY
e-mail: esen@ankara.edu.tr