REVIEW
Doi: 10.5578/tt.6342
Tuberk Toraks 2015;63(2):132-139

Gebelerde pulmoner tromboembolinin tan? ve tedavisi
Sava? ?ZSU1, O?uz UZUN2
1 Karadeniz Teknik ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Trabzon, T?rkiye
1 Department of Chest Diseases, Faculty of Medicine, Karadeniz Technical University, Trabzon, Turkey
2 Ondokuz May?s ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Samsun, T?rkiye
2 Department of Chest Diseases, Faculty of Medicine, Ondokuz Mayis University, Samsun, Turkey
?ZET
Gebelerde pulmoner tromboembolinin tan? ve tedavisi
Gebelerde ven?z tromboemboli maternal mortalitenin maj?r sebeplerinden biridir. ?zellikle ???nc? trimester ve postpartum alt? hafta riskin en fazla oldu?u d?nemdir. Fet?se iyonize radyasyon maruziyeti endi?esi potansiyel olarak tan?da fatal sonu?lara yol a?maktad?r. ?zellikle y?ksek riskli hastalarda bu durum s?kt?r. Normal D-dimer pulmoner emboli (PE) tan?s?n? d??lamakla beraber gebelerde fizyolojik olarak D-dimer y?ksektir. Gebelerde D-dimer nadiren normaldir. Pulmoner emboli ??pheli gebelerde DVT semptom ve bulgusu varsa ilk yap?lmas? gereken alt ekstremite kompresyon ultrasonudur. Sintigrafi akci?er filmi normal olan hastalarda tercih edilmelidir. PE tedavisi gebelerde heparinle olmal?d?r. Artan tecr?beler d???k molek?l a??rl?kl? heparinlerin (DMAH) g?venli oldu?unu g?stermektedir. Kiloya g?re DMAH dozu ayarlanmal?d?r.
Anahtar kelimeler: Gebelik, pulmoner emboli, tan?, tedavi
SUMMARY
Treatment and diagnosis of pulmonary embolism in pregnancy
When occurring during pregnancy, venous thrombo-embolism is a major cause of maternal mortality. The risk is highest in the third trimester of pregnancy and over the 6 weeks of the postpartum period. Exposure of the foetus to ionizing radiation is a concern when investigating suspected PE during pregnancy; although this concern is largely overruled by the hazards of missing a potentially fatal diagnosis. This is particularly true for pregnant patients with suspected high risk. A normal D-dimer value has the same exclusion value for PE in pregnant women as for other patients with suspected PE but is found more rarely, because plasma D-dimer levels physiologically increase throughout pregnancy. In pregnant women with suspected PE and signs and symptoms of DVT, guidelines suggest performing bilateral compression ultrasound of lower extremities. Use of lung scintigraphy as the preferred test in the setting of a normal CXR. The treatment of PE in pregnancy is based on heparin anticoagulation. Increasing experience suggests that LMWHs are safe in pregnancy, and their use is endorsed in several reports. Treatment should consist of a weight-adjusted dose of LMWH.
Key words: Pregnancy, pulmonary embolism, diagnosis, treatment
G?R??
Gebelikte ortaya ??kan fizyolojik ve anatomik de?i?iklikler ven?z tromboemboli (VTE) riskini art?rmaktad?r. Hiperkoag?lopati, ven?z staz ve ven?z kan ak?m?n?n azalmas?, inferior vena kava ve pelvik venlere uterus bas?s? ve immobilite tromb?s olu?mas?nda ?nemli fakt?rlerdendir. Gebelikte baz? p?ht?la?ma fakt?rleri artarken (V, VIII, IX, X ve fibrinojen), protein S seviyesi azalmaktad?r (1). Ya? > 35, obezite, sezaryen ile do?um, ?iddetli over hiperstim?lasyonu, kalp hastal???, DM, multiparite ayr?ca pulmoner emboli (PE) riskini art?rmaktad?r (2).
Gebelik esnas?nda tromboembolik olay insidans?n?n 1000 do?umda 2 oldu?u belirtilmektedir (3). Gebe olmayanlara g?re VTE riski gebelerde 4-50 kat artar. PE ?zellikle geli?mi? ?lkelerde gebeli?e ba?l? anne ?l?mlerinin ?nde gelen nedenidir (4). Gana'da yap?lan bir ?al??mada gebelikle ili?kili ?l?mlerin %1.9'unun PE?den kaynakland??? g?r?lm??t?r (5). VTE riski gebelik d?nemine g?re ?zellikle postpartumun birinci haftas?nda daha fazlad?r (6). Gebelikte ortaya ??kan fizyolojik de?i?iklikler PE benzer semptomlar olu?turmas? tan? g??l???ne yol a?maktad?r. Dispne, takipne, ta?ikardi ve bacak ?i?li?i gebelikte ola?and?r. Gebelik s?resince nefes darl??? ?ikayeti giderek artmaktad?r. ?zellikle nefes darl???n?n ola?an d??? artmas? ve DVT semptomlar?n?n e?lik etmesi PE a??s?ndan ?nemli ipu?lar?d?r. En s?k semptomlar dispne, pl?ritik g???s a?r?s? ve ?ks?r?k olarak s?ralanmaktad?r (7).
TANI
D-dimer seviyesi gebelik s?ras?nda fizyolojik olarak y?ksektir. Ancak gebeli?in ilk 20 haftas?nda hastalar?n %50'de D-dimer pozitif olabilece?i belirtilmektedir (8). Dolay?s?yla, bu periyottaki hastalarda negatif D-dimer seviyesi PE'nin d??lanmas?nda kullan?labilir. ?lerleyen haftalarda D-dimer seviyesi giderek artar ve postpartum 4-6. haftada normale d?ner. Klinik skorlama y?ntemlerinden Wells kriterlerinin gebelikte kullan?m?yla ilgili prospektif olarak kullan?lmam??t?r (9). Y?z seksen ?? hastay? i?eren retrospektif bir ?al??mada ise modifiye Wells kriterlerinin (PE olas? ve PE olas? de?il) sensitivite ve negatif prediktif de?eri %100 olarak bulunmu?tur (10).
PE ??phesi olan gebelerde ve gebe olmayanlarda arteryel kan gaz? tan?sal de?ildir. Hem PE'de hem de gebelikte respiratuar alkaloz ortak ?zelliktir. Gebelikte ???nc? trimesterde s?rt?st? konumdayken PaO2 yatar pozisyonda daha d???k olabilece?i i?in, arteryel kan dik konumdayken al?nmal?d?r. ?zellikle hipoksemi ile birlikte normal akci?er grafisi varl???nda PE i?in ileri de?erlendirilmeler yap?lmas? gerekmektedir. DVT semptomu olmayan PE ??pheli gebelerde kur?un levha ile bat?n? koruyacak ?ekilde akci?er grafisi ?ekilmelidir. Akci?er grafisi di?er patolojilerin d??lanmas?nda (pulmoner ?dem, kardiyomegali, pn?motoraks, pn?moni vs.) olduk?a ?nemlidir.
Gebelikte PE tan?s? koymak olduk?a g??t?r. ?zellikle fet?s?n alaca?? radyasyon nedeniyle hasta ve yak?nlar?n?n endi?esine klinisyenlerin de ?ekimserli?i etkilenince olay i?in i?inden ??k?lamaz bir hal almaktad?r. D-dimer seviyesi pozitif bir gebede e?er bacak semptomu varsa ilk yap?lacak tetkik alt ekstremite kompresyon ultrasonografi (KUS)'dir (11). E?er derin ven trombozu saptan?rsa ileri i?leme gerek kalmadan antikoag?lan tedavi ba?lanmal?d?r. Ancak ultrasonografi negatif gelirse, tan?ya y?nelik di?er ileri i?lemler yap?lmal?d?r (11).
PE ??phesi olan gebelerde ekokardiyografi rutin de?ildir. Gebelikle ili?kili kardiyomiyopati, kalp kapak hastal???, idiyopatik pulmoner hipertansiyon ve benzeri di?er nedenlerin d??lanmas?nda de?erlidir. ?zellikle ekokardiyografide atriyal tromb?s g?r?lmesi, akut solunum yetmezli?ine e?lik eden tabloya sa? ventrik?l yetmezlik bulgular?n?n e?lik etmesi kuvvetle PE tan?s?n? d???nd?rmelidir. Hastan?n e?er varsa daha ?nceki ekokardiyografi sonu?lar?yla birlikte de?erlendirilmesi isabetli olur.
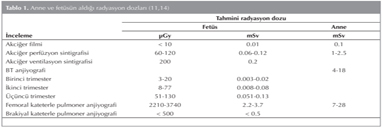
Anne ve bebe?in g?r?nt?leme sonucu PE tan?s? almamas? olas?l???na kar??n radyasyon riskine maruz kalmas? ve uzun d?nemde kanser riski BT ve sintigrafi kullan?m?n? s?n?rlamaktad?r. Ancak tahmini radyasyon dozunun konjenital malformasyon ve malignite i?in tan?mlanan e?ik de?erlerin alt?nda oldu?u d???n?lmektedir (12). Perf?zyon sintigrafisi ile meme dokusunun ald??? radyasyon dozu BT ile k?yasland???nda daha d???kt?r (13). BT ?ekimi s?ras?nda r?latif olarak ?zellikle gen? hastalarda daha y?ksek dozda radyasyon alan meme dokusunda kanser geli?imine katk?da bulunabilir. On be? y?ldan daha uzun s?rede fatal kanser riski BT i?in milyonda bir iken sintigrafi i?in 280 binde bir olarak tahmin edilmektedir (14). Gebelik boyunca tan?sal y?ntemlerle ili?kili fet?s?n ve annenin ald??? tahmini radyasyon dozu Tablo 1'de verilmi?tir (11,15).
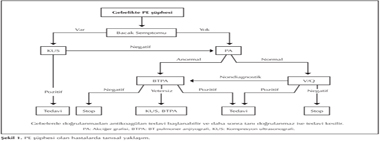
Amerikan Toraks Derne?i ve Torasik Radyoloji k?lavuzu ?? g??l? ?neride bulunmaktad?r (11,16). Birincisi PE ??phesi olup DVT semptomu olmayan veya KUS negatif olan hastalarda, e?er akci?er grafisi normal ise; akci?er sintigrafisini ilk se?enek olarak ?nermektedir. Akci?er grafisi anormal ya da sintigrafi tan?sal de?ilse (d???k/orta olas?l?kl? perf?zyon defekleri) bu durumda BT ?nermektedir. Teknik olarak yetersiz BT s?z konusu ise bu durumda ya BT yeniden ?ekilmeli ya da KUS yap?lmal?d?r. Negatif BT durumunda ileri i?lem yap?lmamal?d?r. Gebelik s?ras?nda PE ??phesi olan hastalarda tan?sal algoritma ?ekil 1'de ?zetlenmi?tir (11). D???k olas?l?kl? perf?zyon sintigrafisi durumunda 1. ve 7. g?nde KUS, e?er orta olas?l?kl? perf?zyon defektleri mevcutsa bu durumda BT ?ekilmesi ?nerilmektedir (9).
Akci?er grafisinin normal oldu?u PE ??phesi olan gebelerde yap?lan d?rt ?al??mada, perf?zyon sintigrafisinin tan?sal oran? olduk?a y?ksek; %75-94 oran?nda bulunmu?tur (17,18,19,20). K?rk ?? hastay? i?eren ba?ka bir ?al??mada hastalar?n %70'inde V/Q normal/d???k olas?l?kl? olarak, sadece %11'inde y?ksek olas?l?kl? olarak raporlanm??t?r (21). Retrospektif bir seride, normal perf?zyon sintigrafisine dayan?larak tedavisiz b?rak?lan gebe kad?nlarda sonu?lar?n g?venli oldu?u belirtilmi?tir. Ancak gebelerde tan?sal olmayan sintigrafi oran? ise %21 olarak bulunmu?tur (22). Ventilasyon faz? ilave radyasyon gerektirdi?i i?in ge?erli bir neden olu?turacak kadar tan?sal bilgi sa?lamaz. Buna kar??l?k, akci?er perf?zyon sintigrafisi ile tan? konamayan kad?nlarda BT, fet?s?n anlaml? ?l??de daha fazla X ???n?na (2.2-3.7 mSv) maruz kalmas?na yol a?an pulmoner anjiyografiye tercih edilmelidir (23). ?ki farkl? ?al??mada ise PE ??phesi ile BT ?ekilen hastalarda teknik olarak yetersiz BT oran? %19-35 bulunmu?tur (24,25).
Manyetik rezonans pulmoner anjiyo (MRPA)'nun gebelik boyunca PE tan?s? i?in spesifite ve sensitivitesi hen?z ara?t?r?lmam??t?r. G?zlemsel insan ?al??malar?nda fetal teratojenitesi hen?z g?sterilmeyen gadolinum kullan?lmas? ?nemli bir avantaj olarak g?sterilse de yorumlanmas? tecr?be gerektirmektedir (26). Zira PE tan?s?nda g?n?m?zde pek kullan?lan bir y?ntem de?ildir. PIOPED III ?al??mas?nda MRPA ?ekilen hastalar?n %25'inde y?ntemin teknik olarak yetersiz oldu?u g?sterilmi?tir (27).
Sonu? olarak gebelerde PE tan?s? koymak di?er hastalara g?re radyasyon riskinin daha fazla ?nemsenmesi nedeniyle ?ok zordur. Ancak gebelerde PE ile ili?kili y?ksek mortalite dikkate al?nd???nda bu durum g?z ard? edilebilir.
TEDAV? YAKLA?IMI
Gebelik d?neminde VTE tedavisinde kullan?lan ila?lar?n gebe olmayanlarda kullan?m?na g?re ?nemli farkl?l?klar? oldu?u her zaman ak?lda tutulmal?d?r. Bu farkl?l?klar aras?nda en ba?ta kullan?lan ila?lar?n fet?s a??s?ndan ta??d??? riskler (fetal anomali, vs.), normal insanlara g?re gebelik d?neminde koag?lasyon sisteminde meydan gelen de?i?iklikler ve do?um ya da sezaryen i?lemlerine ba?l? olu?abilecek artm?? kanama riski yer almaktad?r. Varfarin genel olarak teratejojenik oldu?u i?in ?zellikle birinci trimesterde olmak ?zere gebelik d?neminde geli?en VTE'de tercih edilmez. Yeterli g?venlik verisi olmad??? i?in fondafarinuks ve idraparinuks gibi sentetik heparin pentasakkaritlerinden de gebelik d?neminde ka??n?l?r. Hamilelik d?neminde antikoag?lasyon dozu hakk?nda daha az ?ey bilindi?i i?in antikoag?lan aktivitenin monit?rizasyonu konusunda daha dikkatli olmak gerekir.
Hamilelikte Antikoag?lan ?la?lar?n Etkinli?i
Hamile olmayanlarda VTE tedavisinde d???k molek?l a??rl?kl? heparinlerin (DMAH) etkinli?i kesin olarak g?sterilmi?tir (28). Hamilelerde VTE tedavisi ve profilaksisinde varfarinin teratojenik etkisi nedeniyle anfraksiyone heparin (UFH) veya DMAH'lar kullan?lmaktad?r. DMAH'lar?n UFH'lere kar?? kanama riskinin daha az olmas?, monit?rizasyon gerektirmemesi ve heparine ba?l? trombositopeni ve osteoporoz riskinin daha d???k olmas? gibi sahip oldu?u ?st?nl?klerin gebelerde de ge?erli oldu?u d???n?lmekte ve son y?llarda yay?nlanan b?t?n k?lavuzlarda gebe hastalar?n tedavisinde de DMAH'lar ?nerilmektedir (Tablo 2) (28,29,30). DMAH'lar kilograma ba??ml? olarak g?nde tek veya ?ift doz olarak uygulanabilirler (Tablo 3) (31). Buna ilave olarak, DMAH'lar?n uzun s?reli tedavide VTE n?ks? a??s?ndan vitamin K antagonistlerinden ?st?nl??? kanserli hastalar gibi ?zel gruplarda da g?sterilmi?tir. Buna kar??l?k, gebe hastalar?n b?y?k ?al??malar?n hi?birine dahil edilmedikleri bilinmektedir. DMAH'lar?n gebelik d?neminde kullan?mlar?yla ilgili olarak tart??mal? baz? konular mevcuttur. Bunlardan birincisi DMAH'lar?n uygun dozu ya da hamilelik ilerleyip kilo artt?k?a doz ayarlamas? gerekip gerekmedi?idir. ?kinci konu ise ?zellikle ikinci trimesterde glomer?ler filtrasyonun artmas? nedeniyle g?nde tek doz yerine iki doz uygulaman?n daha do?ru olup olmad??? konusudur. Bir?ok klinisyen kullan?m kolayl??? ve uygulama yerine ba?l? olu?abilecek komplikasyonlar? azaltmak amac?yla g?nde tek doz uygulamay? tercih etmektedirler. Gebelikte geli?en embolili hastalarda yap?lan prospektif ?al??malarda tek uygulaman?n g?nde iki kez uygulamaya g?re VTE n?ks oran?n? art?rd??? g?sterilmemi?tir (32,33). Pratik olarak, hamile bir VTE'li hasta hastanede yatt??? d?nemde DMAH'?n ba?lang?? tedavisi olarak a??rl???na g?re g?nde 2 doz uygulanmas? ve hastaneden taburcu olduktan sonra ise g?nde bir kez uygulamas?n?n mant?kl? oldu?u bir?ok uzman taraf?ndan kabul edilmektedir.
Hamilelik d?neminde DMAH'lar?n terap?tik aral???n? belirlemek i?in yap?lan doz art?rma ?al??malar?nda ?eli?kili sonu?lar mevcuttur (34,35). American G???s Hastal?klar? Birli?i (American College of Chest Physicians) anti-Xa takibiyle ilgili olarak spesifik bir ?neride bulunmamaktad?r (28).
Gebe bir VTE hastas?nda antikoag?lan tedavi en az do?um sonras? alt? haftaya kadar devam edilmelidir, ??nk? gebelerde bu d?nem VTE n?ks? i?in en riskli d?nemi olu?turmaktad?r. Gebe olmayan VTE hastalar?nda maj?r ge?ici bir risk fakt?r? bulundu?u durumlarda antikoag?lan tedavi s?resinin en az ?? ay olmas? gerekti?i bilinmektedir. Bu nedenle, gebeli?in son d?neminde geli?en VTE durumlar?nda do?um ger?ekle?tikten sonra alt? haftadan daha uzun bir tedavi gerekebilir. Ayr?ca gebe hastalar daha uzun s?reli antikoag?lasyon i?in trombofilik bir durum a??s?ndan de?erlendirilmelidirler.
Hamilelikte Vena Kava Filtrelerinin Kullan?m?
Hamilelerde vena kavaya filtre yerle?tirilmesi antikoag?lasyon i?in kesin bir kontrendikasyon bulundu?u durumunda d???n?lmelidir. Vena kava filtrelerinin daha sonradan emboli riski ortadan kalkt?ktan sonra ??kar?labilir olmas?na dikkat etmek gerekir, ??nk? gebelik ve lohusal?k d?nemi sonland???nda antikoag?lasyon ?o?u hastada sonland?r?labilece?inden vena kava filtresi rahatl?kla ??kar?labilir. Kal?c? filtreler ?m?r boyu antikoag?lasyon kullan?m? gereklili?i do?urur. Vena kava filtrelerinin d???n?lmesi gereken ikinci bir durum do?uma yak?n bir d?nemde geli?en a??r? embolik y?k? olan hastalard?r. Bu grup hastalarda do?um esnas?nda ge?ici olarak antikoag?lasyonun kesilmesi gerekti?inden, bu d?nemde olu?abilecek bir emboli hastan?n hayat?n? tehlikeye atabilir. Bunu engellemek i?in bu hastalarda profilaktik ama?l? ??kar?labilir vena kava filtrelerinin yerle?tirilmesi uygun olacakt?r.
Vena kava filtrelerinin tak?lmas? ile ilgili tart??mal? bir durum masif pulmoner emboli geli?en gebelerdir. Baz? ot?rler masif emboli geli?ti?inde de di?er tedavilere ek olarak profilaktik ama?l? vena kava inferior filtrelerinin yerle?tirilmesini gerekti?ini ?nermektedirler.
Hamilelikte Antikoag?lan ?la? Se?imi: Fet?s G?venli?i
Gebelik d?neminde kullan?lan ila?lar?n teratojenite, konjenital malformasyon ve fetal kanamaya yol a?ma olas?l??? son derece ?nemlidir. Anfraksiyone heparin ve DMAH'lar?n gebelerde kullan?m?yla ilgili b?y?k bir deneyim mevcuttur. Bu ila?lar plasentay? ge?mezler ve bir?ok g?zlemsel ?al??ma sonu?lar?na g?re gebelerde g?venli kabul edilmektedirler (28,36). Bu nedenle, gebelik d?neminde olu?an trombozlar?n tedavisinde ve ?nlenmesinde heparinler tercih edilmelidir.
Buna kar??n, K vitamini antagonistleri plasentay? ge?erek fet?ste vitamin K eksikli?i olu?tururlar. Vitamin K embriyopatisi nazal hipoplazi, skolyoz, k?sa proksimal uzuvlar ve k?sa falankslarla karakterize anomaliye yol a?ar (37). Vitamin K embriyopatisi gebeli?in 6-9 haftalar?nda varfarine maruz kalan fet?s?n %5 kadar?nda g?r?l?r (30). Varfarinin 2. trimester ya da 3. trimesterin ba?lang?c?nda kullan?m? fetal intrakraniyal hemoraji ve ?izensephali anomalisi ile ili?kili oldu?u g?sterilmi?tir (38,39). Vitamin K antagonitlerinin mekanik kalp kapa?? hastalar?nda oldu?u gibi t?m gebelik boyunca kullan?ld??? durumlarda konjenital anomali riski %4-10 aras?nda oldu?u bildirilmi?tir (40,41).
Vitamin K antagonitleri genel olarak 2. trimesterde g?venli olduklar? kabul edilmelerine kar??n, okul ?a??ndaki ?ocuklarda yap?lan ara?t?rmalarda gebeli?in bu d?neminde bu ila?lara maruz kalm?? ?ocuklarda ya??tlar?na g?re min?r n?rolojik disfonksiyon tespit edilmi?tir (30,42).
Danaparaid ve fondaparinuks ile yetersiz deneyim olmas?na kar??n gebelerde artan oranlarda kullan?lmaktad?r (43). Fondaparinuksun min?r plasental ge?i?i mevcuttur. Bu ila?lar DMAH'lara kar?? allerjik reaksiyonlar? tespit edilen ya da heparine ba?l? trombositopeni hikayesi olan hastalarda tercih edilebilir.
Embolili Hastalarda Do?um
Anestezi k?lavuzlar?nda profilaktik dozda uygulanan DMAH'lar?n son dozundan 12 saat, terap?tik dozda uygulanan DMAH'lar?n son dozundan 24 saat sonra spinal anestezi uygulanabilece?i belirtilmektedir (44). N?roaksiyel blokajdan 6 saat ?nce parenteral uygulanan anfraksiyone heparin durdurulmal? ve aktive-parsiyel tromboplastin zaman? kontrol edilerek i?leme ba?lamadan konfirmasyon yap?lmal?d?r. DMAH kullanan gebe kad?nlar do?um eylemi (a?r?lar?) ba?lad??? andan itibaren heparin kullanmamalar? konusunda uyar?lmal?d?rlar. Do?um eylemini ne zaman ba?layaca?? ya da sezeryan d???n?len hastalarda bu cerrahi i?lemin ne zaman yap?labilece?i kesin olarak kestirilemedi?inden, ayr?ca DMAH'lar?n etkileri tam olarak geri d?nd?rmenin m?mk?n olmamas? nedeniyle, bu ajanlar? kullanan gebelerde gebeli?inin son haftalar?nda subk?tan?z olarak uygulanan anfraksiyone heparinlere ge?ilmesi makul bir yakla??m olarak kabul edilmektedir. Bununla birlikte, subk?tan?z olarak uygulanan anfraksiyonu heparinin de farmakokinetik ?zellikleri gebeli?in bu d?neminde de?i?iklik g?sterebilece?inden, bu hastalarda aktive-parsiyel tromboplastin zaman?n?n yak?n takip edilmesi gereklili?i unutulmamal?d?r.
Persistan bir kanama olmad??? durumlarda, normal do?umdan 12 saat sonra DMAH'lar ba?lanabilir. N?roaksiyel blokaj uygulanan hastalarda DMAH'lar profilaktik dozda kateter ?ekildikten 12 saat sonra ba?lanabilirken, terapatik dozda ise 24 saatten ?nce DMAH ba?lanmamal?d?r (45,46). DMAH'lar?n ya da varfarinin do?umdan sonra en az 6 hafta ya da total olarak en az 3 ay kullan?lmas? ?nerilmektedir (28). Tedavi kesilmeden ?nce tromboz riski a??s?ndan hastalar de?erlendirilmelidir. Pulmoner emboli ile birlikte derin ven trombozu olan hastalarda etkilenen baca?a kompresyon ?oraplar?n?n ilk olaydan sonra iki y?l boyunca giyilmesi post-trombotik komplikasyon oran?n? azaltt??? bilinmektedir (29,47). Bu nedenle derin ven trombozu olan hastalara etkilenen baca?a varis ?oraplar?n?n iki y?l boyunca giyilmesi tavsiye edilmelidir.
Gebelerde Trombolitik Tedavi
Gebelerde trombolitik tedavi gebe olmayan hastalarda kullan?ld???nda g?r?len kanama riskine benzer risk ta??maktad?r (45,46). Gebelerde trombolitik ila?lar?n kullan?m?yla ilgili b?y?k ?al??malar yoktur, bu nedenle bu konuda deneyim s?n?rl?d?r. Son yay?nlanan Avrupa PE k?lavuzunda trombolitik kullan?lacak gebelerde doku-plazminojen aktivat?r? (tPA) ?nerilmektedir (48). Bu konuda yak?n zamanda yap?lan bir derlemede 189 gebe hastada VTE i?in kullan?lan trombolitik ila?lar?n anne mortalitesi art?rmadan, %2.6 oran?nda maj?r kanamaya yol a?t??? belirtilmi?tir (49). Fare ve tav?an ?al??malar?nda tPA teratojenik etkisi g?sterilmemi?tir (50). tPA b?y?k molek?l yap?s?na (72000 kD) sahip oldu?u i?in plasentay? ge?mez. Trombolitiklerin gebelerde kullan?m?nda plasental ayr?lmaya ili?kin korkular vard?r, ancak bu komplikasyona ait bir veri yay?nlanmam??t?r. Sezaryen ameliyat? veya do?um sonras?ndaki 10 g?n i?inde trombolitikler kontrendike olsalar da, vajinal do?um sonras?nda 1 saat i?inde ve sezaryen sonras? 12 saat i?inde ba?ar?l? trombolitik tedavi uygulamalar? bildirilmi?tir (51). Gebelerde trombolitik tedavi uygularken son derece se?ici olunmal?, sadece hemodinamik olarak anstabil olan hastalarda hastan?n hayat?n? kurtarmak i?in fetal risk ve annede ciddi kanama riski de g?z ?n?ne al?narak uygulanmal?d?r. Gebe olmayan riskli VTE hastalar?n yar? doz trombolitik uygulamas?n?n ba?ar?l? sonu?lar verdi?ini g?steren b?y?k ?ift-k?r randomize ?al??ma bu y?l i?inde yay?nlanm??t?r (52). Gebelerde de kanama a??s?ndan endi?e duyuldu?u durumlarda tam doz tedaviye alternatif olarak yar? doz rTPA tedavisi d???n?lebilir.
Gebelerde geli?ebilecek masif pulmoner emboli hasta ve doktor a??s?ndan ?ok zor bir klinik durumu olu?turur. ??nk? bir taraftan hemodinamik bozukluk hastan?n hayat?n? tehdit ederken, kullan?lacak ila?lar da ciddi kanmaya yol a?arak hastay? ve fet?s?n hayat?n? riske atabilir. Doktor a??s?ndan da bu ?ok zor bir d?nemdir; doktor tan? ve tedavi ile ilgili son derece kritik kararlar? h?zl? bir ?ekilde vermek durumundad?r. Do?uma yak?n bir d?nemde tan?s? konulan masif pulmoner emboli hastalar?n?n tedavisi hastane imkanlar?na, bu konuda deneyimli uzmanlar?n?n bulunmas?na, olu?abilecek komplikasyonlara m?dahale edebilecek ekip ve t?bbi ara?-gere?lerin bulunmas?na g?re bireyselle?tirilmelidir. Hastan?n klinik durumu m?saade ediyor ise masif pulmoner emboli ??phesi ya da tan?s? konmu? gebe hasta invaziv radyoloji imkanlar?n?n, bu konuda deneyimli g???s hastal?klar? uzmanlar?n?n, eri?kin ve yeni do?an yo?un bak?m ?nitelerinin ve kardiyovask?ler cerrahi ekibinin bulundu?u bir merkeze tranfer edilmesi uygun olacakt?r. Bu hastalara hastane imkanlar?na g?re kardiyovask?ler baypas ile cerrahi embelektomi ve sezaryen ameliyat? ya da perk?tan p?ht? fragmantasyonu ile birlikte vena kava inferiora filtre yerle?tirilmesi d???n?lebilir.
Yeni Antikoag?lanlar
Direkt trombin inhibit?rleri (dabigatran) ve anti-Xa inhibit?rleri (rivaroksaban, apiksaban gibi) ile gebelerde geli?en VTE durumlar?nda kullan?m? ile ilgili bir veri olmad???ndan, bu ila?lar?n gebelerde kullan?m? kontrendikedir (46).
??kar ?at??mas?
Bildirilmemi?tir.
KAYNAKLAR
- Pabinger I, Grafenhofer H. Thrombosis during pregnancy: risk factors,diagnosis and treatment. Pathophysiol Haemost Thromb 2002;32:322-4.
- Jacobsen AF, Skjeldestad FE, Sandset PM. Incidence and risk patterns of venous thromboembolism in pregnancy and puerperium--a register-based case-control study. Am J Obstet Gynecol 2008;198:233.e1-7.
- James AH. Venous thromboembolism in pregnancy. Arterioscler Thromb Vasc Biol 2009;29:326-31. doi:10.1161/ATVBAHA.109.184127.
- Sullivan EA, Ford JB, Chambers G, Slaytor EK. Maternal mortality in Australia, 1973-1996. Aust N Z J Obstet Gynaecol 2004;44:452-7.
- Der EM, Moyer C, Gyasi RK, Akosa AB, Tettey Y, Akakpo PK, et al. Pregnancy related causes of deaths in Ghana: a 5-year retrospective study. Ghana Med J 2013;47:158-63.
- Heit JA, Kobbervig CE, James AH, Petterson TM, Bailey KR, Melton LJ 3rd. Trends in the incidence of venous thromboembolism during pregnancy or postpartum: a 30-year population-based study. Ann Intern Med 2005;143:697-706.
- Gherman RB, Goodwin TM, Leung B, Byrne JD, Hethumumi R, Montoro M. Incidence, clinical characteristics, and timing of objectively diagnosed venous thromboembolism during pregnancy. Obstet Gynecol 1999;94:730-4.
- Chabloz P, Reber G, Boehlen F, Hohlfeld P, de Moerloose P. TAFI antigen and D-dimer levels during normal pregnancy and at delivery. Br J Haematol 2001;115:150-2.
- Bourjeily G, Paidas M, Khalil H, Rosene-Montella K, Rodger M. Pulmonary embolism in pregnancy. Lancet 2010;375:500-12.
- Cutts BA, Tran HA, Merriman E, Nandurkar D, Soo G, Dasgupta D, et al. The utility of the Wells clinical prediction model and ventilation-perfusion scanning for pulmonary embolism diagnosis in pregnancy. Blood Coagul Fibrinolysis 2014;25:375-8.
- Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM, et al: An Official American Thoracic Society/Society of Thoracic Radiology Clinical Practice guideline: evaluation of suspected pulmonary embolism in pregnancy. Am J Respir Crit Care Med 2011;184:1200-8. doi: 10.1164/rccm.201108-1575ST.
- Middeldorp S. Thrombosis in women: what are the knowledge gaps in 2013? J Thromb Haemost 2013;11(Suppl 1): S180-S91.
- Astani SA, Davis LC, Harkness BA, Supanich MP, Dalal I. Detection of pulmonary embolism during pregnancy: comparing radiation doses of CTPA and pulmonary scintigraphy. Nucl Med Commun 2014;35:704-11. doi: 10.1097/MNM.0000000000000114.
- Greer IA. Thrombosis in pregnancy: updates in diagnosis and management. Hematology Am Soc Hematol Educ Program 2012;2012:203-7. doi: 10.1182/asheducation-2012.1.203.
- Torbicki A, Perrier A, Konstantinides S, Agnelli G, Gali? N, Pruszczyk P, et al. Guidelines on the diagnosis and management of acute pulmonary embolism: The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008;29:2276-315. doi: 10.1093/eurheartj/ehn310.
- Leung AN, Bull TM, Jaeschke R, Lockwood CJ, Boiselle PM, Hurwitz LM, et al. American Thoracic Society documents: an official American Thoracic Society/Society of Thoracic Radiology Clinical Practice Guideline--Evaluation of Suspected Pulmonary Embolism in Pregnancy. Radiology 2012;262:635-46. doi: 10.1148/radiol.11114045.
- Chan WS, Ray JG, Murray S, Coady GE, Coates G, Ginsberg JS. Suspected pulmonary embolism in pregnancy: clinical presentation, results of lung scanning, and subsequent maternal and pediatric outcomes. Arch Intern Med 2002;162:1170-5.?
- Revel MP, Cohen S, Sanchez O, Collignon MA, Thiam R, Redheuil A, et al. Pulmonary embolism during pregnancy: diagnosis with lung scintigraphy or CT angiography? Radiology 2011;258:590-8. doi: 10.1148/radiol.10100986.
- Scarsbrook AF, Bradley KM, Gleeson FV. Perfusion scintigraphy: diagnostic utility in pregnant women with suspected pulmonary embolic disease. Eur Radiol 2007;17:2554-60.
- Shahir K, Goodman LR, Tali A, Thorsen KM, Hellman RS. Pulmonary embolism in pregnancy: CT pulmonary angiography versus perfusion scanning. AJR Am J Roentgenol 2010;195:W214-20. doi: 10.2214/AJR.09.3506.
- Revel MP, Cohen S, Sanchez O, Collignon MA, Thiam R, Redheuil A, et al. Pulmonary embolism during pregnancy: diagnosis with lung scintigraphy or CT angiography? Radiology 2011;258:590-8. doi: 10.1148/radiol.10100986.
- Chan WS, Ray JG, Murray S, Coady GE, Coates G, Ginsberg JS. Suspected pulmonary embolism in pregnancy: clinical presentation, results of lung scanning, and subsequent maternal and pediatric outcomes. Arch Intern Med 2002;162:1170-5.
- Ginsberg JS, Hirsh J, Rainbow AJ, Coates G. Risks to the fetus of radiologic procedures used in the diagnosis of maternal venous thromboembolic disease. Thromb Haemost 1989;61:189-96.
- Ridge CA, McDermott S, Freyne BJ, Brennan DJ, Collins CD, Skehan SJ. Pulmonary embolism in pregnancy: comparison of pulmonary CT angiography and lung scintigraphy. AJR Am J Roentgenol 2009;193:1223-7. doi: 10.2214/AJR.09.2360.
- van Belle A, Buller HR, Huisman MV, Huisman PM, Kaasjager K, Kamphuisen PW, et al. Effectiveness of managing suspected pulmonary embolism using an algorithm combining clinical probability, D-dimer testing, and computed tomography. JAMA 2006;295:172-9.
- Webb JA, Thomsen HS, Morcos SK. The use of iodinated and gadolinium contrast media during pregnancy and lactation. Eur Radiol 2005;15:1234-40.
- Stein PD, Chenevert TL, Fowler SE, Goodman LR, Gottschalk A, Hales CA, et al. Gadolinium-enhanced magnetic resonance angiography for pulmonary embolism: a multicenter prospective study (PIOPED III). Ann Intern Med 2010;152:434-43.
- Bates SM, Greer IA, Middeldorp S, Veenstra DL, Prabulos AM, Vandvik PO. VTE, thrombophilia, antithrombotic therapy, and pregnancy: Antithrombotic therapy and prevention of thrombosis, 9th ed: American College of Chest Physicians Evidence-Based Clinical Practice Guidelines. Chest 2012;141(Suppl 2):e691-736. doi:10.1378/chest.11-2300.
- Thrombo prophylaxis during pregnancy,labour and after vaginal delivery. Guideline no: 37. London: Royal College of Obstetricians and Gynaecologists, 2004.
- Wesseling J, van Driel D, Heymans HS, Rosendaal FR, Geven-Boere LM, Smrkovsky M, et al. Coumarins during pregnancy:long-term effects on growth and development of school-age children. Thromb Haemost 2001;85:609-13.
- Greer IA. Prevention and mangement of venous thromboembolism in pregnancy. Clin Chest Med 2003;24:123-37.
- Voke J, Keidan J, Pavord S, Spencer NH, Hunt BJ. The management of antenatal venous thromboembolism in the UK and Ireland: a prospective multicentre observational survey. Br J Haematol 2007;139:545-58.
- Knight M. Antenatal pulmonary embolism: risk factors, management and outcomes. BJOG 2008;115:453-61. ?doi: 10.1111/j.1471-0528.2007.01622.x.
- Crowther MA, Spitzer K, Julian J, Ginsberg J, Johnston M, Crowther R, et al. Pharmacokinetic profile of a low-molecular weight heparin (reviparin) in pregnant patients. A prospective cohort study. Thromb Res 2000;98:133-8.
- Smith MP, Norris LA, Steer PJ, Savidge GF, Bonnar J. Tinzaparin sodium for thrombosis treatment and prevention during pregnancy. Am J Obstet Gynecol 2004;190:495-501.
- Greer IA, Nelson-Piercy C. Low-molecular-weight heparins for thromboprophylaxis and treatment of venous thromboembolism in pregnancy: a systematic review of safety and efficacy. Blood 2005;106:401-7.
- van Driel D, Wesseling J, Sauer PJ, Touwen BC, van der Veer, Heymans HS. Teratogen update: fetal effects after in utero exposure to coumarins overview of cases, follow-up findings, and pathogenesis. Teratology 2002;66:127-40.
- Lee HC, Cho SY, Lee HJ, Kim CJ, Park JS, Chi JG. Warfarin-associated fetal intracranial hemorrhage: a case report. J Korean Med Sci 2003;18:764-7.
- Pati S, Helmbrecht GD. Congenital schizencephaly associated with in utero warfarin exposure. Reprod Toxicol 1994;8:115-20.
- Chan WS, Anand S, Ginsberg JS. Anticoagulation of pregnant women with mechanical heart valves:a systematic review of the literature. Arch Intern Med 2000;160:191-6.
- Schaefer C, Hannemann D, Meister R, El?fant E, Paulus W, Vial T, et al. Vitamin K antagonists and pregnancy outcome. A multi-centre prospective study. Thromb Haemost 2006;95:949-57.
- Wesseling J, van Driel D, Smrkovsky M, Van der Veer E, Geven-Boere LM, Sauer PJ, et al. Neurological outcome in school-age children after in utero exposure to coumarins. Early Hum Dev 2001;63:83-95.
- Lindhoff-Last E, Kreutzenbeck HJ, Magnani HN. Treatment of 51 pregnancies with danaparoid because of heparin intolerance. Thromb Haemost 2005;93:63-9.
- Horlocker TT, Wedel DJ, Benzon H, Brown DL, Enneking FK, Heit JA, et al. Regional anesthesia in the anticoagulated patient: defining the risks (the second ASRA Consensus Conference on Neuraxial Anesthesia and Anticoagulation). Reg Anesth Pain Med 2003;28:172-97.
- Marik PE, Plante LA. Venous thromboembolic disease and pregnancy. N Engl J Med 2008;359;2025-33.
- Middeldorp S. How I treat pregnancy-related venous thromboembolism? Blood 2011;118:5394-400. ?doi: 10.1182/blood-2011-04-306589.
- Brandjes DP, B?ller HR, Heijboer H, Huisman MV, de Rijk M, Jagt H, et al. Randomised trial of effect of compression stockings in patients with symptomatic proximal-vein thrombosis. Lancet 1997;349:759-62.
- Konstantinides SV, Torbicki A, Agnelli G, Danchin N, Fitzmaurice D, Gali? N, et al. 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J 2014;35:3033-69, 3069a-3069k. doi: 10.1093/eurheartj/ehu283.
- Gartman EJ. The use of thrombolytic therapy in pregnancy. Obstet Med 2013;6:105-11.
- Ginsberg JS, Hirsh J, Rainbow AJ, Coates G. Risks to the fetus of radiologic procedures used in the diagnosis of maternal venous thromboembolic disease. Thromb Haemost 1989;61:189-96.
- Stefanovic BS, Vasiljevic Z, Mitrovic P, Karadzic A, Ostojic M. Thrombolytic therapy for massive pulmonary embolism 12 hours after cesarean delivery despite contraindication? Am J Emerg Med 2006;24:502-4.
- Meyer G, Vicaut E, Danays T, Agnelli G, Becattini C, Beyer-Westendorf J, et al. Fibrinolysis for patients with intermediate-risk pulmonary embolism. N Engl J Med 2014;370:1402-11. doi: 10.1056/NEJMoa1302097.
Yaz??ma Adresi (Address for Correspondence)
Dr. Sava? ?ZSU
Karadeniz Teknik ?niversitesi T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
TRABZON - TURKEY
e-mail: savasozsu@gmail.com