REVIEW
Doi: 10.5578/tt.8975
Tuberk Toraks 2015;63(2):111-131

KOAH ve ast?mda atak
Nurhayat YILDIRIM1, Tun?alp DEM?R1, Bilun GEM?C?O?LU1, Esen KIYAN2, K?v?lc?m O?UZ?LGEN3, Mehmet POLATLI4, Sevgi SARYAL5, Abdullah SAYINER6, Arzu YORGANCIO?LU7, Sevim BAVBEK8, G?lfem E. ?EL?K8, Hakan G?NEN9, Dil?ad MUNGAN8, Elif ?EN5, Haluk T?RKTA?3, F?sun YILDIZ10
1 ?stanbul ?niversitesi Cerrahpa?a T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, ?stanbul, T?rkiye
1 Department of Chest Diseases, Faculty of Cerrahpasa Medicine, Istanbul University, Istanbul, Turkey
2 ?stanbul ?niversitesi ?stanbul T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, ?stanbul, T?rkiye
2 Department of Chest Diseases, Faculty of Istanbul Medicine, Istanbul University, Istanbul, Turkey
3 Gazi ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Ankara, T?rkiye
3 Department of Chest Diseases, Faculty of Medicine, Gazi University, Ankara, Turkey
4 Adnan Menderes ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Ayd?n, T?rkiye
4 Department of Chest Diseases, Faculty of Medicine, Adnan Menderes University, Aydin, Turkey
5 Ankara ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Ankara, T?rkiye
5 Department of Chest Diseases, Faculty of Medicine, Ankara University, Ankara, Turkey
6 Ege ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, ?zmir, T?rkiye
6 Department of Chest Diseases, Faculty of Medicine, Ege University, Izmir, Turkey
7 Celal Bayar ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Manisa, T?rkiye
7 Department of Chest Diseases, Faculty of Medicine, Celal Bayar University, Manisa, Turkey
8 Ankara ?niversitesi T?p Fak?ltesi, ?mm?noloji ve Allerji Bilim Dal?, Ankara, T?rkiye
8 Division of Allergy and Immunology, Faculty of Medicine, Ankara University, Ankara, Turkey
9 S?rreyapa?a G???s Hastal?klar? ve G???s Cerrahisi, E?itim ve Ara?t?rma Hastanesi, G???s Hastal?klar? Klini?i,
?stanbul, T?rkiye
9 Clinic of Chest Diseases, Sureyyapasa Chest Diseases and Chest Surgery Training and Research Hospital,
Istanbul, Turkey
10 Kocaeli ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Kocaeli, T?rkiye
10 Department of Chest Diseases, Faculty of Medicine, Kocaeli University, Kocaeli, Turkey
?ZET
KOAH ve ast?mda atak
Kronik obstr?ktif akci?er hastal??? (KOAH) ve ast?m, ataklarla seyreden hava yollar?n?n hastal?klar?d?r. Ataklar her iki hastal?kta da hastal???n do?al seyrini etkilemektedir. KOAH ataklar? infeksiyonlar ve infeksiyon d??? nedenlere ba?l? olarak geli?ebilir. ?nfeksiyon d??? nedenler; ba?l?ca ?evresel fakt?rler (i? ve d?? ortam hava kirlili?i, mevsimsel de?i?iklikler), kardiyovask?ler hastal?klar, ast?m-KOAH "overlap" sendrom varl???, KOAH-obstr?ktif uyku apne "overlap" sendrom varl???, pulmoner emboli, gastro-?zefageal refl?, anksiyete-depresyon, pulmoner hipertansiyon olmas? gibi di?er fakt?rlerdir. Ast?m ataklar?, tetikleyen etkenlere maruziyet, viral infeksiyonlar, tedavinin hasta veya hekim taraf?ndan aksat?lmas? veya yetersiz verilmesi ile ortaya ??kar. Sigaran?n b?rak?lmas?, infeksiyonlar?n ?nlenmesi, uzun etkili antikolinerjik, uzun etkili ?2 agonist, inhaler kortikosteroidler, fosfodiesteraz-4 inhibit?rleri, mukolitikler, profilaktik antibiyotikler KOAH akut ataklar?n?n ?nlenmesinde etkili olabilir. Ast?mda tetikleyen allerjen, viral infeksiyonlardan korunma, mesleki ajanlar, ?evre kirlili?inden sak?nma, komorbit hastal?klar?n tedavisi ile atak oranlar?nda azalmalar sa?lanabilmektedir. Etkin tedaviler verilmesi; inhaler steroidler ve kombine tedaviler ataklar?n ?nlenmesinde en etkin tedavi ajanlar?d?r. Hasta e?itimi ve hasta ile i?birli?i; etkin bir tedavi verilerek hastaya d?zg?n tedavisinin kullan?m?n?n gere?i, inhaler tekni?i ??retilmeli ve eline yaz?l? eylem plan? verilerek yak?nmalar? ba?lay?nca yapmas? gerekenler yaz?larak aktar?lmal?d?r. KOAH ve ast?m atak tedavisinin temeli yo?un bir bronkodilat?r tedavidir. Buna paralel olarak, atakta yang?ya y?nelik steroid tedavileri de, hastan?n durumuna g?re, devreye sokulur. Ayr?ca ata?a neden olan soruna (infeksiyon, hava kirlili?i, emboli vb.) ?zg?l tedavi ve uygulanmal?d?r.
Anahtar kelimeler: Atak, KOAH, ast?m
SUMMARY
Acute exacerbation in COPD and asthma
Chronic obstructive pulmonary disease (COPD) and asthma are airway diseases with acute exacerbations. Natural course of both disease are affected by exacerbations. COPD exacerbations may be caused by infections and other causes; indoor and outdoor pollution, cardiovascular diseases, asthma-COPD overlap syndrome, COPD- obstructive sleep apnea syndrome, pulmonary embolism, gastro-oesophageal reflux, anxiety-depression, pulmonary hypertension. Exposure to triggering factors, viral infections, treatment insufficiency may cause asthma exacerbations. Smoking cessations, prevention of infections, long-acting anticholinergics, long-acting 2 agonists, inhaled corticosteroids, phosphodiesterase-4 inhibitors, mucolytics, prophilactic antibiotics can be effective on the prevention of COPD exacerbations. Asthma exacerbations may be decreased by the avoidance of allergens, viral infections, occupational exposures, airpollution, treatment of comorbid diseases. Effective treatment of asthma is required to prevent asthma exacerbations. Inhaled steroids and combined treatments are the most effective preventive therapy for exacerbations. Patient education and cooperation is an element of the preventive measures for asthma attacks. Compliance to therapy, inhalation techniques, written asthma plans are required. The essential of COPD and asthma exacerbation treatment is bronchodilator therapy. Steroids are also implemented to the therapy, targeting the inflammation. Specific treatments of the cause (infection, airpollution, pulmonary embolism etc.) should be administered.
Key words: Exacerbation, COPD, asthma
G?R??
Kronik obstr?ktif akci?er hastal??? (KOAH) ve ast?m ataklarla seyreden hava yollar?n?n hastal?klar?d?r. Ataklar her iki hastal?kta da hastal???n do?al seyrini etkilemektedir.
Son GOLD strateji raporunda KOAH'?n de?erlendirilmesinde ataklara ayr? bir ?nem verilmi?tir. Raporda "Ataklar ve komorbiditelerin KOAH'ta a??rl??? belirleyen en ?nemli etkenler" oldu?u belirtilmi?tir. Ataklar solunum fonksiyonlar?ndaki kayb? h?zland?rd???, ya?am kalitesini bozdu?u ve mortaliteyi artt?rd??? i?in ataklar?n de?erlendirilmesi hastal???n k?t? gidi?at?n?n belirlenmesiyle ayn? anlama gelmektedir (1). GOLD'a g?re yeni KOAH evrelemesi de temel olarak risk ve semptomlar?n belirlenmesi ?zerine kurgulanm??t?r. Bu de?erlendirmede risk analizi solunum fonksiyonlar?na g?re ya da atak say?s?na g?re yap?lmaktad?r. Hastan?n son y?lda hi? atak ge?irmemesi ya da hastaneye yat?? gerektirmeyen bir atak ge?irmesi d???k risk, iki ve daha fazla atak ge?irmesi ya da hastaneye yat?? gerektiren en az bir atak ge?irmesi ise y?ksek risk olarak kabul edilmektedir. 2014 strateji rapou tedavi hedefleri i?inde ataklar?n ?nlenmesi ve tedavisini saymaktad?r (1).
Ast?mda da tedavi hedefi ataklar?n ?nlenmesidir. Ast?m rehberleri ataklar?, kontrol?n bozulmas?ndan ay?rmaktad?r.
Bu yaz?da atak ba?l??? bulunsa da alevlenme, akut ast?m, akut KOAH ata?? ?eklinde isimlendirmeleri ayn? anlamda kullan?lmaktad?r. Bu durum pek ?ok dilde g?r?lmektedir. ?ngilizcede "attack, exacerbation, acute severe asthma, acute COPD exacerbation, flare-up, episode,..." ?eklinde farkl? terminolojilerle anlat?lmaktad?r. Bu metinde atak terimi kullan?lmas? tercih edilmi?tir.
ATAK TANIMI
KOAH
KOAH atak tan?m?nda biri "semptom temeline dayanan", di?eri semptomla birlikte atak nedeniyle hastaya uygulanan tedavi veya hastaneye yat?? ?eklinde "olaya dayanan" iki farkl? yakla??m ?ne s?r?lm??t?r (2). Semptomatik tan?mlamada "solunum semptomlar?nda t?bbi tedavi gerektirecek boyutta k?t?le?menin olmas?" ve daha sonra ?ne s?r?len olaya dayal? atak tan?m?nda "hastan?n stabil durumunda g?nl?k ola?an de?i?ikliklerin ?tesinde ve hastan?n altta yatan KOAH tedavisine ek tedavi gerektiren akut geli?en olaylar" temel al?nmaktad?r (2).
GOLD 2014 strateji raporunda, KOAH atak hastan?n solunumsal semptomlar?nda g?nl?k ola?an de?i?ikliklerin ?tesinde ve tedavide de?i?iklik gerektirecek boyutta k?t?le?me ile karakterize akut olay olarak tan?mlanm??t?r (1). Fakat bu tan?mlama, spirometri dikkate al?nmad???nda veya ger?ek atak olmad???nda bir?ok hastan?n risk grubunda yo?unla?aca?? d???ncesi nedeniyle tart??maya a??kt?r. Di?er bir problem, bu tan?m?n kan?ta dayal? ?al??malarda hen?z yer almam?? olmas?d?r.
Ast?m
T?rk Toraks Derne?i 2014 Ast?m Tan? ve Tedavi Rehberinde ast?m ata?? "Ast?ml? hastalarda ilerleyen nefes darl???, ?ks?r?k, h?r?lt?l?/h???lt?l? solunum, solunum g??l??? ya da g???ste t?kan?kl?k gibi yak?nmalar?n ortaya ??kmas? ve bunlara FEV1, PEF azalmas? gibi solunum fonksiyonlar?nda bozulmalar?n e?lik etmesi" ?eklinde tan?mlanm??t?r (1). ERS-ATS 2009 ortak raporunda "Hastan?n ek tedavi ihtiyac? olacak kadar semptom artma d?nemleri" ?eklinde belirtilmi?tir (3). Fransa'dan bir grup yazar taraf?ndan ise "Ast?m hastas?n?n klinik kontrol kriterlerinde ve fonksiyonel verilerinde bazale d?nmeksizin iki g?n boyunca bozulma olmas? ve tedavi gerektiren durum" ast?m ata?? olarak tan?mlanm??t?r (4). GINA Rehberinde "Ast?ml? hastada nefes darl???, ?ks?r?k, h?r?lt?l? solunum, g???ste bask? hissi gibi yak?nmalar?n?n ilerleyen art??? ve solunum fonksiyonlar?nda ilerleyen azalmalar olup, hastal???n gidi?inde bozulma saptanmas? ile tedavi de?i?ikli?i gerektiren durum" ast?m ata?? olarak tan?mlanm??t?r (5).
ATAK KR?TERLER?
KOAH
Bug?ne kadar KOAH'ta atak varl???n? ve a??rl???n? ortaya koyan yeterli duyarl?l?k ve ?zg?ll??e sahip belirlenmi? ideal bir biyolojik belirte? tan?mlanmam??t?r. Temel atak semptomlar? ile birlikte de?erlendirildi?inde 36 biyolojik belirte? aras?nda CRP'nin KOAH alevlenmelerini do?rulamada di?erlerine g?re daha etkili oldu?u g?r?lm??t?r (6). Serum CRP seviyesi > 3 mg/L olan KOAH olgular?nda, hastaneye yat?? ve ?l?mlerin CRP seviyesi < 3mg/L olanlardan y?ksek bulunmas? atak ?iddeti konusunda bilgi verebilece?ini d???nd?rmektedir (7).
Prokalsitonin pahal? bir y?ntem olmakla birlikte, serum d?zeyi bakteriyel nedenlere ba?l? ataklarda artt??? i?in viral nedenlerden ay?rt etme ve antibiyotik karar?nda yararl? olabilir. 2012'de Cochrane meta-analizinde, KOAH ataklar?n?n da dahil edildi?i akut solunum infeksiyonlar?nda prokalsitonin kullan?ld???nda mortalite veya tedavi ba?ar?s?zl???nda art?? olmadan antibiyotik kullan?m?nda azalma oldu?u bildirilmi?tir (8).
?nceden atak ?yk?s? olmasa bile CRP, fibrinojen ve l?kosit say?s?n?n artt??? hastalarda, atak riskinin y?ksek oldu?u bildirilmi?tir (9). Son y?llarda yap?lm?? ?al??malarda, KOAH atak a??rl???n?n de?erlendirilmesinde fibrinojen ve mikroalbumin?rinin ?nemli olabilece?i ileri s?r?lm??t?r (10-13). Stabil ancak duyarl? durumdaki hastada tetikleyicilerle havayolu mikrobiyomu de?i?erek atak semptomlar? ortaya ??kmaktad?r (14). Her atak gelecek ataklar i?in havayollar?n? daha duyarl? hale getirdi?inden, atak s?kl??? ve ?iddeti giderek artmaktad?r (15). Fakt?r ve k?me analizleri ile klinik fenotipleri ?ng?ren en ?nemli biyolojik belirte?lerin bakteriyel olaylarda balgamda IL-1b, vir?s ili?kili olaylarda kanda CXCL10 (IP-10), eozinofilik ataklarda periferik kan eozinofilisi oldu?u bildirilmi?tir (16).
Ast?m
Ast?m ataklar?nda kriterler semptom skoru (g?nd?z ve gece), PEF veya FEV1'de d??me, PEF variabilitesinde artma, k?sa etkili beta 2 kullan?m? ve acile ba?vuru olmas? ve hastane yat???d?r (3). Baz? rehber ve derlemelerde ise daha geni? genel g?r?n?m ve fizik muayene bulgular?n? da i?eren a??rl??a g?re de?i?en tan?mlamalar yap?lm??t?r (4,5,17-19).
ATAK SINIFLANMASI
KOAH
Semptomlara g?re atak s?n?flamas?; KOAH'ta Anthonisen s?n?flamas? nefes darl???, balgam miktar? ve balgam p?r?lans?ndaki art?? ?eklinde ?? temel ?zelli?i dikkate al?r. Ciddi ataklarda nefes darl???, balgam miktar? ve balgam p?r?lans?nda art?? ?eklinde ?? temel ?zellik varken (Grup 1), orta derecede bir atakta (Grup 2) bunlardan ikisi yer al?r. Hafif bir atakta (Grup 3) ise, bu ?? ?zellikten birine e?lik eden, yak?n zamanda ?st solunum yolu infeksiyonu veya ate? veya "h???lt?l? solunum, ?ks?r?k, solunum h?z? veya nab?z h?z?nda artma" gibi ?zelliklerden en az biri s?z konusudur (20,21).
Ek tedavi gereksinimine g?re atak s?n?flamas?: Hafif (mevcut ila?lar?n?n kullan?m?nda art??), orta (atak s?ras?nda antibiyotik ve/veya sistemik steroid kullan?m?) ve ciddi KOAH ataklar? (hastaneye yat?? gerektiren atak) olarak s?n?fland?r?lmaktad?r.
Atak s?kl???na g?re: Hastal?k ilerledi?inde ataklar daha s?k ve ?iddetli olmakta ve atak s?kl???, KOAH'l? hastan?n ya?am kalitesinin daha da d??mesi ile sonu?lanmaktad?r. Bununla birlikte, benzer hava ak?m? k?s?tl?l??? olan hastalarda atak s?kl??? bireyler aras?nda farkl?l?k g?stermektedir. Ger?ekten de baz? hastalarda solunum fonksiyonlar?ndan ba??ms?z olarak atak s?kl???n?n daha fazla olmas? (≥ 2 atak/y?l, evre 2 KOAH) ve gelecek ataklar? ?ng?ren en ?nemli belirleyici kriterin ?nceki atak ?yk?s? olmas? nedeniyle bu grup hastalar "s?k atakl? fenotip" olarak tan?mlanm??t?r (22).
Ast?m
Ast?m ataklar? ?e?itli ?ekilde s?n?flanabilirler.
Geli?im s?resine g?re: Ast?m ataklar? h?zl? geli?en ve yava? geli?en olarak ikiye ayr?labilir. H?zl? geli?en ataklar birka? saatte en ?st seviyeye var?r. Bunlarda CD8 lenfosit ve n?trofil hakimiyeti s?z konusudur (23). Esas sorun inflamasyon kadar d?z kas kas?lmas?n?n varl???d?r. Yava? geli?enler birka? g?n i?inde, ortalama 3-7 g?nde en ?st seviyeye gelip, yine bu s?relerde d?zelir. Bunlarda CD4 lenfosit ve eozinofil hakimiyeti vard?r (23).
Atak s?kl???na g?re: Y?lda ≥ 2 atak ge?iren hastalar s?k atak ge?iren fenotip olarak s?n?fland?r?lm??t?r (24).
Atak zaman?na g?re: BIOAIR ?al??mas?nda ?? grup ortaya konmu?tur. ?lkbahar atakl?lar: Nisan, May?s, Haziran d?neminde, y?lda bir veya daha fazla atak ge?irenler; Sonbahar atakl?lar: Ekim, Kas?m, Aral?k d?neminde, y?lda bir veya daha fazla atak ge?irenler; Mevsimsiz atakl?lar: ?nceki belirtilen aylar d???nda y?lda minimum bir atak ge?irenler ?eklindedir (24).
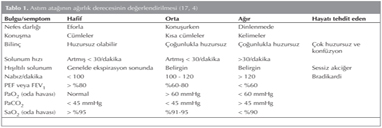
A??rl???na g?re ataklar: ERS/ATS ortak raporunda ?al??malarda atak kavram?n?n sadece orta ve a??r ataklar? tan?mlad??? vurgulanarak, a??r-ciddi ataklar?n; en az 3 g?n sistemik kortikosteroid gerektiren veya kortikosteroid verilerek hospitalizasyon ve acil ba?vurusu olu?turan, orta ataklar?n ise en az iki g?n s?reyle semptom ve/veya akci?er fonksiyonlar?nda k?t?le?me, kurtar?c? ila? ihtiyac?nda art??a neden olan ama kortikosteroid ba?lama ve/veya hastaneye ba?vurma gerektirmeyen olarak tan?mlar? yap?lm??t?r (3). TTD 2014 a??rl???na g?re atak s?n?flamas? ise Tablo 1'de g?sterilmi?tir.
GINA 2014 rehberinde ataklar ?iddetine g?re, hafif-orta ve a??r olarak ikiye ayr?lm??t?r. TTD rehberindeki orta ve a??r atak tan?mlar? GINA rehberi tan?mlar? ile ?rt??mektedir.
?zel terminolojili ataklar:
"Status astmaticus"; yirmi d?rt saatten uzun s?ren, a??r, hayat? tehdit eden ast?m ataklar?n?n genel terminolojisi olarak kullan?lm??t?r, h?zl? etkili beta agonistlere cevaps?z, yo?un mukus art??? saptanan, h?zl? veya yava? ba?layabilen ataklard?r (25-27).
"Brittle" ast?m; s?kl??? %0.05 olarak verilmektedir. Tip1; 1500 ?g ve ?st? inhale kortikosteroid (IKS) tedavisine ra?men en az 150 g?n?n yar?s?nda %40'dan fazla PEF variabilitesi olmas?, Tip 2; ?ncesinde, tetikleyen bulunmamas? ve normal solunum fonksiyonlar? olmas?na ra?men ?? saat i?inde geli?en ani a??r atak ile karakterizedir (28).
Neredeyse ?l?mc?l ataklar; yo?un bak?mda tedavi edilen, int?basyon gerektiren, hiperkarbik, asidemik ?zelliklere sahip ataklard?r (29). Olgular?n ??te biri h?zl? geli?en (Ani asfiksik ast?m) tipindedir, 2/3 olguda yava? geli?en atak g?r?l?r (29).
Fatal (?l?mc?l) ast?m ata??; ani, dakikalar i?inde ?l?mle sonu?lanan ataklard?r. Bunlar?n eri?kinlerde %13'?n?n hafif, %22'sinin orta ve %6's?n?n a??r ast?m olgular? oldu?u g?zlenirken, ?ocuklarda %23'? hafif, %41'i orta ve % 36's? a??r olgu olarak bildirilmi?tir (25,30).
ATAKLARIN ?NG?R?LMES?
KOAH ve ast?m?n g?ncel kontrol?n?n sa?lanmas?, semptomlar?n azalt?lmas? ve gelecek risklerin ?nlenmesi KOAH ve ast?m tedavisinin ana hedefleridir.? Ast?mda g?ncel kontrol?n sa?lanmas?yla, bile?enleri "k?t?le?me, solunum fonksiyon kayb?, ataklar, mortalite ve ila? yan etkileri" olan gelecek risklerin de ?nlenece?i kabul edilirken, KOAH'ta semptomlar?n ve gelecek risklerin azalt?labilece?i kabul edilmektedir.
KOAH
Bir ?nceki y?l atak ge?irmi? olmak, ?zellikle iki ve daha fazla atak ge?irmi? olmak veya atak nedeniyle bir kez hastaneye yat?? ?yk?s? tan?mlamak KOAH olgular?nda gelecek riskleri art?rmakta ve atak ge?irme ihtimalini y?kseltmektedir (1,31).
KOAH'a e?lik eden hastal?k olmas? halinde, ataklar s?ras?nda e?lik eden hastal???n ve KOAH'?n klinik durumunu k?t?le?tirebilir. ?rne?in atak kalp yetersizli?ini, kalp yetersizli?i de dispne d?zeyini art?rarak ata?? a??rla?t?rabilir. Komorbiditelerin oldu?u ?zellikle kardiovask?ler komorbiditelerin oldu?u, hastalarda ataklar daha s?kt?r.
KOAH'n?n ileri evrelerinde ataklar s?kt?r. Ancak ECLIPSE (Evaluation of COPD Longitudinally to Identify Predictive Surrogate Endpoints) ?al??mas?nda da g?zlendi?i gibi orta KOAH olgular?nda da atak ve s?k ataklar g?zlenebilir. T?m GOLD evrelerinde g?zlenebilen bu fenotip, ECLIPSE ?al??mas?nda Evre 2 hastalarda %22 oran?nda bildirilmi?tir (22,31).
ECLIPSE ?al??mas?n?n ?oklu varyans analizinde, ?nceki atak ?yk?s? ve hastal?k ?iddeti d???nda gastro?zofageal refl?, l?kosit say?s?nda y?kseklik de s?k ataklar ile ili?kili bulunmu?tur (31).
Hava ak?m? k?s?tl?l??? ?iddetinden ba??ms?z olarak, amfizemin a??rl??? ve hava yolu duvar kal?nl??? da s?k atak a??s?ndan ?nemlidir. Segmental hava yolu duvar kal?nl??? 1 mm artt???nda atak s?kl??? 1.84 kat, akci?erlerinde %35 ve daha fazla amfizem olanlarda amfizem oran? %5 artt???nda 1.18 kat artmaktad?r (32).
Semptomlar?n g?nl?k kartlarla takip edildi?i olgularda KOAH ata?? ge?iren hastalar?n yar?s?n?n tedavi i?in doktora ba?vurmad???, ?stelik bildirilmemi? bu ataklar?n hastan?n sa?l?k durumu ?zerine olumsuz etkilerinin oldu?u kaydedilmi?tir (33). Bu nedenle atak tan?s? ve de?erlendirilmesinde EXACT (Exacerbations of Chronic Pulmonary Disease Tool) veya KOAH de?erlendirme testi (COPD Assessment Test-CAT) gibi ara?lar?n kullan?lmas? ?nerilmektedir (34,35). EXACT skorlar? ile solunum fonksiyonlar?, atak s?resi ve sistemik inflamasyonla tan?mlanan atak ?iddeti aras?nda anlaml? korelasyon bulundu?u, tedavi gereksinimi olan ve olmayan ataklarda ayn? derecede duyarl? oldu?u, buna kar??l?k, ataklar?n ba?lang?c?n?n tan?mlanmas? ve s?kl???n?n belirlenmesinde net sonu?lar olmad??? saptanm??t?r (34).
CAT skoruyla semptomlardaki d?zelmenin birbiriyle uyumlu oldu?u g?zlenmi?, atak s?resi ve solunum fonksiyonlar?ndaki de?i?melerle CAT skorlar? aras?nda anlaml? korelasyon olmas? CAT skorunun atak ?iddetini yans?tabilece?ini d???nd?rm??t?r (35).
KOAH ve pn?moni olan hastalarda DECAF (Dispne, Eozinopeni, Konsolidasyon, Asidemi ve Atriyal fibrilasyon) skorunun mortaliteyi CURB-65 skoruna g?re daha do?ru ?ng?rebildi?i g?zlenmi?tir (36).
CODEX (Comorbidite, Obstr?ksiyon, Dispne, EXaserbasyon) indeksi 3. ay ve 1. y?lda hastaneye yeniden yat?? ve mortalite ile anlaml? korelasyon g?stermi?tir (37).
Ast?m
G?ncel ast?m kontrol?n?n bile?enlerinin her birindeki k?t?le?me ast?m ataklar? i?in haberci olabilmektedir (19). Bile?enler; semptomlar, kurtar?c? kullan?m?, aktivite k?s?tlanmas? ve solunum fonksiyon testleridir. Bunlar? de?erlendiren, ast?m ataklar?n?n ?ng?r?lmesinde yararl? olabilecek fakt?rler aras?nda kontrol/semptom anketleri, hava yolu obstr?ksiyonunun a??rl???, FEV1 de?eri ve yak?n tarihte ge?irilen ataklar say?labilir. Balgam eozinofilisi, ekshale solukta nitrik oksit ?l??m? (FENO) ise ataklar? ?ng?rmede kullan?lan noninvaziv, objektif belirte?lerdir (38).
Onbin d?rty?z yirmi sekiz ast?ml? hastan?n, anket sonu?lar?na g?re takipte acil ba?vuru oranlar?n?n; ilk de?erlendirmede ast?m? kontrol alt?nda olmayanlarda %59, tam kontrol alt?nda olanlarda %15 oldu?u g?sterilmi?tir (39). Son bir ay i?inde ast?m nedenli hastane yat??lar?n?n; ast?m? kontrol alt?nda olmayan hastalarda [Ast?m Kontrol Testi, (AKT) < 20] ast?m? kontrol alt?nda olanlara (AKT ≥ 20) g?re anlaml? olarak y?ksek oldu?u g?sterilmi?tir (40). Ba?lang?? AKT de?eri > 15 olan hastalarda, ast?m tedavisine ra?men takipteki 6 ay i?inde ACQ de?eri daha d???k olan hastalara g?re daha fazla atak g?zlenmi?tir. ?stelik bu ?al??mada ACQ de?eri azald?k?a atak s?kl???n?n da azald??? g?sterilmi?tir (41).
On iki ayl?k prospektif bir kohortta ise ast?m? kontrol alt?nda olmayan hastalarda kontrol alt?nda olanlara g?re atak ge?irme olas?l???n?n 3.6 kat, plans?z doktor vizitlerinin 8 kat, acil servis ba?vurular?n?n 20 kat fazla oldu?u g?sterilmi?tir (42). ?? y?z yetmi? ast?ml? hastan?n dahil edildi?i ba?ka bir ara?t?rmada, FENO ve FEV1 ile kar??la?t?r?ld???nda AKT'ndeki d???kl???n gelecek alt? aydaki ast?m ata?? ve acil servis ba?vurular?n? ?ng?rmede en duyarl? parametre oldu?u g?sterilmi?tir (43). Baz? ara?t?rmac?lar ast?m kontrol de?erlendirmesinin ba?ka objektif verilerle beraber kullan?m?n?n ata?? ?ng?rmede daha etkin oldu?unu belirtmektedirler. Tek ba??na AKT kullan?lmas? ile (AKT ≤ 23) ata?? ?ng?rme olas?l??? %60.3 iken, AKT ≤ 23 ile beraber FEV1 ≤ %91.8 al?nd???nda olas?l???n %85'e ??kt??? g?sterilmi?tir (38). Semptom skorlar? ile beraber tepe ak?m h?z? takibi yapan hastalarda bu de?erin belirlenen e?i?in alt?na d??mesinin de ataklar? ?ng?rmede anlaml? oldu?u g?sterilmi?tir (44).
S?k kullan?lan kurtar?c? ila?lar ast?m?n kontrol alt?nda olmad???n?n belirte?lerinden biridir. Do?al olarak bu hastalarda atak riski y?ksektir. Bu ama?la yap?lan bir ara?t?rmada ?ocuklarda y?lda ??, eri?kinlerde y?lda iki kanister k?sa etkili beta agonist kullan?m?n?n her iki grupta da daha az kullananlarla kar??la?t?r?ld???nda hospitalizasyon ve acil servis ba?vurular?n? yakla??k iki kat artt?rd??? g?r?lm??t?r (45). ?stelik atak riskindeki bu art?? hastan?n ald??? kontrol edici tedavinin yo?unlu?undan ba??ms?zd?r ve rahatlat?c? ila? kullan?m s?kl??? artt?k?a atak riski de artmaktad?r (46).
Hastan?n inhale steroide uyumunun da ataklar? ?ng?rmede yararl? oldu?u g?sterilmi?tir. Bir y?l boyunca kullan?lan kontrol edici ila?lar?n, rahatlat?c? ila?lar?n yar?s?ndan az olmas?n?n da atak riskini ?ng?ren bir parametre oldu?u g?sterilmi?tir (47).
FENO de?erleri y?ksek olan hastalar?n ast?m ata?? i?in riskli olduklar? g?sterilmi?tir. Eri?kinlerde 50, ?ocuklarda 35 ppb ?zeri ?l??mlerin hastan?n mevcut klinik durumdan ba??ms?z olarak artm?? atak riskini veya klinik k?t?le?me olas?l??? yans?tt??? kabul edilmektedir (48). ?? y?z d?rt ast?ml? olguda FENO de?erinin beklenenin ?? kat? olmas?n?n SFT ve AKT'den ba??ms?z olarak atak ge?irecek hastalar? ?ng?rmede de?erli oldu?u g?sterilmi?tir. ?zellikle persistan atopik ve sigara i?meyen hastalarda FENO ?l??m?n?n kontrols?z ast?m? ?ng?rmede klinik olarak kullan?labilece?i d???n?lmektedir (49).
FENO'nun SFT ile beraber de?erlendirildi?i 53 ast?m hastas?n?n 18 ay boyunca takip edildi?i ba?ka bir ?al??mada ise olgularda geli?en ataklar?n %92'si ba?lang?? FEV1 < %76; %59'u FeNO > 28 ppb olan olgularda g?r?lm??. Bu de?erlere sahip bir ast?ml?n?n 18 ay i?inde atak ge?irme olas?l??? %85 bulunmu?tur (50).
?nhaler steroid dozu azalt?lmas? sonras?nda ba?lang?? balgam eozinofilisi y?ksek olan olgularda ast?m ata?? geli?ti?i g?zlenmi?tir. Yap?lan alt analizlerde balgam eozinofilisi ve FENO'nun y?ksekli?inin SFT'deki d???? ile korele oldu?u, ancak lojistik regresyon analizinde ata?? ?ng?rmede en anlaml? parametrenin balgam eozinofilisi oldu?u g?sterilmi?tir (51). Bir ba?ka ?al??mada ise inhale steroidin kesilmesinden iki hafta sonra bak?lan balgam eozinofilisi art??? bu olgularda ast?m ata??n? ?ng?rmede anlaml? bulunmu?tur (52).
Ge?irilen ataklar?n da, ge?irilecek ataklar i?in risk olu?turdu?u g?zlenmi?tir. Ast?ml? ?ocuklarda yap?lan bir ?al??mada ast?m a??rl??? veya kontrol?nden ba??ms?z olarak, bir ?nceki y?l atak ge?iren ?ocuklarda, sonraki y?l di?er ?ocuklara oranla daha fazla atak ge?irdikleri g?zlenmi?tir (53).
Sonu? olarak, t?m bu verilerin ?????nda ve yap?lan meta analizlerle, ?nceden ast?m ata?? ge?irmi? olmak, s?k rahatlat?c? ila? kullan?m? gereksinimi, solunum fonksiyonlar?, ast?m kontrol?, FENO y?ksekli?i ve balgam eozinofilisi gelecek ast?m ata??n? ?ng?rmede kullan?labilecek parametrelerdir (54).
ATAKLAR ve GELECEK R?SK
KOAH
"Ataklar ve komorbiditelerin KOAH'ta a??rl??? belirleyen en ?nemli etkenler" oldu?u belirtilmi?tir (1). Ataklar solunum fonksiyonlar?ndaki kayb? h?zland?rd???, ya?am kalitesini bozdu?u ve mortaliteyi art?rd??? i?in ataklar?n de?erlendirilmesi hastal???n k?t? gidi?at?n?n belirlenmesiyle ayn? anlama gelmektedir (1). GOLD'a g?re yeni KOAH evrelemesi de temel olarak risk ve semptomlar?n belirlenmesi ?zerine kurgulanm??t?r. Hastan?n son y?lda hi? atak ge?irmemesi ya da hastaneye yat?? gerektirmeyen bir atak ge?irmesi d???k risk, iki ve daha fazla atak ge?irmesi ya da hastaneye yat?? gerektiren en az bir atak ge?irmesi ise y?ksek risk olarak kabul edilmektedir. ECLIPSE ?al??mas?n?n sonu?lar? incelendi?inde spirometrik GOLD evreleri ile s?k atak ge?irme ve hastaneye yat?? gerektiren atak ge?irme aras?nda ili?ki oldu?u g?r?lmektedir. Evre 2 KOAH'l?larda hastaneye yat?? gerektiren atak ge?irenlerin oran? %7 iken, Evre 3'te bu oran %18, Evre 4'te ise %33't?r. Yine s?k atak ge?irenlerin oran? Evre 2, 3 ve 4'te s?ras?yla %22, %33 ve %47'dir (31).
KOAH ataklar?nda inflamatuar belirte?lerde art?? oldu?u g?sterilmi?tir. Yine KOAH'l? olgularda y?ll?k atak say?s? ile IL-6 ve -8 gibi inflamatuvar belirte?ler aras?nda ili?ki oldu?u da saptanm??t?r (55).
KOAH'ta s?k atak ge?irmenin solunum fonksiyonlar?ndaki y?ll?k kay?pla, ya?am kalitesi, hastaneye yat?? ve mortalite ile ili?kili oldu?u g?r?lmektedir. KOAH'ta ataklar?n ?nem kazanmas? ve tedavinin ana amac?n?n ataklar?n ?nlenmesi olmas? da bu nedenlerledir. S?k atak ge?irenlerle, s?k atak ge?irmeyenler aras?nda y?ll?k 8 mL istatistiksel olarak anlaml? FEV1 kayb?nda fark saptanm??t?r (56). Atak say?s? ile SGRQ skoru aras?nda ili?ki g?sterilmi?tir. KOAH nedeniyle hastaneye yatan olgularda alt? dakika y?r?me testi (DYT)?nde anlaml? derecede d??me saptanm??t?r (57). Atak ge?irme s?kl??? ile mortalite aras?ndaki ili?kiye bak?ld???nda da bir ?nceki y?l hi? atak ge?irmeyenlerde mortalite riski %35.7 iken iki atak ge?irenlerde %58.2 ve d?rt ve ?zerinde atak ge?irenlerde ise %70.3 olarak bulunmu?tur (58). Suissa ve arkada?lar? da bir atak sonras?nda olgular?n yakla??k %50'sinin ilk d?rt y?l i?inde ?ld???n? g?stermi?lerdir (15). Ata??n a??rl???n?n da s?rviyi etkiledi?i ve hastaneye yatma gerektiren atak ge?irenlerde be? y?ll?k s?rvinin ayaktan tedavi edilenlerden daha k?t? oldu?u g?r?lm??t?r (59).
KOAH'ta mortalite nedenlerinin ba??nda kardiyovask?ler hastal?klar gelmektedir. Kardiyovask?ler hastal?klarla akut atak aras?ndaki ili?kiye bak?ld???nda, atak say?s? ile miyokord infarkt?s? (MI) ge?irme riski aras?nda korelasyon g?sterilmi?tir (60).
Sonu?ta KOAH'ta atak s?kl??? ve ata??n a??rl??? ya?am kalitesi, prognoz ve y?ll?k FEV1 kayb? a??s?ndan en ?nemli fakt?rlerdendir.
Ast?m
A??r ast?ml?larda pek ?ok ?al??ma atak oranlar?n?n artt???n? belirtmektedir. A??r ast?ml?larda ast?m?n a??rl??? ile ataklar aras?nda yak?n ili?ki oldu?u g?sterilmi?tir (61). Eozinofilik a??r olgular ve erken ba?lang??l? a??r allerjik ast?ml?larda da ataklar?n artm?? oldu?u bildirilm?tir (61).
Aspirin duyarl??? da atak riskini art?rmada ?nemli bir risk fakt?r?d?r (62). Ayr?ca KOAH-ast?m "overlap" sendromunun da atak ve hospitalizasyon riskini artt?rd??? g?zlemlenmi?tir (63). Ataklar yeni ataklar?n habercisidir (64). S?k atakl? olguda hastaneye yat?? oranlar? da artar (65). Daha ?nce hastane yat??? olmas? ast?m mortalite riskini on kat art?r?r (66). Atak ge?iren olgularda FEV1 ve FEV1/FVC'deki kay?p atak ge?irmeyenlere g?re daha fazla olmaktad?r (67,68).
ATAK NEDENLER?
KOAH
KOAH atak nedenleri infeksiyonlar ve infeksiyon d??? nedenler olmak ?zere iki ba?l?kta toplanabilir. ?nfeksiyon d??? nedenleri ba?l?ca ?evresel fakt?rler (i? ve d?? ortam hava kirlili?i, mevsimsel de?i?iklikler), kardiyovask?ler hastal?klar, ast?m-KOAH "overlap" sendrom varl???, KOAH-obstr?ktif uyku apne "overlap" sendrom varl???, pulmoner emboli, gastro-?zefageal refl?, anksiyete-depresyon, pulmoner hipertansiyon ve di?er nedenler (sigara, inhale kortikosteroid, periodontal hastal?k, pn?motoraks, pl?rezi gibi) ?eklinde alt ba?l?klara ay?rabiliriz.
?nfeksiyonlar: KOAH ataklar?n?n kabaca %80'inden bakteriyel ve/veya viral alt solunum yolu infeksiyonlar? sorumludur (33). Bakteriyel infeksiyonlar ataklar?n %30-50'sinden, mekanik ventilasyon gerektiren ataklar?n ise %70'inden sorumludur (69,70). ?nfektif ataklardan sorumlu bakteriler i?erisinde en s?k saptananlar H. influenzae, M. catarhalis, S. pneumoniae ve H. parainfluenzae'd?r. ?leri evre KOAH'da ve bron?ektazinin e?lik etti?i olgularda ise P. aeroginosa ve Enterobactericeae s?kt?r (71-73). Klinik olarak stabil KOAH olgular?n?n %30'unda alt solunum yolu potansiyel patojenik mikroorganizma ile kolonizedir ve bu olgularda ataklar daha s?kt?r (74,75).
Son y?llarda polimeraz zincir reaksiyonu (PCR) tekniklerindeki geli?meler KOAH ataklar?nda vir?slerin san?landan daha s?k ve daha ?nemli rol oynad???n? g?stermi?tir (76-79). Viral ataklarda klinik genel olarak daha a??rd?r, FEV'deki d???? daha fazlad?r ve iyile?me s?reci daha uzundur (79). Viral ataklar?n bir di?er ?zelli?i de bir k?sm?nda sekonder bakteriyel infeksiyonlar?n geli?mesidir (80).
?nfektif ataklar?n kabaca %25'inde viral ve bakteriyel etkenler bir aradad?r ve bu miks infeksiyonlarda inflamasyonun d?zeyi ve ata??n ?iddeti daha a??rd?r.
?nfektif ataklar?n k???k bir k?sm?ndan Chlamydia ve Mycoplasma t?rleri sorumludur (81). Daha nadir olmakla birlikte atipik mikobakterilerin ve mantar infeksiyonlar?n?n da atak nedeni olabilece?i unutulmamal?d?r (82,83).
?nfeksiyon d??? nedenler: Hava kirlili?i t?m ataklar?n kabaca %5'inden sorumludur (1). D?? ortam hava kirlili?i ile atak/hastane yat??? aras?nda bir ili?ki oldu?unu g?steren yeterli say?da ?al??ma varken ev i?i hava kirlili?i ile atak ili?kisine ait veriler yetersizdir (82,83). Mevsim de?i?ikliklerinin ve so?uk havan?n da ataklar ?zerinde etkili oldu?u bildirilmi?tir (84,85). Kardiyovask?ler hastal?klar hafif-orta ?iddette KOAH i?in ?nemli bir mortalite nedenidir (86). Atak nedeniyle hastane ba?vurusundan 24 saat sonra ?len 43 KOAH olgusunun otopsi de?erlendirmesinde en s?k ?l?m nedeni kalp yetmezli?i (%37.2) olarak bulunmu?tur (87). Atak nedeniyle hastaneye yat?r?lan ve ba?vuru yak?nmas?nda g???s a?r?s? olmayan 242 olgunun (69 ya?, erkek %45 ve yar?s? aktif i?ici) yar?s?nda takipte g???s a?r?s? saptanm?? (%26's?nda eforla ortaya ??kan) ve %8.3'? MI tan?s? alm??t?r (88). Hiperkapnik solunum yetersizli?i nedeniyle invaziv mekanik ventilasyon uygulanan KOAH olgular?n?n %41'inde ekokardiyografi ile daha ?ncesinde bilinmeyen sol ventrik?l disfonksiyonu saptanm??t?r (89). Hastane yat??? gerektiren ilk ataktan ?? ay sonra tetkik edilen 342 KOAH olgusunun %67'sinde ekokardiyografi (EKO) incelemesinde anlaml? kardiyak patoloji (%27 sol, %48 sa? kalp yetmezli?i) saptanm?? ve EKO bulgular? hastal?k ?iddeti ile ili?kisiz bulunmu?. Bu ?al??mada hastanede yatan KOAH olgular?nda ekokardiyografinin daha s?k kullan?lmas? gerekti?i bildirilmi?tir (90).
Ast?m-KOAH "overlap" sendromu ileri ya?larda daha s?kt?r. Elli ya? alt?ndakilerde bu oran %10'un alt?nda iken 80 ya? ve ?zeri olgularda oran %50'den fazlad?r (91). Bu olgularda atak s?kl??? ve ?iddeti sadece KOAH'? olan olgulara g?re ?? kat daha fazlad?r (63).
KOAH olgular?nda obstr?ktif uyku apne s?kt?r ve bu olgularda ?l?m riski ve ataklara ba?l? hastane yat??lar? saf KOAH olgular?na g?re anlaml? olarak daha fazlad?r. CPAP kullanan (n= 228) ve kullanmayan? (n= 213) "overlap" sendromu olgular?n?n saf KOAH olgular? (n= 210) ile kar??la?t?r?ld??? uzun s?reli takip ?al??mas?nda (ortalama 9.4 y?l) hastane yat??? gerektiren ilk atak oran? CPAP kullanmayanlarda %61.4, CPAP kullananlarda %46.9 ve saf KOAH olgular?nda %39.5 saptanm??t?r (63).
KOAH ataklar?nda ven?z tromboemboli (VTE) s?kt?r, ?nemli bir mortalite nedenidir ve nedeni saptanamayan ataklarda prevalans artar (87,92-94). Bir meta-analizde acilde tetkik edilen KOAH atak olgular?nda VTE prevelans? %3.3 iken hastaneye yat?r?lan ataklarda bu oran %24.7 saptanm??t?r (95).
Bilinen refl?s? olmayan 221 stabil KOAH olgusunun bir y?ll?k takip ?al??mas?nda refl? semptom sorgulamas? ile prevalans? %26.7 saptanm?? ve bir y?ll?k takipte refl?s? olanlarda atak ve ata?a ba?l? hastane yat??lar? daha fazla bulunmu? (96). Refl?n?n ?iddeti artt?k?a atak s?kl??? da artmaktad?r (96-98).
Mevcut literat?r bilgisi depresyonun ve ?zellikle anksiyetenin KOAH ataklar? i?in bir risk fakt?r? oldu?unu g?stermektedir (99,100).
"COPDGene" ?al??ma hastalar?nda (3464, Evre II-IV KOAH olgusu/10 300 olgu) akci?er tomografisinde pulmoner arter geni?lemesi (PA/Aorta oran?> 1) ile ge?mi?teki a??r atak hikayesi aras?nda anlaml? bir ili?ki saptanm??t?r (OR 4.78, %95 CI, 3.43-6.65, p< 0.001) (101). PA/A oran?n?n birden b?y?k olmas?n?n gelecekteki a??r alevlenmeler i?in ba??ms?z bir risk fakt?r? oldu?u bildirilmi?tir (OR 3.44, %95 CI, 2.78-4.25, p< 0.001) (101).
Pn?motoraks, pl?rezi, sigara i?menin s?rd?r?lmesi gibi fakt?rler de ataklara neden olabilir. Son y?llarda KOAH'da periodontal hastal???n s?k oldu?unu g?steren ?al??ma ise etkin periodontal hastal?k tedavisinin KOAH ataklar?n? azaltt??? g?sterilmi?tir (102). ?nhaler kortikosteroid kullan?m? KOAH olgular?nda pn?moni riskini art?rabilmektedir (103).
Ast?m
Ast?m ataklar? tetikleyen etkenlere maruziyet veya tedavinin hasta veya hekim taraf?ndan aksat?lmas? veya yetersiz verilmesi ile ortaya ??kar. ?? veya daha ?ok atak ile ba?vurular incelendi?inde hafif ast?ml?lar?n %5, orta a??rl?ktakilerin %13 ve a??r ast?ml?lar?n %54'?nde g?r?len bu durumun kad?n cinsiyet, obezite, psikososyal durum, solunum yolu infeksiyonu, sigara kullan?m?, refl?, sin?zit, uyku apne olmas? ile ili?kili oldu?u g?r?lm??t?r. Tetikleyen etkenlere bak?ld???nda ?ocuklardaki wheezing epizodlar?n?n %80'inde ve eri?kin wheezing epizodlar?n?n ise yar?s? ile d?rtte ???n?n PCR ile viral oldu?u saptanm??t?r. Bunlar i?inde en ?ok sorumlu tutulan rinovir?sler, respiratuar sinsisyal vir?s ve influenzad?r. Bunlar?n d???nda coronavir?s, metapn?movir?s, parainfluenza, adenovir?s, bakovir?s gibi ajanlarada rastlanm??t?r. Bu vir?slerde mevsime ba?l? art??lar g?r?lebilir. Yine bir di?er art?ran neden allerjenlere maruziyetle birlikte viral infeksiyonun bulunmas?d?r. Bir arada sinerjistik bir etki yaratt?klar? bildirilmektedir. Ayn? ?ekilde viral infeksiyonlar bakteriyel infeksiyonlar?nda yerle?mesine makrofaj aktivitesini bozarak kolayl?k sa?lamaktad?r. Ast?m olgular?nda bakteriyel infeksiyonda en s?k %5 oranlar?nda saptanan etkenler atipik ajanlar K. pneumoniae ve M. pneumoniae?d?r. Hava kirlili?i veya ?al??ma ortam?ndaki gazlar bildirilen di?er etkenler olarak ortaya ??kmaktad?r. Sigara da benzeri di?er bir risk fakt?r?d?r. Her ikisi de allerjen duyarl?l??? ve vir?slerin etkilerini kolayla?t?r?c? rolleri ile de ataklarda rol oynarlar. Hamile ast?ml?lar?n %20 kadar?nda da ataklar?n daha s?k oldu?u bildirilmektedir. Stres ve psikolojik fakt?rlerde yine ataklar?n olu?umunda bildirilen di?er nedenler olarak ortaya ??kmaktad?r. Tedavinin aksat?lmas? veya yetersiz kalmas? da atakla sonu?lan?r (104,105).
ATAK F?ZYOPATOLOJ?S?
KOAH
KOAH ata??nda infeksiyon veya poll?tanlar hava yolu mukozas?nda hasar, ?dem ve a??r? mukus sekresyonuyla karakterize bir hava yolu inflamasyonuna neden olurlar. Hava yolu direnci (Raw) ve elastans artar, ekspiratuar ak?m h?zlar? azal?r, h?zl?, y?zeyel solunum nedeniyle Ttot (solunum s?resi), TI (inspirasyon s?resi) ve TE (ekspirasyon s?resi'nin (TI< TE) azalmas? atak s?ras?nda pulmoner hiperinflasyonun belirginle?mesine yol a?ar. Hava yolu direncinin artmas? ve pulmoner hiperinflasyona ba?l? intrensek PEEP art??? (PEEPi) solunum i?inin artmas?na yol a?ar. Solunum i?inin artmas? ve hiperinflasyona ba?l? geli?en solunum kas g??s?zl??? bu hastalarda oksijen t?ketiminin artmas?na, solunum kaslar?nda yetersizli?e ve akut solunum yetmezli?ine neden olur (106).
KOAH ata??nda s?kl?kla g?r?len semptomlar ?ks?r?k, p?r?lan balgam ve dispne art??? olmakla birlikte h???lt?l? solunum, g???ste tutukluk hissi ve ?st solunum yolu infeksiyonuna ili?kin bulgular da e?lik edebilir (33).
KOAH ata??nda s?kl?kla g?r?len semptomlar ?ks?r?k, p?r?lan balgam ve dispne art??? olmakla birlikte h???lt?l? solunum, g???ste tutukluk hissi ve ?st solunum yolu infeksiyonuna ili?kin bulgular da e?lik edebilir.
KOAH ata??nda dispne ?e?itli mekanizmalarla ortaya ??kar;
? Hava yolu diren? art??? nedeniyle solunum i?inin artmas? sonucunda solunum kaslar?nda bulunan propriosept?rler ve metaboresept?rlerden kaynaklanan impulslar dispnenin a??r? solunum eforu ?eklinde alg?lanmas?na yol a?ar.
? Dinamik hiperinflasyondaki art?? solunum kaslar?n?n etkinli?inin azalmas?na, kaslar?n uzunluk-gerilim ?zelliklerinin de?i?mesine neden olur, g???s duvar? propriosept?rleri ile akci?erlerin yava? adaptasyon g?steren (SARs) ve h?zl? adaptasyon g?steren ((RARs) gerilme resept?rlerininin aktivasyonu sonucunda hava a?l??? ?eklinde bir dispne alg?s? ortaya ??kar.
? Bron? mukozas?n? innerve eden vagal afferentler olan bronkopulmoner C- fibrilleri de kimyasal irritanlar, infeksiyon ajanlar? ve inflamatuvar mediat?rler taraf?ndan aktive edilir. C-fibril resept?rlerinin aktivasyonu bron?iyal tonus art???, dispneyle birlikte ?ks?r?k ve a??r? mukus sekresyonuna neden olur (107,108).
Sistemik inflamasyon nedeniyle sal?nan TNF-, IL-1ve IL-6 gibi sitokinler y?ksek ate?e neden olur. Bu sitokinler beyinde organum vasculosum laminae terminalisteki n?ronlar? aktive eder, bu b?l?m hipotalamusla ba?lant?l?d?r ve termoreg?lasyonu d?zenler. Sistemik dola??ma sal?nan bakteriyel endotoksinler de bu pirojenik etkiye neden olabilir. PGD2, PGE2, PGF2, PG12 ve tromboksan A2 gibi prostanoidler de sistemik inflamasyonda adaptif yan?tlarda rol al?r. Bakteriyel endotoksinlere ate? yan?t?nda preoptik n?ronlardaki PGE2 resept?rleri primer rol? oynar.
Tromboksan A2 ve PGF2 kalbe direkt etkiyle ta?ikardiye yol a?ar, bu etki sempatik sinir sistem etkisinden ba??ms?zd?r. Ancak sistemik inflamasyon olu?umunda sempatik sinir sistemi ?zerinden de ta?ikardiye neden olabilir. Havayollar?ndaki inflamasyonun yol a?t??? bronkopulmoner C-fibril aktivasyonu ise bradikardi ve hipotansiyona neden olabilir (107).
Ast?m
Ast?m olgular?nda gerek olgular?n farkl? derecelerde bulunmas?, gerek farkl? fenotipler olmas? gerekse ata?? ba?latan etkenlerin ?e?itlili?i fizyopatolojik de?i?ikliklerde de farkl?l?klar olu?mas?na neden olmaktad?r. Ancak sonu? farkl? mekanizmalarla da olsa inflamasyonunun artmas?, bron? d?z kaslar?n?n kas?lmas?, ?dem, mukus art??? ile hava yollar?nda k?s?tlama olu?mas?d?r. Bu k?s?tlanma semptomlar? ve fizik muayene bulgular?n? ba?lat?rken KOAH'a benzer mekanizma ile hava hapsi ile resid?el vol?m ve total akci?er kapasitesi art???n? da olu?turur. Hastan?n FEV1 d????? ile birlikte hava hapsine paralel olarak FVC'si de d??er. ?zellikle bu olgular?n fenotiplerinin bilinmesi obezite gibi ek fakt?rlerin bulunmas? fizyopatoloji kadar tedavilerinin y?netilmesi a??s?ndan da ?nemlidir (109).
ATAKLARIN ?NLENMES?
KOAH
Sigara ile ilgili olarak yap?lan uzun s?reli bir ?al??mada sigaray? b?rakanlarda toplam ataklarda sigara i?meyi s?rd?renlere g?re klinik ve istatistiksel olarak ataklarda %22 oran?nda anlaml? azalma saptanm??, onuncu y?l? takiben %35 oran?nda azalma ile etkin hale geldi?i g?r?lm??t?r (110).
KOAH ataklar?n?n en ?nemli nedeni trakeabron?iyal a?ac?n infeksiyonlar?d?r. ?ki bu?uk y?ll?k takip s?recinde influenza a??s?n?n acil ba?vurular?, hastane yat??lar?n? ve mortaliteyi azaltt??? g?sterilmi?tir (111,112).
?nfluenza vir?s? yan?nda pn?mokoklar da KOAH ataklar?nda rol almaktad?r. Food and Drug Administration (FDA), Europan Medicines Agency (EMA), Centers for Disease Control and Prevention (CDC) 2010 y?l?ndan beri invaziv pn?mokok hastal???n? (IPD) ?nledi?i i?in ya?l?lara ve risk gruplar?na (KOAH, ast?m, sigara i?meyi s?rd?renler) pn?mokok a??s?n? ?nermektedir (113).
Rehabilitasyon hastanede kal?? s?resini k?saltmakta, atak s?kl???n? etkilememekte ancak ?iddetini azaltmaktad?r. D?zenli fiziksel aktivite atak nedeniyle hastanede yat?? s?resini k?saltt??? g?sterilmi?tir (114,115).
RCT ile uzun s?reli oksijen tedavisinin ataklar? azaltt???n? g?stermek kontrol grubunun olu?turulmas?n?n etik olarak sorun olmas? nedeniyle m?mk?n olmamaktad?r. Evde noninvaziv mekanik ventilasyon (NIMV) kullan?m?n?n toplam ataklar? azaltt??? g?sterilememi?tir, ancak hastane yat??lar?n? azaltmaktad?r (116).
Heterojen amfizemi olan KOAH olgular?nda vol?m azalt?c? cerrahi ataklar? azaltmaktad?r (117,118).
G?n?m?z GOLD strateji raporunda ?nerilen tedaviler ile ilgili tan?mlanan gruplarda hen?z yay?nlanm?? tedavi, ?zellikle atak ?al??mas? olmad??? gibi fonksiyonel olarak evrelendirilmi? ve FEV1 ≥ %50 beklenen hafif-orta KOAH olgular?nda ?nerilen ila?larla yap?lm?? ataklarla ilgili ?al??ma da yoktur.
Uzun etkili antikolinerjik ile bir y?ll?k ve d?rt y?ll?k ?al??malarda s?ras? ile ataklar?n %35 ve %14 azalt?ld??? g?sterilmi?tir (119,120). Son olarak 2013 y?l?nda ABD yap?lm?? olan bir "post hoc pooled" analizde tiotropiumun toplam KOAH ataklar?nda %27 ve hastaneye yatmay? gerektiren ataklarda %44 azalma yapt??? belirtilmi?tir (121). Uzun etkili beta-2 agonistlerin KOAH ataklar? ?zerine etkisinin analiz edildi?i meta-analizde salmeterol?n tek ba??na ataklar? %20, salmeterol, formoterol ve 24 saat etkili LABA olan indakaterol'?n ICS'lerle birlikte kullan?ld?klar?nda toplam atak say?s?n? s?ras?yla %21, %24 ve %18 azaltt??? g?sterilmi?tir (122).
LABA + LAMA tedavisinin tek ba??na LAMA tedavisine toplam ve hastaneye yatmay? gerektiren ataklar y?n?nden ?st?nl??? g?sterilememi?tir (123).
?? y?ll?k ve 6000?den fazla hastan?n de?erlendirildi?i ?al??mada ICS/LABA fiks kombinasyonunun toplam ataklar? %25 azaltt???, yirmi d?rt saat etkili flutikazone furuat (100 mcg/g?n)/vilanterol (25 mcg/g?n) fiks kombinasyonunun toplam ataklar? %24 azaltt??? g?sterilmi?tir (124,125).
FEV1 < %50 olan KOAH olgular?nda ICS/LABA fiks kombinasyonu ya da LAMA ?nerisini kar??la?t?ran tek bir ?al??ma s?z konusudur. ICS/LABA grubunda mortalite (p= 0.032) ve kardiovask?ler mortalite (s?ras?yla %1?e %3) d???kt?r (126).
LAMA ile ICS/LABA + LAMA'n?n kar??la?t?r?lmas?nda toplam ataklar?n benzer ?ekilde azald??? ancak hastaneye yatmay? gerektiren ciddi ataklar?n ??l? tedavide klinik (%47) ve istatistiksel (p< 0.05) olarak anlaml? azald??? g?sterilmi?tir (123).
LABA kullanan ve kullanmayan, s?k atak ge?iren ve ge?irmeyen KOAH olgular?nda PDE4 inhibit?r? (roflumilast) toplam atak say?s?nda istatistiksel olarak anlaml?, LABA ile birlikte kullan?ld???nda ve s?k atak ge?iren olgularda istatistiksel ve klinik olarak anlaml? azalma meydana getirmi?tir. Bateman'?n ?al??mas?nda ciddi ataklarda y?ll?k %21.6'l?k klinik ve istatistiksel (p= 0.0439) olarak anlaml? azalma g?sterilmi?tir (126-130).
Mukolitikler i?inde en ?ok ara?t?r?lan N-asetil sistein (NAC)'dir. Yirmi alt? ?al??man?n de?erlendirildi?i 2006 y?l?na ait bir Cochrane analizinde mukolitik ila?lar?n ataklar? %20 oran?nda azaltt??? do?rulanm??t?r (131). 2012 ?spanyol rehberi KOAH olgular?n? fenotiplere g?re s?n?flad? ve s?k atak ge?iren kronik bron?itin belirgin oldu?u fonksiyonel olarak GOLD Evre IV yer alan olgulara karbosisteinin eklenmesinin d???n?lebilece?ine de?inmektedir (132).
Tart??mal? bir di?er konu da profilaktik olarak uzun s?reli antibiyotik kullan?m?n?n ataklar?n azalmas?ndaki yeridir. Azitromisin ile yap?lan ?al??mada 250 mg/g?n azitromisin, 12 ayl?k tedavi ile orta/ciddi ataklarda %17 azalma ve atak ge?irmeyen hasta oran?n?n %27 oran?nda azitromisin lehine geli?ti?i g?sterilmi?tir (133). Makrolidlerle ilgili bir meta-analizde makrolitlerin 6 ve 12 ayl?k uygulamalar? analiz edilmi? ve %17 oran?nda ataklar? azaltt???na g?sterilmi?tir (134). Mart 2013 y?l?nda FDA azitromisinin kalbin elektrik aktivitesini bozdu?unu ve ?l?mc?l ritm kusurlar?na sebep olabilece?ini belirten bir g?venlik duyurusu yay?nlad? (135). Bir solunum kinolonu olan moksifloksasinin 400 mg/g?n, be? g?n, sekiz haftada bir, bir y?lda alt? kez uygulamas?n?n da KOAH ataklar?nda %25 azalma yapt???, ?zellikle p?r?len-mukop?r?lan balgam? olan hastalarda %45 atak azalmas?na sebep oldu?u do?rulanm??t?r (136).
Ast?m
Ast?m ataklar?n? olu?turan nedenlerden sak?n?lmas? ataklar?n da ?nlenmesini sa?lar. Bu ba?lamda ?? grup alt?nda ?nlemler toplanabilir:
Tetikleyen nedenlerden korunma: Daha ?nce belirtilen atak nedenlerinden korunmada viral infeksiyonlar?n en ?nemli etken oldu?u belirtilmi?ti. Ancak en s?k g?r?len rinovir?slerin ?e?itlili?i nedeni ile a??s?n?n olmamas? a??n?n sadece influenza i?in yap?lmas?n? m?mk?n k?lmaktad?r. A??n?n uygulanmas? ile ataklardan korunma aras?nda ise ?al??ma sonu?lar? halen ?eli?kili g?r?nmekle birlikte rehberler influenza a??s?n?n yap?lmas?n? ?nermektedir (5,17).
Makrolid grubu antibiyotiklerin kullan?m?n?n imm?nomod?lat?r etkileri nedeni ile rinovir?s ve di?er baz? vir?s infeksiyonlar?n? azallt???n? g?steren ?al??malar mevcuttur. Tetikleyen allerjen, mesleki ajanlar, ?evre kirlili?inden sak?nma, komorbit hastal?klar?n tedavisi ile atak oranlar?nda azalmalar sa?lanabilmektedir. Ancak bu durum hastan?n fenotipine g?re de?i?ik sonu?lar yarat???ndan herhangi bir oran verilmesi uygun bulunmamaktad?r.
Etkin tedaviler verilmesi: ?nhaler steroidler ve kombine tedaviler ataklar?n ?nlenmesinde en etkin tedavi ajanlar?d?r. 2011 Cochrane de?erlendirmesinde salmeterol-flutikazon kombinasyonu ile formoterol-budesonid kombinasyonunun oral steroid gerektiren ataklara, atak nedenli hospitalizasyona benzer etkili olduklar? belirtilmi?tir (137). 2014 y?l?nda yap?lan Cochrane de?erlendirmesinde de kombinasyon tedavilerinin g?venli oldu?u bildirilmektedir (138). 2013 Cochrane de?erlendirmesine budesonid formoterol fiks doz tek inhaler kullan?m?n?n, di?er separe veya fiks doz kombinasyonlara g?re oral steroid gerektiren ataklar ve atak nedenli hospitalizasyon oranlar?nda daha iyi bir azalma sa?lad??? g?zlenmi?tir (139). ?nhaler kortikosteroide uzun etkili beta agonist eklenmesi ile montelukast eklenmesi konusunda 2014 y?l?nda yay?nlanan Cochrane de?erlendirmesinde beta agonist eklenmesinin sistemik steroidli atak riskini daha iyi azaltt??? g?sterilmi?tir (140). Stabil hale gelen olgularda inhaler steroid dozunu %50 azaltman?n ?? ay i?inde atak riskini art?rmad??? yine 2014 y?l?nda yap?lan bir meta-analiz ile verilmi?tir (141). Omalizumab eklenmesinin eri?kinde 2014 sistematik de?erlendirmesinde de ataklar? azaltt??? belirtilmi? ancak ?ocukta ve halen sistemik steroid kullanan hastalarda daha fazla ?al??ma olmas?n?n daha iyi olaca?? belirtilmi?tir (142). Hastan?n fenotipine uygun yeni monokonal antikorlarla da ataklar?n ?nlenmesinde etkin benzeri sonu?lar yay?nlanmaya ba?lanm??t?r.
Hasta e?itimi ve hasta ile i?birli?i: Etkin bir tedavi verilerek hastaya d?zg?n tedavisinin kullan?m?n?n gere?i, inhaler tekni?i ??retilmeli ve eline yaz?l? eylem plan? verilerek yak?nmalar? ba?lay?nca yapmas? gerekenler yaz?larak aktar?lmal?d?r. ?al??malar yaz?l? eylem plan? verilmesinin %40 oran?nda hospitalizasyonu azalt???n? ve %20 oran?nda da acil ba?vurular? azalt???n? g?stermektedir.
ALEVLENMELER?N FARMAKOLOJ?K TEDAV?S?
KOAH
KOAH ve ast?m atak tedavisinin temeli yo?un bir bronkodilat?r tedavidir. Buna paralel olarak, atakta yang?ya y?nelik steroid tedavileri de hastan?n durumuna g?re devreye sokulur. Ayr?ca ata?a neden olan soruna (infeksiyon, hava kirlili?i, emboli vb.) ?zg?l tedavi uygulanmal?d?r.
KOAH ataklar?nda bronkodilat?r tedavi: Atakta hastan?n solunum s?k?nt?s?n?n h?zl? ve g?venli bir ?ekilde rahatlat?lmas? hedeflenir. Bu ama?la, yak?n izlemle, doz aral??? ve dozu daha kolayl?kla modifiye edilebilen k?sa etkili bronkodilat?rler kullan?l?r. Bilindi?i gibi, elimizdeki k?sa etkili bronkodilat?rler beta 2-agonistler ve ipratropiumdur. ?lac?n inhalasyonundan sonra 90. dakikada yap?lan solunum fonksiyon testleri dikkate al?nd???nda, bu iki grup bronkodilat?r?n etkinlikleri aras?nda fark yoktur. Ayr?ca, "optimal" doz (?nerilen standart doz de?il, optimal doz, teorik olarak, bir hastada maksimum bronkodilatasyonu sa?layan en d???k dozdur) beta 2-agonist uygulanan hastalarda, tedaviye ipratropium eklemesi de FEV1 d?zeyinde ek bir d?zelme sa?lamamaktad?r (143-148). Artan dozlarda salbutamol kullan?larak bir doz-yan?t e?risi olu?turulan bir ?al??mada, KOAH ataklar?nda ortalama optimal salbutamol dozunun 800 mcg d?zeyinde oldu?u g?sterilmi?tir (149). Uluslararas? rehberlerde iki bronkodilat?r grubu aras?nda bir ?ncelik belirtilmemekte, gerekti?inde kombine edilmeleri ?nerilmektedir (1,150). A??r olmayan (hastaneye yat?? gerektirmeyen) ataklarda uzun etkili bronkodilat?rler de ? s?kl?kla kombine olarak ? kullan?l?rlar. Beklendi?i ?zere, uzun etkili beta 2-agonistlerle tiotropiumun kombinasyonu, monoterapiye g?re FEV1, inspiratuvar kapasite ve oksijen sat?rasyonu d?zeylerinde daha belirgin d?zelmeler sa?lamaktad?r (151).
Bronkodilatat?r tedavi, tercihen bir spacer arac?l???yla, ?l??l? doz inhalerlerle (?D?) ya da neb?lizat?rle uygulanabilir. Genellikle, ?D?'yi do?ru teknikle kullanabilen ya da spacer'? olan hastalarda, hastan?n ihtiyac? olan dozlar uyguland??? s?rece, neb?lizat?r kullan?m? gerekli de?ildir.
Ataklarda metilksantinler, inhale bronkodilat?r uygulanan hastalarda ek yarar sa?lamamaktad?r; buna kar??l?k, s?kl?kla bulant?-kusma, ?arp?nt? ve aritmiye neden olmaktad?r (152).
Antibiyotik tedavisi: ?ok say?da plasebo kontroll? ?al??ma, ataklarda antibiyotik kullan?m?n?n yarar?n? g?stermi?tir (153,154). Antibiyotik kullan?m? mortalite ve tedavi ba?ar?s?zl??? riskini azaltmaktad?r (155). Ancak, ataklar?n yakla??k yar?s?n?n bakteriyel infeksiyonlara ba?l? oldu?u bilinmektedir. Antibiyotik kullan?lmas? gereken hastalar?n se?iminde Anthonisen kurallar?n?n kullan?lmas? gerekmektedir. Buna g?re, ?? temel semptomun (dispne art???, balgam miktar?n?n art??? ve balgam?n p?r?lan olmas?) ??? de bulunan ya da p?r?lan balgam?n yan? s?ra bir semptomu daha olan hastalarda bakteriyel bir infeksiyon olas?l??? y?ksektir ve antibiyotik kullanma endikasyonu vard?r.
En s?k g?r?len etkenler, H. influenzae, S. pneumoniae ve M. catarrhalis'tir ve ayaktan tedavi edilen hastalarda ?ncelikle beta-laktam + beta-laktamaz inhibit?r? ya da 2. ku?ak sefalosporinler ?nerilmektedir. Makrolidler de ulusal ve uluslararas? rehberlerde se?enek olarak ?nerilmekle birlikte, son d?nemde yap?lan ?al??malarda, KOAH ataklar?nda atipik bakterilerin anlaml? bir rol? olmad??? g?sterilmi?tir (156, 157). Ayr?ca, ataklarda makrolid kullan?m?n?n kardiyovask?ler olay ve akut koroner sendrom riskinde ve kardiyovask?ler mortalitede art??a yol a?t??? bildirilmi?tir (158).
A??r ve ?ok a??r KOAH'? olan, kardiyovask?ler komorbiditesi olan ya da son y?l i?inde en az ?? atak ge?iren hastalarda, enterik gram-negatif bakterilerin etken olma riski y?ksektir. Bu nedenle, bu risk fakt?rleri olan hastalarda ?ncelikle beta-laktam + beta-laktamaz kombinasyonu ve 2. ya da 3. ku?ak sefalosporinler, son ?? ay i?inde beta-laktam kullanm?? olan hastalarda solunum kinolonlar? ?nerilmektedir.
KOAH ataklar?ndan P. aeruginosa infeksiyonu da sorumlu olabilir. Pseudomonas infeksiyonu i?in risk fakt?rleri, son bir ay i?inde hastaneye yat?? ?yk?s?, son y?lda en az d?rt kez ya da son bir ay i?inde antibiyotik kullan?m ?yk?s?, a??r solunum yetmezli?i varl??? ve ?nceki atakta ya da stabil d?nemde balgamda P. aeruginosa saptanmas?d?r. Bu risk fakt?rlerinin bulundu?u hastalarda ampirik olarak oral siprofloksasin ya da parenteral bir anti-Pseudomonas antibiyotik ba?lanmal?d?r. Enterik gram-negatif bakteriler ya da Pseudomonas infeksiyonu riski olan ve yukar?da belirtilen geni? spektrumlu antibiyotiklerin ba?land??? hastalarda, her olanak oldu?unda balgam k?lt?r? yap?lmal? ve sonucuna g?re antibiyotik tedavisi mutlaka g?zden ge?irilmelidir.
Kortikosteroid tedavisi: Sistemik steroidlerin ataklarda tedavi ba?ar?s?n? art?rd???, iyile?meyi h?zland?rd??? ve n?ks geli?me s?resini uzatt??? ?ok say?da plasebo kontroll? ?al??ma ile g?sterilmi?tir (159). Optimal tedavi s?resinin 5-10 g?n oldu?u d???n?lmektedir (160,161). Genel olarak, 30-40 mg/g?n metil prednizolonun yeterli oldu?u ve parenteral ve oral tedavilerin etkinli?inin benzer oldu?u bilinmektedir (162,163). Ancak, a??r solunum yetmezli?i olan hastalarda, hastan?n durumu stabilize olana dek parenteral uygulamak daha g?venlidir. Steroid kullan?m?na ba?l? yan etkiler doz ve s?reyle ili?kilidir. Yan etki riskinin y?ksek oldu?u hastalarda (kontrol alt?nda olmayan diyabet ya da hipertansiyon vb.) neb?lizat?r ile inhale steroid kullan?m?n?n benzer etkinlik sa?lad??? bildirilmi?tir (164,165).
Mukolitiklerin ataklarda, di?er tedavilere ek bir yarar sa?lamad??? bilinmektedir (166,167). Ataklarda ekinasea kullan?m?n? inceleyen kontroll? bir ?al??ma, bir yarar sa?lamad???n? g?stermi?tir (168).
Ataklarda selektif beta-bloker kullan?m?n?n g?venli oldu?u, mortalitede, bir ay i?inde yeniden hospitalizasyonda, mekanik ventilasyon gere?inde bir art??a yol a?mad??? g?sterilmi?tir. Buna kar??l?k, non-selektif beta-bloker kullan?m?, 30 g?n i?inde daha y?ksek oranda hospitalizasyon ile ili?kili bulunmu?tur (169).
Ast?m
Hafif-orta ast?m ata?? hastas? tedavi alt?nda k?t?le?iyorsa mutlaka a??r atak gibi de?erlendirilmeli ve yo?un bak?ma al?nmal?d?r. Hastalarda saat ba?? solunum fonksiyon ?l??m? ile takip ?nerilmektedir.
Oksijen: SaO2 > %90-93 (gebelerde ve kalp hastalar?nda %95) tutacak ?ekilde, oksimetri ?l??m? ile kontroll?, nazal kan?l veya maske ile (1-3 L/dakika) verilmelidir.
Ast?m ata??nda bronkodilat?r tedavi: H?zl? k?sa etkili beta 2-agonistler (SABA), 20-30 dakika ara ile d?zenli doz tekrar? ile 4-8 puf (24-36 puf/saat) verilir. Neb?lizat?r ile s?rekli verilebilir. Spacer ile verilen 400 mcg salbutamol, neb?lizat?r ile verilen 2.5 mg salbutamole e?de?erdir. S?rekli ya da intermitan beta agonist kullan?m? aras?nda anlaml? fark yoktur. A??r atakta acilde kontin? kullan?m solunum fonksiyonlar?n? d?zeltip hastane yat??lar?n? azalt?r, g?venlidir ve iyi tolere edilir. GINA ba?lang??ta s?rekli sonra ihtiyaca g?re intermitan kullan?m? ?nermektedir.
H?zl? etkili beta 2-agonist formoterol ile yap?lan 9 RCT 576 hasta i?eren meta-analizde formoterol ve SABA aras?nda serum K d?zeyi, kalp h?z? QT aral???, hastaneye yat?? a??s?ndan klinik anlaml? fark yoktur. Y?ksek doz formoterol iyi tolere edilebilir, y?ksek doz SABA ya e?de?er h?zl? ve etkin bronkodilatasyon sa?lar, ancak pahal?d?r.
SABA refrakter olgularda ast?m ata?? esnas?nda ICS/formoterol fiks kombinasyonu ile akut rahatlama sa?lan?r.
IV beta agonistler ile yap?lan 584 olguluk 15 ?al??man?n sonucunda ast?m ata??nda kullan?m? ile ilgili kan?t bulunamam??t?r. Yararl? oldu?u g?sterilen herhangi bir subgrupta saptanmam??t?r. Ayr?ca IV beta agonistlerin akut angina ya da son alt? ayda MI ge?irenlerde kullan?m? kontrendikedir.
Tedaviye k?sa etkili antikolinerjik (SAMA) ipratropium eklenmesi, bronkodilat?r yan?t? art?r?r. SABA + SAMA kombinasyonunda, tek ba?lar?na kullan?mlar?na g?re PEF ve FEV1 artar ve hastaneye yat??lar azal?r. 20 dakikada bir 500 mg neb?l ya da 4-8 puf kullan?l?r. Metilksantinlerden ?nce denenmelidir. ?nemli bir endikasyonu da beta blokerler ile olu?an ataklard?r. ?zellikle PEF < %40 olanlarda yarar g?r?lm??t?r.
IV aminofilin, SABA'lardan daha az etkili olmas? ve yan etki potansiyelinin y?ksekli?i nedeniyle akut atakta ?ok az yeri vard?r. Eri?kinlerde, ciddi ast?m ataklar?nda verilmesinin ek bir yarar? g?sterilememi?tir. "Near fatal" ast?ml?lar, inhaler ve intraven?z beta 2-agonistlere, inhaler ipratropium brom?r, IV steroid ve IV magnezyuma yan?t vermeyen hastalarla s?n?rl?d?r. IV teofilin, 6 mg/kg 30 dakikadan uzun s?rede inf?zyonla verildikten sonra 0.5-0.9 mg/kg/saat idame dozu ile inf?zyona devam edilir. Halen oral teofilin almakta olanlara y?kleme dozu verilmemelidir. ?la? etkile?imlerine dikkat edilmelidir.
Sistemik steroidler, etki mekanizmas?ndan kaynaklanan zaman kayb? nedeniyle olabildi?ince erken verilmelidir. Atakta hemen steroid ba?lanmas? gereken hastalar, ba?lang??ta verilen inhaler beta 2-agoniste yan?ts?z olan, halen sistemik steroid al?rken atak ortaya ??km?? ve ?nceki ataklar?nda sistemik steroid gerekmi? olanlard?r. Oral yol IV yola e?de?erdir. 60-80 mg/g?n prednizolon s?kl?kla ?nerilen dozdur, 40 mg/g?n prednizolon pek ?ok olguda yeterli bulunmu?tur. A??r olgularda doz art??? gerekebilir (120-180 mg/g?n).
Ataklarda y?ksek doz inhaler (neb?l) steroidler de kullan?labilir, ancak maliyet etkinlik a??s?ndan ilk se?enek olarak ?nerilmemektedir. Non-genomik etki mekanizmas?ndan faydalan?lmaktad?r. Bu non-genomik etkiler doza ba?l?d?r y?ksek doz kullan?lmal? (idame dozun en az be? kat?) ve dozlar aras?nda 30 dakikadan fazla ara verilmemelidir. IKS y?ksek dozda ve multiple uygulan?mda ataklar? kontrol alt?na almakta, hastane ba?vurular?n? azaltmakta sistemik steroide e?it veya daha iyi bir oranda etkili bulunmu?tur.
L?kotrien resept?r antagonistleri (LTRA): 1470 eri?kin, 470 ?ocu?u kapsayan sekiz ?al??man?n de?erlendirilmesinde rutin kullan?mda atakta yeri olmad???na karar verilmi?tir.
IV magnezyum s?lfat (Mg), rutin ?nerilmez. Hasta-neye ba?vurdu?unda FEV1'i beklenenin %25-30'u olan, ba?lang?? tedavisine yan?t vermeyen, bir saatlik tedavi sonras? FEV1 de?eri beklenenin %60'?n?n ?zerine ??kmayan baz? hastalarda hastaneye yat?? oranlar?n? azaltt??? g?sterilmi?tir. IV Mg atak tedavisinde IV teofilin ve IV beta 2-agonistten daha etkili bulunmu?tur. 2 g Mg 50 mL %0.9'luk salin sol?syonu i?inde, 30 dakikadan uzun s?rede inf?zyon ?eklinde kullan?lmaktad?r (1g/1-10 dakika). Salbutamola ba?l? olu?an ta?ikardide atriyumda stabilizan etki art?s? olabilir. Flushing, hafif sedasyon, solunum depresyonu, hipotansiyon yan etkileri g?r?lebilir, b?brek yetmezli?inde dikkat edilmelidir.
Helioks, 70/30 ya da 60/40 oranlar?nda helyum ve oksijen kar???m?d?r. Rutin olarak kullan?m?n? destekleyecek yeterli veri olmad???, ancak standart tedaviye yan?ts?z ast?m ataklar?nda denenebilece?i g?sterilmi?tir.
Adrenalin kullan?m?n?n, ast?m ata??nda yeri yoktur. Anafilaksi ve anjiyo?dem durumunda kullan?m? d???n?lmelidir. SC 0.2-0.5 mL (1:1000 sol.) 20-30 dakikada 3 doz, IV 2-10 mL (1:10,000 sol.), be? dakikada, gerekirse tekrarlan?r, fayda varsa 1-20 mg/g?n devam edilir.
Mukus t?kac? fatal/near fatal ast?mda neb?lize rhDNase ile bronkoalveoler lavaj ?ok ?nemlidir. Konvan-siyonel tedaviye yan?t vermeyen ent?be bir status astmatikus olgusunda BAL'? takiben rhDNase kullan?m? ile dramatik yan?t elde olunmu?tur.
Ekstrakorporeal membran oksijenasyon (ECMO), status astmatikusa ba?l? solunum yetmezli?i olan 24 eri?kinde sonu?lar ba?ar?l?, %83.4, olgu baz?nda ?ocuklarda da se?ilmi? olgularda ba?ar?l?d?r.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Global Initiative for Chronic Obstructive Lung Disease. The Global Strategy for Diagnosis, management and Prevention of COPD (updated 2014, www.goldcopd.org).
- Caramori G, Contoli M, Marku B, Casolari P, Pauletti A, Forini G, et al. Definition and aetiology of infective exacerbations of COPD. Eur Respir Monogr 2013;60:58-67.
- Reddel HK, Taylor DR, Bateman ED Boulet LP, Boushey HA, Busse WW. An official American Thoracic Society/European Respiratory Society statement: asthma control and exacerbations: standardizing endpoints for clinical asthma trials and clinical practice. Am J Respir Crit Care Med 2009:1;180:59-99. doi: 10.1164/rccm.200801-060ST.
- Montania D, Cavailles A, Bertoletti L, Botelhod A, Cortot A, Taill? C, et al. Adult asthma exacerbations in questions. Rev Mal Respir 2010:27:1175-94. doi: 10.1016/j.rmr.2010.10.005.
- Global Strategy for Asthma Management and Prevention. Available at: http://www.ginasthma.org/local/uploads/files/GINA_Report_2014_Jun11.pdf, (Last accessed on july 2014).
- Hurst JR, Donaldson GC, Perera WR, Wilkinson TM, Bilello JA, Hagan GW, et al. Use of plasma biomarkers at exacerbation of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2006;174:867-74.
- Dahl M, Vestbo J, Lange P, Bojesen SE, Tybjaerg-Hansen A, Nordestgaard BG. C-reactive protein as a predictor of prognosis in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2007;175:250-5.
- Schuetz P, M?ller B, Christ-Crain M, Stolz D, Tamm M, Bouadma L, et al. Procalcitonin to initiate or discontinue antibiotics in acute respiratory tract infections. Cochrane Database Syst Rev 2012;9:CD007498. doi: 10.1002/14651858.CD007498.pub2.
- Thomsen M, Ingebrigtsen TS, Marott JL, Dahl M, Lange P, Vestbo J, et al. Inflammatory biomarkers and exacerbations in chronic obstructive pulmonary disease. JAMA 2013;309:2353-61.
- Polatli M, Cakir A, Cildag O, Bolaman AZ, Yenisey C, Yenicerioglu Y. Microalbuminuria, von Willebrand factor and fibrinogen levels as markers of the severity in COPD exacerbation. J Thromb Thrombolysis 2008;26:97-102.
- Casanova C, Celli BR. Microalbuminuria as a potential novel cardiovascular biomarker in patients with COPD. Eur Respir J 2014;43:951-53. doi: 10.1183/09031936.00015614.
- Romundstad S, Naustdal T, Romundstad PR, Sorger H, Langhammer A. COPD and microalbuminuria: a 12-year follow-up study. Eur Respir J 2014;43:1042-50.
- Agusti A, Sin DD. Biomarkers in COPD. Clin Chest Med? 2014;35:131-141. doi: 10.1016/j.ccm.2013.09.006.
- Hurst JR. Exacerbation phenotyping in chronic obstructive pulmonary disease. Am J Respir Crit Care Med? 2011;184:625-26. doi: 10.1164/rccm.201106-1136ED.
- Suissa S, Dell'Aniello S, Ernst P. Long-term natural history of chronic obstructive pulmonary disease: severe exacerbations and mortality. Thorax 2012;67:957-63. doi: 10.1136/thoraxjnl-2011-201518.
- Bafadhel M, McKenna S, Terry S, Mistry V, Reid C, Haldar P, et al. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am J Respir Crit Care Med? 2011;184:662-71. doi: 10.1164/rccm.201104-0597OC.
- T?rk Toraks Derne?i Ast?m Tan? ve Tedavi Rehberi, Turkish Thoracic J 2014;(suppl 1) Available at Global Initiative for Chronic Obstructive Lung Disease. The Global Strategy for Diagnosis, management and Prevention of COPD (updated 2014, www.goldcopd.org): http://www.toraks.org.tr/uploadFiles/book/file/242014113315-kapak.pdf, (Last accessed on july 2014)
- BTS/SIGN British Guideline on the management of asthma. Available at: https://www.brit-thoracic.org.uk/document-library/clinical-information/asthma/btssign-guideline-on-the-management-of-asthma/ (Last accessed on july 2014).
- Expert Panel Report 3 (EPR3): Guidelines for the Diagnosis and Management of Asthma. Available at: http://www.nhlbi.nih.gov/ guidelines/asthma/asthgdln.htm. (Last accessed on july 2014).
- Anthonisen NR, Manfreda J, Warren CP, Hershfield ES, Harding GK, Nelson NA. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease. Ann Intern Med 1987;106:196-204.
- Siddiqi A, Sethi S. Optimizing antibiotic selection in treating COPD exacerbations. Int J Chron Obstruct Pulmon Dis 2008;3:31-44.
- Wedzicha JA, Mackay AJ, Singh R. COPD exacerbations: impact and prevention. Breathe 2013;9:434-40.
- Plaza V, Serrano J, Picado C, Sanchis J; High Risk Asthma Research Group. Frequency and clinical characteristics of rapid-onset fatal and near-fatal asthma. Eur Respir J 2002;19:846-52.
- Tattersfield AE, Postma DS, Barnes PJ, Svensson K, Bauer CA, O'Byrne PM. Exacerbations of asthma: a descriptive study of 425 severe exacerbations. The FACET International Study Group. Am J Respir Crit Care Med 1999;160:594-9.
- Nievas IF, Anand KJ. Severe acute asthma exacerbation in children: a stepwise approach for escalating therapy in a pediatric intensive care unit. J Pediatr Pharmacol Ther 2013;18:88-104. doi: 10.5863/1551-6776-18.2.88.
- Picado C. Classification of severe asthma exacerbations: a proposal. Eur Respir J 1996;9:1775-8.
- Wasserfallen JB1, Schaller MD, Feihl F, Perret CH. Sudden asphyxic asthma: a distinct entity? Am Rev Respir Dis 1990;142:108-111.
- Ayres JG, Miles JF, Barnes PJ. Brittle asthma. Thorax 1998;53:315-21.
- Alvarez GG1, Schulzer M, Jung D, Fitzgerald JM. A systematic review of risk factors associated with near-fatal and fatal asthma. Can Respir J 2005;12:265-270.
- Robin ED, Lewiston N. Unexpected, unexplained sudden death in young asthmatic subjects. Chest 1989;96:790-3.
- Hurst JR, Vestbo J, Anzueto A, Locantore N, M?llerova H, Tal-Singer R, et al. Susceptibility to exacerbation in chronic obstructive pulmonary disease. N Engl J Med? 2010;363:1128-38. doi: 10.1056/NEJMoa0909883.
- Han MK, Kazerooni EA, Lynch DA, Liu LX, Murray S, Curtis JL, et al. Chronic obstructive pulmonary disease exacerbations in the COPDGene study: associated radiologic phenotypes. Radiolog 2011;261:274-82. doi: 10.1148/radiol.11110173.
- Wedzicha JA, Singh R, Mackay AJ. Acute COPD exacerbations. Clin Chest Med 2014;35:157-163. doi: 10.1016/j.ccm.2013.11.001.
- Mackay AJ, Donaldson GC, Patel AR, et al. Detection and severity grading of COPD exacerbations using the exacerbations of chronic pulmonary disease tool (EXACT). Eur Respir J 2014;43:735-744.
- Mackay AJ, Donaldson GC, Patel AR, Jones PW, Hurst JR, Wedzicha JA. Usefulness of the Chronic Obstructive Pulmonary Disease Assessment Test to evaluate severity of COPD exacerbations. Am J Respir Crit Care Med 2012;185:1218-24. doi: 10.1164/rccm.201110-1843OC.
- Steer J, Gibson J, Bourke SC. The DECAF Score: predicting hospital mortality in exacerbations of chronic obstructive pulmonary disease. Thorax 2012;67:970-6.
- Almagro P, Soriano JB, Cabrera FJ, Boixeda R, Alonso-Ortiz MB, Barreiro B, et al. Short-and medium - term prognosis in patinets hospitalized for COPD exacerbation. The CODEX index. Chest 2014;145:972-80.
- Sato R, Tomita K, Sano H, Ichihashi H, Yamagata S, Sano A, et al. The strategy for predicting future exacerbation of asthma using a combination of the Asthma Control Test and lung function test. J Asthma 2009;46:677-82. doi: 10.1080/02770900902972160.
- Chapman KR, Boulet LP, Rea RM, Franssen E. Suboptimal asthma control: prevalence, detection and consequences in general practice. Eur Respir J 2008;31:320-5.
- Demoly P, Gueron B, Annunziata K,et al. Update on asthma control in five European countries: results of a 2008 survey. Eur Respir Rev 2010;19:150-7. doi: 10.1183/09059180.00002110.
- Bateman ED, Reddel HK, Eriksson G, Peterson S, Ostlund O, Sears MR, et al. Overall asthma control: the relationship between current control and future risk. J Allergy Clin Immunol 2010;125:600-8. doi: 10.1016/j.jaci.2009.11.033.
- Wei HH, Zhou T, Wang L, Zhang HP, Fu JJ, Wang L, et al. Current asthma control predicts future risk of asthma exacerbation: a 12-month prospective cohort study Chin Med J 2012;125:2986-93.
- Ko FW, Hui DS, Leung TF, Chu HY, Wong GW, Tung AH, et al. Evaluation of the asthma control test: A reliable determinant of disease stability and a predictor of future exacerbations. Respirology 2012;17:370-8. doi: 10.1111/j.1440-1843.2011.02105.x.
- Honkoop PJ, Taylor DR, Smith AD, Snoeck-Stroband JB, Sont JK. Early detection of asthma exacerbations by using action points in self-management plans. Eur Respir J 2013;41:53-9. doi: 10.1183/09031936.00205911.
- Stanford RH, Shah MB, D'Souza AO, Dhamane AD, Schatz M. Short-acting b-agonist use and its ability to predict future asthma-related outcomes. Ann Allergy Asthma Immunol 2012;109:403-7. doi: 10.1016/j.anai.2012.08.014.
- Buhl R, Kuna P, Peters MJ, Andersson TL, Naya IP, Peterson S, et al. The effect of budesonide/formoterol maintenance and reliever therapy on the risk of severe asthma exacerbations following episodes of high reliever use: an exploratory analysis of two randomised, controlled studies with comparisons to standard therapy. Respir Res 2012;13:59. doi: 10.1186/1465-9921-13-59.
- Laforest L, Licaj I, Devouassoux G, Chatte G, Martin J, Van Ganse E. Asthma drug ratios and exacerbations: claims data from universal health coverage systems. Eur Respir J 2014;43:1378-86. doi: 10.1183/09031936.00100113.
- Bjermer L, Alving K, Diamant Z, Magnussen H, Pavord I, Piacentini G, et al. Current evidence and future research needs for FeNO measurement in respiratory diseases. Respir Med 2014;108:830-41. doi:10.1016/j.rmed.2014.02.005.
- Zeiger RS, Schatz M, Zhang F, Crawford WW, Kaplan MS, Roth RM, et al. Elevated exhaled nitric oxide is a clinical indicator of future uncontrolled asthma in asthmatic patients on inhaled corticosteroids. J Allergy Clin Immunol 2011;128:412-4. doi: 10.1016/j.jaci.2011.06.008.
- Gelb AF, Flynn Taylor C, Shinar CM, Gutierrez C, Zamel N. Role of spirometry and exhaled nitric oxide to predict exacerbations in treated asthmatics. Chest 2006;129:1492-9.
- Jatakanon A, Lim S, Barnes PJ. Changes in sputum eosinophils predict loss of asthma control. Am J Respir Crit Care Med 2000;161:64-72.
- Deykin A, Lazarus SC, Fahy JV, Wechsler ME, Boushey HA, Chinchilli VM, et al. Sputum eosinophil counts predict asthma control after discontinuation of inhaled corticosteroids. J Allergy Clin Immunol 2005;115:720-7.
- Forno E, Celed?n JC. Predicting asthma exacerbations in children. Curr Opin Pulm Med 2012;18:63-9. doi: 10.1097/MCP.0b013e32834db288.
- Zeiger RS, Yegin A, Simons FE, Haselkorn T, Rasouliyan L, Szefler SJ, et al. Evaluation of the National Heart, Lung, and Blood Institute guidelines impairment domain for classifying asthma control and predicting asthma exacerbations. Ann Allergy Asthma Immunol 2012;108:81-7. doi: 10.1016/j.anai.2011.12.001.
- Bhowmik A, Seemungal TA, Sapsford RJ, Wedzicha JA. Relation of sputum inflammatory markers to symptoms and lung function changes in COPD exacerbations. Thorax 2000;55:114-20.
- Donaldson GC, Seemungal TA, Bhowmik A, Wedzicha JA. Relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease. Thorax 2002;57:847-52.
- Ramon MA, Gimeno-Santos E, Ferrer J Balcells E, Rodr?guez E, de Batlle J, et al. Hospital admissions and exercise capacity decline in patinents with COPD. Eur Respir J 2014;43:1018-27. doi: 10.1183/09031936. 00088313.
- Piquet J, Chavaillon JM, David P, Martin F, Blanchon F, Roche N, et al. High risk patients following hospitalisation for an acute exacerbation of COPD. Eur Respir J 2013;42:946-55. doi: 10.1183/09031936.00180312.
- Soler-Cataluna JJ, Martinez-Garcia MA, Sanchez PR, Salcedo E, Navarro M, Ochando R. Severe acute exacerbations and mortality in patients with chronic obstructive pulmonary disease. Thorax 2005;60:925-31.
- Donaldson GC, Hurst JR, Smith CJ, Hubbard RB, Wedzicha JA. Increased risk of myocardial infarction and stroke following exacerbation of COPD. Chest 2010;137:1091-7. doi: 10.1378/chest.09-2029.
- McDonald VM, Gibson PG. Exacerbations of severe asthma. Clin Exp Allergy 2012;42:670-7. doi: 10.1111/j.1365-2222.2012.03981.x.
- Steppuhn H, Langen U, Scheidt-Nave C, Keil T. Major comorbid conditions in asthma and association with asthma-related hospitalizations and emergency department admissions in adults: results from the German national health telephone interview survey (GEDA) 2010. BMC Pulm Med 2013;13:46. doi: 10.1186/1471-2466-13-46.
- Menezes AM, Montes de Oca M, P?rez-Padilla R, P?rez-Padilla R, Nadeau G, Wehrmeister FC, et al. Increased risk of exacerbation and hospitalization in subjects with an overlap phenotype: COPD-asthma. Chest 2014;145:297-304.
- Miller MK, Lee JH, Miller DP, Wenzel SE; TENOR Study Group. Recent asthma exacerbations: a key predictor of future exacerbations. Respir Med 2007;101:481-9.
- Calhoun WJ, Haselkorn T, Mink DR,et al. Clinical burden and predictors of asthma exacerbations in patients on guideline-based steps 4-6 asthma therapy in the TENOR cohort. J Allergy Clin Immunol Pract 2014;2:193-200. doi: 10.1016/j.jaip.2013.11.013.
- Tough SC, Hessel PA, Ruff M, Green FH, Mitchell I, Butt JC. Features that distinguish those who die from asthma from community controls with asthma. J Asthma 1998;35:657-65.
- Kupczyk M, ten Brinke A, Sterk PJ, Bel EH, Papi A, Chanez P, et al. Frequent exacerbators a distinct phenotype of severe asthma. Clin Exp Allergy 2014;44:212-21 doi: 10.1111/cea.12179.
- Balter M, Ernst P, Watson W, et al. Asthma Worsenings Working Group. Asthma worsenings: approaches to prevention and management from the Asthma Worsenings Working Group. Can Respir J 2008;15(Suppl B):1B-19B.
- Soler N, Torres A, Ewig S, Gonzalez J, Celis R, El-Ebiary M, et al. Bronchial microbial patterns in severe exacerbations of chronic obstructive pulmonary disease (COPD) requiring mechanical ventilation. Am J Respir Crit Care Med 1998;157:1498-505.
- Sethi S, Evans N, Grant BJ, Murphy TF. New strains of bacteria and exacerbations of chronic obstructive pulmonary disease. N Engl J Med 2002;347:465-71.
- Domenech A, Puig C, Mart? S,? Santos S, Fern?ndez A, Calatayud L, et al. Infectious etiology of acute exacerbations in severe COPD patients. J Infection 2013;67:516-23.? doi: 10.1016/j.jinf.2013.09.003.
- Beasley V, Joshi PV, Singanayagam A, Molyneaux PL, Johnston SL, Mallia P. Lung microbiology and exacerbations in COPD. Int J Chron Obstruct Pulmon Dis 2012;7:555?69. doi: 10.2147/COPD.S28286.
- Patel IS, Vlahos I, Wilkinson TMA, Lloyd-Owen SJ, Donaldson GC, Wilks M, et al. Bronchiectasis, exacerbation ?ndices, and in?ammation in chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2004;170:400-7.
- Tumkaya M, Atis S, Ozge C, Delialioglu N, Polat G, Kanik A. Relationship between airway colonization, in?ammation and exacerbation frequency in COPD. Respir Med 2007;101:729-37.
- Zhang M, Li Q, Zhang XY, Ding X, Zhu D, Zhou X. Relevance of lower airway bacterial colonization, airway in?ammation, and pulmonary function in the stable stage of chronic obstructive pulmonary disease. Eur J Clin Microbiol Infect Dis 2010;29:1487-93. doi: 10.1007/s10096-010-1027-7.
- Wedzicha JA. Role of viruses in exacerbations of chronic obstructive pulmonary disease. Proc Am Thorac Soc 2004;1:115-20.
- Tan WC, Xiang X, Qiu D, Ng TP, Lam SF, Hegele RG. Epidemiology of respiratory viruses in patients hospitalized with near-fatal asthma, acute exacerbations of asthma, or chronic obstructive pulmonary disease. Am J Med 2003;115:272-7.
- Cameron RJ, de Wit D, Welsh TN, et al. Virus infection in exacerbations of chronic obstructive pulmonary disease requiring ventilation. Intensive Care Med 2006;32:1022-9.
- Seemungal T, Harper Owen R, Bhowmik A, Moric I, Sanderson G, Message S, et al. Respiratory viruses, symptoms, and inflammatory markers in acute exacerbations and stable chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001;164:1618-23.
- Molyneaux PL, Mallia P, Cox MJ, Footitt J, Willis-Owen SA, Homola D, et al. Overgrowth of the bacterial microbiome after Rhinovirus exacerbations of chronic obstructive pulmonary disease. Am J Respir Crit Care Med?2013;188:1224-31. doi: 10.1164/rccm.201302-0341OC.
- Sethi S, Murphy TF. Bacterial infection in chronic obstructive pulmonary disease in 2000: a state-of-the-art review. Clin Microbiol Rev 2001;14:336-63.
- Chan ED, Iseman MD. Underlying host risk factors for nontuberculous mycobacterial lung disease. Semin Respir Crit Care Med 2013;34:110-23.
- Huerta A, Soler N, Esperatti M, Guerrero M, Menendez R, Gimeno A, et al. Importance of Aspergillus spp. isolation in acute exaerbations of severe COPD: prevelence, factors and follow-up: the FUNGI-COPD study. Respir Res 2014;15:17. doi: 10.1186/1465-9921-15-17.
- Donaldson GC, Goldring JJ, Wedzicha JA. In?uence of season on exacerbation characteristics in patients with COPD. Chest 2012;141:94-100. doi: 10.1378/chest.11-0281
- Jenkins CR, Celli B, Anderson JA, Ferguson GT, Jones PW, Vestboe J, et al. Seasonality and determinants of moderate and severe COPD exacerbations in the TORCH study. Eur Respir J 2012;9:38-40 doi: 10.1183/09031936.00194610.
- Patel AR, Hurst JR. Extrapulmonary comorbidities in chronic obstructive pulmonary disease: state of the art. Expert Rev Respir Med 2011;5:647-62. doi: 10.1586/ers.11.62.
- Zvezdin B, Milutinov S, Kojicic M, Hadnadjev M, Hromis S, Markovic M, et al. A postmortem analysis of major causes of early death in patients hospitalized with COPD exacerbation. Chest 2009;136:376-80. doi: 10.1378/chest.08-2918.
- McAllister DA, Maclay JD, Mills NL, Leitch A, Reid P, Carruthers R, et al. Diagnosis of myocardial infarction following hospiatlisation for exacerbation of COPD. Eur Respir J 2012;39:1097-103. doi: 10.1183/09031936. 00124811.
- Matamis D, Tsagourias M, Papathanasiou A, Sineffaki H3, Lepida D4, Galiatsou E, et al. Targeting occult heart failure in intensive care unit patient with acute chronic obstructive pulmonary disease exacerbation: Effect on outcome and quality of life. J Crit Care 2014;29:315.e7-14. doi: 10.1016/j.jcrc.2013.11.011.
- Freixa X, Portillo K, Par? C, Garcia-Aymerich J, Gomez FP, Benet M, et al. Echocardiographic abnormalities in patients with COPD at their first hospital admission. Eur Respir J 2013;41:784-91. doi: 10.1183/09031936.00222511.
- Soriano JB, Davis KJ, Coleman B, Visick G, Mannino D, Pride NB. The proportional Venn diagram of obstructive lung disease: two approximations from the United States and the United Kingdom. Chest 2003;124:474-81.
- Erelel M, Cuhadaroglu C, Ece T, Arseven O. The frequency of deep vein thrombosis and pulmonary embolism in acute exacerbations of chronic obstructive pulmonary disease. Respir Med 2002;96:515-8.
- Sch?nhofer B, K?hler D. Prevalence of deep vein thrombosis of the leg in patients with acute exacerbations of chronic obstructive pulmonary disease. Respiration1998;65:173-7.
- Gunen H, Gulbas G, In E, Yetkin O, Hacievliyagil SS. Venous thromboemboli and exacerbations of COPD. Eur Respir J 2010;35:1243-8. doi: 10.1183/09031936.00120909.
- Rizkallah J, Man SF, Sin DD. Prevalence of pulmonary embolismin acute exacerbations of COPD. A systematic review and meta-analysis. Chest 2009;135:786-93. doi: 10.1378/chest.08-1516.
- Takada K, Matsumoto S, Kojima E, Iwata S, Okachi S, Ninomiya K, et al. Prospective evaluation of the relationship between acute exacerbations of COPD and gastroesophageal re?ux disease diagnosed by questionnaire. Respir Med 2011;105:1531-6. doi: 10.1016/j.rmed.2011.03.009.
- Liang B, Wang M, Yi Q, Feng Y. Association of gastroesophageal re?ux disease risk with exacerbations of chronic obstructive pulmonary disease. Dis Esophagus 2013;26:557-60. doi: 10.1111/dote.12014.
- Kim J, Lee JH, Kim Y, Kim K, Oh YM, Yoo KH, et al. Association between chronic obstructive pulmonary disease and gastroesophageal reflux disease: anationalcross-sectional cohort study. BMC Pul Med 2013;13:51. doi: 10.1186/1471-2466-13-51.
- Laurin C, Moullec G, Bacon SL, Lavoie KL. Impact of anxiety and aepression on chronic obstructive pulmonary disease exacerbation risk. Am J Respir Crit Care Med 2012:185;918-23. doi: 10.1164/rccm.201105-0939PP.
- Eisner MD, Blanc PD, Yelin EH, Katz PP, Sanchez G, Iribarren C, et al. In?uence of anxiety on health outcomes in COPD. Thorax 2010;65:229-34. doi: 10.1136/thx.2009.126201.
- Wells JM, Washko GR, Han MK, Abbas N, Nath H, Mamary AJ, et al. Pulmonary arterial enlargement and acute exacerbations of COPD. N Engl J Med 2012;367:913-21. doi: 10.1056/NEJMoa1203830.
- Kucukcoskun M, Baser U, ?ztekin G, Kiyan E, Yalcin F. Initial periodontal treatment for prevention of chronic obstructive pulmonary disease exacerbations. J Periodontol 2013;84:863-70. doi: 10.1902/jop.2012.120399.
- Kew KM, Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2014;3:CD010115. doi: 10.1002/14651858.CD010115.pub2.
- Jackson DJ, Sykes A, Mallia P, Johnston SL. Asthma exacerbations: origin, effect, and prevention. J Allergy and Clin Immunol 2011;128:1165-74. doi:10.1016/j.jaci.2011.10.024.
- Bateman ED, Buhl R, O'Byrne PM, Humbert M, Reddel HK, Sears MR, et al. Development and validation of a novel risk score for asthma exacerbations: The risk score for exacerbations. J Allergy Clin Immunol 2014;pii:S0091-6749:01187-7. doi: 10.1016/j.jaci.2014.08.015.
- Pride NB, Milic-Emili J. Lung mechanics. In: Calverley PMA, MacNee W, Pride NB, Rennard SI (eds). Chronic Obstructive Pulmonary Disease. London: Arnold, 2000:151-174.
- Roca M, Verduri A, Corbetta L, Clini E, Fabbri LM, Begh? B. Mechanisms of acute exacerbation of respiratory symptoms in chronic obstructive pulmonary disease. Eur J Clin Invest 2013;43:510-21.
- Parshall MB, Schwartzein RM, Adams L, Banzett RB, Manning HL, Bourbeau J, et al. An official American Thoracic Society statement: update of mechanisms, assessment and managementof dyspnea. Am J Respir Crit Care Med 2012;185;435-52. doi: 10.1164/rccm.201111-2042ST.
- Chung KF, Adcock IM How variability in clinical phenotypes should guide research into disease mechanisms in asthma. Ann Am Thorac Soc 2013;(Suppl 10):S109-S17.
- Au DH, Bryson CL, Chien JW, Sun H, Udris EM, Evans LE, et al. The effects of smoking cessation on the risk of COPD exacerbations. J Gen Intern Med 2009;24:457-63. doi: 10.1007/s11606-009-0907-y.
- Nichol KL, Baken L, Nelson A. Relation between influenza vaccination and out patient visits, hospitalization and mortality in elderly patients with chronik lung disease. Ann Intern Med 1999;130:397-403.
- Wedzicha JA, Seemungal TA. COPD exacerbations: definiting their cause and prevention. Lancet 2007;370:786-96.
- Alfageme I, Vazquez R, Reyes N, Mu?oz J, Fern?ndez A, Hernandez M, et al. Clinical efficacy of anti-pneumococcal vaccination in patients with COPD. Thorax 2006;61:189-95.
- Griffiths TL, Burr ML, Campbell IA, Lewis-Jenkins V, Mullins J, Shiels K, et al. Results at 1 year of outpatient? multidisciplinary pulmonary rehabilitation. Lancet 2000;355:362-8.
- Garcia-Aymerich J, Farrero E, F?lez MA, Izquierdo J, Marrades RM, Ant? JM; Estudi del Factors de Risc d'Aguditzaci? de la MPOC investigators. Risk faktors of readmission to hospital for COPD exacerbation: prospective study. Thorax 2003;58:100-5.
- Casanova C, Celli BR, Tost L, Soriano E, Abreu J, Velasco V, et al. Long-term controlled trial of nocturnal nasal positive pressure ventilation in patients with severe COPD. Chest 2000;118:1582-90.
- Zahid I, Sharif S, Routledge T, Scarci M. Is volume reduction surgery effective in the treatment of ? advanced emphysema? Intract Cardiovasc Thorac Surg 2011;12:480-6. doi: 10.1510/icvts.2010.252213
- Washko GR, Fan VS, Ramsey SD, Mohsenifar Z, Martinez F, Make BJ, et al. The effect of lung volume reduction surgery on chronic obstructive pulmonary disease exacerbations. Am J Respir Crit Care Med 2008;177:164-9.
- Dusser D, Bravo ML, Iacano P. The effect of tiotropium on exacerbations and airflow in patients with COPD. Eur Respir J 2006;27:547-55.
- Tashkin DP, Celli B, Senn S, Burkhart D, Kesten S, Menjoge S, et al. A 4-year trial of tiotropium in chronic obstructive pulmonary disease. N Engl J Med 2008;359:1543-54 doi: 10.1056/NEJMoa0805800.
- Anzueto A, Niewoehner DE, Leimer I, R?hmkorf F, Celli BR, Decramer M, et al. A post hoc pooled analysis of exacerbations among US participants in randomised controled trials of tiotropium. Respir Med 2013;107:1912-22. doi: 10.1016/j.rmed.2013.07.020.
- Wang J, Nie B, Xiong W, Xu Y. Effect of long-acting beta-agonists on the frequency of COPD exacerbations; meta-analysis. J Clin Pharmacy Ther 2012;37:204-11. doi: 10.1111/j.1365-2710.2011.01285.x.
- Aaron S, Vandemheen KL, Fergusson D, Maltais F, Bourbeau J, Goldstein R, et al. Tiotropium in combination with plasebo, salmeterol, or fluticasone-salmeterol for treatment of COPD. Ann Intern Med 2007;146:545-55.
- Calverley PM, Anderson JA, Celli B, Ferguson GT, Jenkins C, Jones PW, et al. Salmeterol and fluticasone propionate and survival in chronic obstructive pulmonary disease. N Engl J Med 2007;356:775-7.
- Dransfiet MT, Bourbeau J, Jones PW, Hanania NA, Mahler DA, Vestbo J, et al. Once-daily inhaled fluticasone furuate and vilanterol versus vilanterol only for prevention of exacerbations of COPD: two replicate double-blinde, paralel-group, randomised controled trials. Lancet Respir Med 2013;1:210-23. doi: 10.1016/S2213-2600(13)70040-7.
- Wedzicha JA, Calverley PMA, Seemurgal TA, Hagan G, Ansari Z, Stockley RA; INSPIRE Investigators. The prevention of COPD exacerbations by salmeterol/fluticasone propionate or tiotropium bromide. Am J Respir Crit Care Med 2008;177:19-26.
- Wedzicha JA, Rabe KF, Martinez FJ, Bredenbr?ker D, Brose M, Goehring UM, et al. Efficacy of roflumilast in the COPD frequent exacerbator phenotype. Chest 2013;143:1302-11. doi: 10.1378/chest.12-1489.
- Calverley PMA, Rabe HF, Goehring UM, Kristiansen S, Fabbri LM, Martinez FJ, et al. Roflumilast in semptomatik chronic obstructive pulmonary disease; two randomised clinical trial. Lancet 2009;374:685-94. doi: 10.1016/S0140-6736(09)61255-1.
- Rennard SI, Calverley PM, Goehring UM, Bredenbr?ker D, Martinez FJ. Reduction of exacerbations by the PDE4 inhibitors roflumilast--the importance of definiting differend susets of patients with COPD. Respir Res 2011;12:18. doi: 10.1186/1465-9921-12-18.
- Bateman ED, Rabe KF, Calverley PM, Goehring UM, Brose M, Bredenbr?ker D, et al. Roflumilast with long-acting beta2-agonist for COPD: influence of exacerbation history. Eur Respir J 2011;38:553-60. doi: 10.1183/09031936.00178710.
- Poole PJ, Black PN. Mucolytic agents for COPD. Cochrane Database Syst Rev 2006;3:CD001287.
- Miravitlles M, Soler-Cataluna JJ, Calle M, Molina J, Almagro P, Quintano JA, et al. Spanish COPD guidelines (GesEPOC): Pharmacological treatment of stable COPD. Spanish Society of Pulmonology and Thoracic Surgery. Arch Bronconeumol 2012;48:247-57.
- Albert RK, Connett J, Bailey WC, Casaburi R, Cooper JA Jr, Criner GJ, et al. Azitromycin for prevention of exacerbations of COPD. N Engl J Med 2011;365:689-98. doi: 10.1056/NEJMoa1104623.
- Donalth E, Chaudhry A, Hernandez-Aya LF, Lit L. A meta-analysis on the prophylactic use of macrolide antibiotics fort he prevention of disease exacerbations in patients with Chronic Obstructive Pulmonary Disease. Respir Med 2013;107:1385-92. doi: 10.1016/j.rmed.2013.05.004.
- United State Food and Drug Administration. FDA Drug safety communication: Azitromycin (Zithromax or Zmax) and risk of potantially fatal heart rhythms. March 2013.
- Sethi S, Jones PW, Theron MS, Miravitlles M, Rubinstein E, Wedzicha JA, et al. Pulsed moxifloxacin for the prevention of exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Respir Res 2010;11:10. doi: 10.1186/1465-9921-11-10.
- Lasserson TJ, Ferrara G, Casali L. Combination fluticasone and salmeterol versus fixed dose combination budesonide and formoterol for chronic asthma in adults and children. Cochrane Database Syst Rev 2011;12:CD004106. doi: 10.1002/14651858.CD004106.pub4
- Cates CJ, Wieland LS, Oleszczuk M, Kew KM. Safety of regular formoterol or salmeterol in adults with asthma: an overview of Cochrane reviews. Cochrane Database Syst Rev 2014;2:CD010314. doi: 10.1002/14651858.CD010314.pub2.
- Kew KM, Karner C, Mindus SM, Ferrara G. Combination formoterol and budesonide as maintenance and reliever therapy versus combination inhaler maintenance for chronic asthma in adults and children. Cochrane Database Syst Rev. 2013;12:CD009019. doi: 10.1002/14651858.CD009019.pub2.
- Chauhan BF, Ducharme FM. Addition to inhaled corticosteroids of long-acting beta2-agonists versus anti-leukotrienes for chronic asthma. Cochrane Database Syst Rev. 2014;1:CD003137. doi: 10.1002/14651858.CD003137.pub5.
- Hagan JB, Samant SA, Volcheck GW, Li JT, Hagan CR, Erwin PJ, et al. The risk of asthma exacerbation after reducing inhaled corticosteroids: a systematic review and meta-analysis of randomized controlled trials. Allergy 2014;69:510-6. doi: 10.1111/all.12368.
- Normansell R, Walker S, Milan SJ, Walters EH, Nair P. Omalizumab for asthma in adults and children. Cochrane Database Syst Rev 2014;1:CD003559. doi: 10.1002/14651858.CD003559.pub4.
- Rebuck AS, Chapman KR, Abboud R, Pare PD, Kreisman H, Wolkove N, et al. Nebulized anticholinergic and sympathomimetic treatment of asthma and chronic obstructive airways disease in the emergency room. Am J Med 1987;82:59-64.
- Johnson MK, Stevenson RD. Management of an acute exacerbation of COPD: are we ignoring the evidence ? Thorax 2002;57(Suppl 2):SII15-SII23.
- Rennard SI. Treatment of stable chronic obstructive pulmonary disease. Lancet 2004;364:791-802.
- Polverino E, Gomez FP, Manrique H, Soler N, Roca J, Barber? JA, et al. Gas exchange response to short acting beta2-agonists in chronic obstructive pulmonary disease severe exacerbations. Am J Respir Crit Care Med 2007;176: 350-5.
- McCrory DC, Brown CD. Anti-cholinergic bronchodilators versus beta2-sympathomimetic agents for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2002;CD003900.
- Moayyedi P, Congleton J, Page RL, Pearson SB, Muesr MF. Comparison of nebulised salbutamol and ipratropium bromide with salbutamol alone in the treatment of chronic obstructive pulmonary disease. Thorax 1995;50:834-7.
- Nair S, Thomas E, Pearson SB. Henry MT. A randomized controlled trial to assess the optimal dose and effect of nebulized albuterol in acute exacerbations of COPD. Chest 2005;128:48-54.
- Celli BR, MacNee W; ATS/ERS Task Force. Standards for the diagnosis and treatment of patients with COPD: a summary of the ATS/ERS position paper. Eur Respir J 2004;23:932-46.
- Di Marco F, Verga M, Santus P, Morelli N, Cazzola M, Centanni S. Effect of formoterol, tiotropium and their combination in patients with acute exacerbation of chronic obstructive pulmonary disease: a pilot study. Respir Med 2006;100:1925-32.
- Barr RG, Rowe BH, Camargo CA. Methylxanthines for exacerbations of chronic obstructive pulmonary disease: meta-analysis of randomized trials. BMJ 2003;327:643.
- Quon BS, Gan WQ, Sin DD. Contemporary management of acute exacerbations of COPD: a systematic review and meta-analysis. Chest 2008;133:756-66. doi: 10.1378/chest.07-1207.
- Llor C, Moragas A, Hernandez S, et al. Efficacy of antibiotic therapy for acute exacerbations of mild to moderate chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2012;186:716-23. doi: 10.1164/rccm.201206-0996OC.
- Vollenweider DJ, Jarrett H, Steurer-Stey CA, Garcia-Aymerich J, Puhan MA. Antibiotics for exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2012;12:CD010257. doi: 10.1002/14651858.CD010257.
- Ba?o?lu ?K, Say?ner AA, Zeytino?lu A, Say?ner A. The role of atypical bacteria in acute exacerbations of chronic obstructive pulmonary disease. Turkish Respiratory Journal 2005;6:22-27.
- Siempos II, Dimopoulos G, Korbila IP, Manta K, Falagas ME. Macrolides, quinolones and amoxicillin/clavulanate for chronic bronchitis: a meta-aanlysis. Eur Respir J 2007;29: 1127-37.
- Schembri S, Williamson PA, Short PM, Singanayagam A, Akram A, Taylor J, et al. Cardiovascular events after clarithromycin use in lower respiratory tract infections: analysis of two prospective cohort studies. BMJ 2013;346:f1235. doi: 10.1136/bmj.f1235.
- Walters JA, Gibson PG, Wood-Baker R, Hannay M, Walters EH. Systemic corticosteroids for acute exacerbations of chronic obstructive pulmonary disease. Cochrane Database Syst Rev 2009;CD001288. doi: 10.1002/14651858.CD001288.pub3.
- Say?ner A, Aytemur ZA, Cirit M, ?nsal I. Systemic glucocorticoids in severe exacerbations of COPD. Chest 2001;119:726-30.
- Leuppi JD, Schuetz P, Bingisser R, Bodmer M, Briel M, Drescher T, et al. Short-term vs conventional glucocorticoid therapy in acute exacerbations of chronic obstructive pulmonary disease: the REDUCE randomized clinical trial. JAMA 2013;309:2223-31. doi: 10.1001/jama.2013.5023.
- Lndenauer PK, Pekow PS, Lahti MC, Lee Y, Benjamin EM, Rothberg MB. Association of corticosteroid use and route of administration with risk of treatment failure in avute exacerbations of chronic obstructive pulmonary disease. JAMA 2010;303:2359-67. doi: 10.1001/jama.2010.796.
- ?eviker Y, Say?ner A. Comparison of two systemic steroid regimens for the treatment of COPD exacerbations. Pulm Pharmacol Ther 2014;27:179-83. doi: 10.1016/j.pupt.2013.03.004.
- Maltais F, Ostinelli J, Bourbeau J, Tonnel AB, Jacquemet N, Haddon J, et al. Comparison of nebulized budesonide and oral prednisolone with placebo in the treatment of acute exacerbations of chronic obstructive pulmonary disease: a randomized controlled trial. Am J Respir Crit Care Med 2002;165:698-703.
- G?nen H, Hac?evliyagil SS, Yetkin O, G?lba? G, Mutlu LC. The role of nebulised budesonide in the treatment of exacerbations of COPD. Eur Respir J 2007;29:660-7.
- Black PN, Morgan-Day A, McMillan TE, Poole PJ, Young RP. Randomised, controlled trial of N-acetylcysteine for treatment of acute exacerbations of chronic obstructive pulmonary disease. BMC Pulm Med 2004;4:13.
- Aytemur ZA, Baysak A, ?zdemir ?, Sayiner A. N-Acetylcysteine in exacerbations of chronic obstrutive pulmonary disease associated with increased sputum. Am J Respir Crit Care Med 2011;183:A3123.
- Isbaniah F, Wiyono WH, Yunus F, Setiawati A, Totzke U, Verbruggen MA. Echinacea purpurea along with zinc, selenium and vitamin C to alleviate exacerbations of chronic obstructive pulmonary disease: results from a randomized controlled trial. J Clin Pharm Ther 2011;36:568-57. doi: 10.1111/j.1365-2710.2010.01212.x.
- Stefan MS, Rothberg MB, Priya A, Pekow PS, Au DH, Lindenauer PK. Association between beta-blocker therapy and outcomes in patients hospitalized with acute exacerbations of chronic obstructive lung diasease with underlying ischemic heart disease, heart failure or hypertension. Thorax 2012;67:977-984. doi: 10.1136/thoraxjnl-2012-201945.
Yaz??ma Adresi (Address for Correspondence)
Dr. Nurhayat YILDIRIM
Istanbul ?niversitesi Cerrahpa?a T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
ISTANBUL-TURKEY
e-mail: nurhayatyil@hotmail.com