REVIEW
Doi: 10.5578/tt.8314
Tuberk Toraks 2014;62(4):301-315

Ven?z tromboembolizm? ve kanser
O?uzhan OKUTAN1, ?mer AYTEN1
1 GATA Haydarpa?a E?itim Hastanesi, G???s Hastal?klar? Klini?i, ?stanbul, T?rkiye
1 Clinic of Chest Diseases, GATA Haydarpasa Training Hospital, Istanbul, Turkey
?ZET
Ven?z tromboembolizm ve kanser
Ven?z tromboemboli (VTE) kanser hastalar?nda mortalite ve morbidite ?zerinde ?nemli etkileri olan komplikasyonlardan birisidir. VTE geli?en kanser hastalar?nda erken mortalite geli?me oran? daha y?ksektir. Bu komplikasyon kanserin h?cre tipi ve evresi, tedavi esnas?nda uygulanan kanser cerrahisi, kateter uygulamas?, kemoterap?tik ajanlarla ili?kilidir. Kanser hastalar?n?n tedavi ve takiplerinde VTE profilaksisi ve/veya tedavisi mortalite ve morbidite oranlar?nda azalmay? sa?layacakt?r. VTE profilaksisi ve tedavisi, hastalar?n gerek kanser tipi, gerekse uygulanacak tedavi yakla??mlar?na g?re farkl?l?klar arz etmektedir. Bu derlemede uluslararas? uzla?? raporlar? dikkate al?narak patogenez, risk fakt?rleri ve tedavi yakla??mlar?n?n anlat?lmas? hedeflenmi?tir.
Anahtar kelimeler: Ven?z tromboembolizm, kanser
SUMMARY
Venous thromboembolism and cancer
Venous thromboembolism (VTE) is one of the complications which have significant influence on mortality in patient with cancer. Early mortality rate is high in cancer patients who have VTE. This complication is related with cell type and stage of the cancer, surgery applied during cancer treatment, applying catheter and the chemotherapeutic agents. VTE prophylaxis and/or treatment in treatment and follow-up of cancer patients will provide a reduction in mortality and morbidity rates. VTE prophylaxis and treatment poses differences according to both treatment approaches which will be applied and the type of cancer. It has been aimed to describe pathogenesis, risk factors and treatment approaches taking into account international consensus reports in this review.
Key words: Venous thromboembolism, cancer
G?R??
Ven?z tromboembolizm (VTE), kanser hastalar?nda mortalite ve morbidite ?zerine ?nemli etkileri olan komplikasyonlardan birisidir. VTE, kanser hastalar?nda ?l?mlerin en s?k ikinci sebebi olmakla beraber, VTE tan?s?yla yat?r?lan hastalarda e?lik eden kanser varl???nda hastalar?n %94'? ilk alt? ayda kaybedilmektedir (1). Bu s?k kar??la??lan komplikasyon ilk olarak 1865 y?l?nda Trouseau taraf?ndan g?sterilmi?tir. Trouseau, gastrik karsinomlu hastada a??klanamayan derin ven trombozunu saptayarak bu hastalarda koag?lasyonda art?? oldu?unu savunmu?tur. Daha sonra Trouseau sendromu olarak da bilinen gezici, a??klanamayan trombofilebit varl???n?n tespit edilemeyen bir visseral kanserin bulgusu olabilece?ini g?stermi?tir (2). Bu tarihten sonra yap?lan bir?ok ?al??mada da kanser hastalar?nda VTE'nin tedavi y?netiminde zorluklara yol a?t??? ve ya?am s?releri ?zerine olumsuz etkileri g?sterilmi?tir.
Kanser hastalar?nda VTE riskinin 4 ila 7 kat artt??? bilinmektedir (3). Kanser hastalar?nda VTE insidans? net olarak bilinmemekle birlikte genel anlamda kanserli hastalarda VTE s?kl??? %4-20 oran?nda de?i?mektedir (3). Shinagare ve arkada?lar? yakla??k 14.000 kanserli hastan?n alt? y?ll?k takipleri s?ras?nda VTE insidans?n? %2.87 olarak bulmu?lard?r (4). Jonnson ve arkada?lar? kanserli hastalar?n %15'inde klinik olarak saptanabilen VTE varl???n? g?stermi?ler, subklinik VTE oranlar?yla birlikte bu oran?n daha da artabilece?ini vurgulam??lard?r (5).
R?SK FAKT?RLER?
Kanser Tipi ve Evresi
Kanser tipine g?re VTE oranlar? de?i?ebilmekle birlikte yap?lan ?al??malarda VTE saptanan kanser t?rlerinin s?kl??? aras?nda bir tutarl?l?k yoktur. Ancak metastatik kanser varl??? VTE i?in en ?nemli predikt?r odlarak g?sterilmi?tir. Chew ve arkada?lar? kanser hastalar?nda ilk y?l VTE riskinin daha y?ksek oldu?unu ve VTE saptad?klar? kanser hastalar?n? s?kl?k s?ras?na g?re, metastatik akci?er kanseri, uterus, mesane, pankreas, mide ve b?brek kanserleri olarak saptam??lard?r (6). Bu kanserlerin metastaz yapm?? olanlar?nda, lokalize olanlar?na g?re VTE s?kl???n?n 4 ile 13 kat artt???n? tespit etmi?lerdir. Jones ve arkada?lar? da benzer ?ekilde metastatik kanserlerde VTE riskini daha y?ksek olarak saptam??lar, VTE riskinin s?ras?yla hematolojik kanserler, akci?er, gastrointestinal sistem, beyin ve b?brek kanserlerinde daha y?ksek oldu?unu belirlemi?lerdir (7). "Multiple Environmental and Genetic Assessment (MEGA)" ?al??mas?nda da tan?dan sonra birka? ay i?inde VTE riskinin daha fazla oldu?u belirtilmi? ve s?ras?yla hematolojik, akci?er ve gastrointestinal kanserlerinde VTE s?kl??? daha y?ksek oranda saptanm??t?r (8). Shinagare ve arkada?lar? alt? y?ll?k takiplerinde s?ras?yla santral sinir sistemi, pankreas, ?st gastrointestinal sistem ve akci?er kanserlerinde VTE oranlar?n? di?er kanserlere nazaran daha y?ksek oranda saptam??lard?r (4). Khorana ve arkada?lar? ise geli?tirdikleri klinik skorlamada mide ve pankreas kanserlerinde VTE riskinin en y?ksek oldu?unu ve akci?er, lenfoma, jinekolojik, mesane ve testis kanserlerinin de VTE i?in y?ksek risk ta??d?klar?n? saptam??lard?r (9). Y?ksek grade gliomalar?n da VTE i?in y?ksek risk ta??d?klar? g?sterilmi?tir. Bir prospektif randomize plasebo kontroll? ?al??mada tromboprofilaksi uygulanmayan y?ksek grade gliomalarda tan? konulduktan alt? ay sonra toplam VTE geli?me olas?l??? %17 olarak saptanm??t?r (10). Y?ksek VTE riski saptanan di?er bir kanser t?r? de multipl miyelomad?r. Multipl miyelomal? hastalar?n VTE g?r?lme s?kl??? uygulanan tedavi modalitelerine g?re de?i?kenlik g?stermekle beraber bu oran %10'u bulmaktad?r (11).
Kemoterapi
?o?u sistemik kanser tedavilerinin VTE riskini art?rd??? bilinmektedir. Otten ve arkada?lar? kemoterapi sonras? ilk ?? ay i?erisinde VTE oran?n? %7.3 ve y?ll?k insidans? da tahmini %10.9 olarak saptam??lar, fluorourasil ve l?kovorin kalsiyumla tedavi edilen kolorektal kanserler de VTE riskini daha y?ksek bulmu?lard?r (12). Bir ?al??mada karmustin, diazikuon (damar i?i) ve sisplatin kemoterapisi uygulanan high grade gliomlarda VTE riski %19 bulunmu?tur (13).
Kemoterapiyle ili?kili VTE olgular? ?ncelikle meme kanseri tedavilerinde dikkati ?ekmi?tir. Perioperatif kemoterapi uygulanan erken evre meme kanserlerinin %1'inde tromboembolik komplikasyonlar saptanm??t?r (14). Evre II meme kanserlerinde bu oran %2-10 aras?nda de?i?mekle beraber, Evre 4 meme kanserlerinde bu oran daha da y?ksek saptanm??t?r (%15) (15). Meme kanserlerinde uygulanan farkl? kemoterapi rejimlerinin tromboembolik komlikasyonlara etkisi tart??mal? bir durumdur. Siklofosfamid-metotreksat-fluorourasil (SMF) kullanan hastalarda protein C ve S seviyelerinin azald??? g?sterilse de bu durumun klinik olarak tromboza e?ilimi g?sterilememi?tir (16,17). Levine ve arkada?lar? 205 Evre 2 meme kanserli hastada 12 haftal?k siklofosfamid-metotreksat-fluorourasil-vinkristin-prednizon-doksorubisin-tamoksifen ve 36 haftal?k siklofosfamid-metotreksat-florourasil-vinkristin-prednizon tedavisi kar??la?t?r?ld???nda ilk 12 haftal?k d?nemde ilk grupta be? hastada, ikinci grupta d?rt hastada tromboz saptam??lard?r (18).
SMF yerine kullan?lan yeni antrasiklin bazl? kemoterap?tiklerin trombosiz ?zerine etkilerini g?steren ?al??malar s?n?rl?d?r. Bu kemoterap?tiklerin fibrinolitik sistem belirte?leri olan plazminojen aktivat?r inhibit?r? 1 (PAI-1) ve thrombin activitable fibrinolysis inhibit?r (TAFI) seviyelerinde bir de?i?iklik yapmad??? g?sterilmi?tir (19).
Meme kanserli hastalarda kemoterapiyle e? zamanl? tamoksifen kullan?m? tromboembolik komplikasyon s?kl???n? art?rmaktad?r. Fischer ve arkada?lar? "Study of the National Surgical Adjuvant Breast and Bowel Project (NSABP-B20)" ?al??mas?nda yaln?z tamoksifen alan meme kanserli hastalarda tromboembolik komplikasyon g?r?lme oran?n? %1.9, metotreksat-florourasil (MF) veya siklofosfamid-metotreksat-fluorourasil ile birlikte tamoksifen (SMF-T) kullan?m?nda ise s?ras?yla %6.5 ve %7 olarak bulmu?lard?r (20). Kanada Ulusal Kanser Enstit?s? de benzer ?ekilde SMF-T kullanan grupta tek ba??na tamoksifen kullanan gruba g?re tromboembolik komplikasyonlar?n belirgin artm?? oldu?unu saptam??lard?r (s?ras?yla %13.6, %2.6) (21).
Talidomid ve talidomid analo?u olan lenalidomid ?zellikle multipl miyeloma tedavisinde kullan?lan imm?nmod?lat?r ajanlard?r. Tek ajan talidomid kullanan multipl miyeloma hastalar?nda VTE riskinin artt??? g?sterilse de (%1-4), klinik anlam? tart??mal?d?r ve antikoag?lan profilaksisi ?nerilmemektedir. Ancak ?zellikle yeni tan? konulan multipl miyeloma hastalar?nda talidomidin, deksometazon veya di?er kemoterap?tik ajanlarla kombinasyon rejimlerinde VTE riski ?ok y?ksek olarak saptanm??t?r (s?ras?yla %14-26, %16-34) (22-24). Lenalidomidin talidomide nazaran multipl miyeloma tedavisinde daha etkili ve daha az yan etkilere sahip oldu?u g?sterilse de lenalidomid kombine rejimlerinin de y?ksek VTE riski dikkat ?ekmektedir (%9-15) (25). Alexander ve arkada?lar? tromboprofilaksi uygulanan talidomid ve lenalidomide bazl? rejimlerde de VTE riskini y?ksek olarak saptam??lard?r (s?ras?yla %9.3, %9.1) (26).
Platin bazl? kemoterap?tiklerin VTE riskini art?rd??? g?sterilmi?tir. Sisplatin bazl? rejim uygulanan hastalarda, tedavi esnas?nda ve son doz yap?ld?ktan sonra bir ay i?erisinde geli?en tromboembolik komplikasyonlar?n retrospektif incelendi?i bir ?al??mada, olgular?n yakla??k 1/5 (%18)'inde bir tromboembolik komplikasyon geli?ti?ini bildirilmi?tir (27). Randomize kontroll? ?al??malar?n al?nd??? 8200 hastay? i?eren bir meta-analizde, sisplatin bazl? rejimlerde VTE s?kl???n?n (%1.92) sisplatin i?ermeyen rejimlere (%0.79) g?re anlaml? olarak y?ksek oldu?u saptanm??t?r (28).
Bevacizumab t?m?r anjiyogenezinde ?nemli bir role sahip olan vask?ler endotelyal b?y?me fakt?r? (VEGF) hedef alan monoklonal bir antikordur. Bevacizumab kullan?m?n?n arteryel ve ven?z tromboemboli riskini art?rd??? bilinmektedir. Son y?llarda yay?nlanan iki meta-analizde bevacizumab kullanan hastalar?n %11.9'unda VTE ve %3.3'?nde arteryel tromboemboli (ATE) saptanm??t?r (29,30).
Kanserli hastalarda eritropoietin ve darbepoietin gibi eritropoezi stim?le edici ajanlar?n anemi ve transf?zyon ihtiyac?n? azaltmas? gibi olumlu etkilerine ra?men artan ?l?m ve VTE riskleri nedeniyle rutin kullan?mlar? ?nerilmemektedir (31,32).
Akut l?semili hastalarda L-Asparaginase kullan?m?n?n antitrombin 3, fibrinojen ve di?er hemostatik proteinleri azaltarak trombotik komplikasyonlar? art?rd??? bilinmektedir. L-aspariginase kullanan akut l?semili hastalar?n yakla??k %5-15'inde trombotik komplikasyonlar izlenmekle beraber bu komplikasyonlar?n ?o?unlu?u ind?ksiyon tedavisi esnas?nda g?r?lmektedir (33-35).
Cerrahi Operasyon
Cerrahi operasyonlar?n VTE riskini art?rd??? bilinen bir ger?ektir. Ancak kanser cerrahisi uygulanan hastalarda veya kanserli hastalar?n di?er cerrahi operasyonlar?nda bu risk daha da artmaktad?r. Benzer cerrahi operasyon uygulanan kanser hastalar?nda postoperatif VTE riski, kanser olmayan hastalara g?re ?? kat, kanser cerrahisi uygulanan hastalarda postoperatif fatal emboli riski kanser d??? cerrahilere g?re d?rt kat artm??t?r (3). Maj?r kanser cerrahisi uygulanan yakla??k 45.000 hastan?n de?erlendirildi?i bir ?al??mada postoperatif 30 g?n i?erisindeki VTE geli?me riski %3.5 olarak bulunmu?tur. Ayn? ?al??mada VTE i?in en y?ksek riske sahip operasyonlar s?ras?yla ?zefagus rezeksiyonlar? (%13.2), radikal sistektomi, pankreatektomi ve panreatik duedonektomi olarak saptanm??t?r. Prostetektomi ise en d???k VTE riskine sahip kanser cerrahisi olarak bulunmu?tur (36). R?STOS ?al??mas?nda da kanser cerrahisi sonras? VTE insidans? %2.1 olarak bulunmu?tur. VTE insidans? genel cerrahi operasyonlar?nda %2.8, jinekoloji operasyonlar?nda %2 ve ?roloji operasyonlar?nda %0.87 saptanm??t?r (37).
Cerrahi uygulanan akci?er kanserli hastalar?n ortalama 16 ayl?k takiplerinde tahmin edilen postoperatif VTE riski %2 olarak bulunmu?tur (%0.2-%19) (38). Benzer ?ekilde ba?-boyun kanserlerinde cerrahi uygulanan hastalar?n %2'sinde VTE saptanm??t?r (39).
Kateterizasyon
Santral veya periferik ven?z kateterizasyon, kanser hastalar?nda kemoterapi ajanlar?n?n, kan ve beslenme ?r?nlerinin etkin bir ?ekilde uygulanmas? i?in s?kl?kla kullan?lmaktad?r. Kateterizasyon uygulanan hastalarda lokal (kateter etraf?nda ve kateter l?meni i?inde fibrin birikimi, trombofilebit vb.) veya sistemik (VTE) kateterle ili?kili bir?ok trombotik komplikasyonlar izlenebilmektedir. Kanser hastalar?nda semptomatik kateterle ili?kili tromboz s?kl??? yakla??k olarak %4, asemptomatik kateterle ili?kili tromboz s?kl??? enoksaparin profilaksisisi uygulananlarda %14 profilaksi uygulanmayanlarda %18 olarak bulunmu?tur (40,41). Santral ven?z kateter (SVK) uygulanan kanser hastalar?n?n %0.3-28.3'?nde semptomatik DVT saptanm?? bu hastalar?n yakla??k %15-25'inde pulmoner emboli tespit edilmi?tir. Venografi yap?lan hastalarda bu oran daha da y?ksek bulunmu?tur (%27-66) (42).
Kateterle ili?kili tromboz s?kl??? uygulanan kateterin t?r?ne, kateterin yerle?tirildi?i damara, kanser t?r?ne ve uygulanan kanser tedavisine g?re de?i?kenlik g?sterir (43). Rehberler kateter se?iminde hasta ?zelliklerinin, uygulanacak kemoterapi t?r?n?n ve s?resinin ?ncelikle g?z ?n?nde bulundurulmas?n? ?nermektedir. Ancak periferik yolla tak?lm?? santral ven?z kateterlerle t?nelli santral ven?z kateterlerin (Hickman), port kateterlere g?re, s?ras?yla femoral, subklavyen venlere tak?lan kateterlerin jug?ler vene tak?lanlara g?re kateterle ili?kili tromboz riski daha y?ksek bulunmu?tur. Yine ?ok l?menli kateterlerin daha az l?menli kateterle g?re, vena kava s?periyordan daha y?ksek seviyede tak?lanlar?n, daha a?a?? seviyede tak?lanlara g?re ve sol subklavyen vene tak?lanlar?n sa? subklavyen vene tak?lanlara g?re, kateterle ili?kili tromboz geli?me riski daha y?ksek bulunmu?tur (44,45).
Klinik Risk Fakt?rleri
Kansere ?zg? risk fakt?rlerinin d???nda, kanser hastalar?nda VTE riskinin belirleyen baz? klinik risk fakt?rleri de bulunmaktad?r. Bunlar aras?nda hospitalizasyon, e?lik eden komorbid hastal?klar (infeksiyon, renal hastal?klar, konjestif kalp yetmezli?i vb.), ailesel veya edinsel hiperkoag?labilite, ileri ya?, kad?n cinsiyet, siyahi ?rk, immobilite ve beden kitle endeksi (BK?) > 35 kg/m2 ?zerinde olmas? gibi fakt?rle say?labilir (9,46,47).
Uluslararas? miyeloma ?al??ma grubu, kanserle ili?kili risk fakt?rleri d???nda (cerrahi, kateter, kemoterapi vb.) d???nda, obezite (BK? ≥ 30 kg/m2), hiperviskozite, daha ?nce VTE ?yk?s?, e?lik eden komorbid hastal?klar (kronik renal hastal?klar, kalp hastal?klar?, diyabet vb.) p?ht?la?ma bozukluklar?, olan hastalar? VTE geli?imi i?in risk fakt?rleri olarak belirlemi?tir (48). Kanserli hastalarda VTE risk fakt?rleri Tablo 1'de ?zetlenmi?tir.
Baz? laboratuvar parametrelerinin de kanser hastalar?nda artm?? VTE riskiyle ili?kili oldu?u g?sterilmi?tir (9). Bu hastalarda ?zellikle trombositoz varl???nda VTE riski belirgin olarak artmaktad?r. Simanek ve arkada?lar? "Vienna Cancer and Thrombosis Study (CATS)" ?al??mas?nda trombosit say?s? 443 x 109/L nin ?zerinde olan kanserli hastalarda bir y?l?n sonunda toplam VTE geli?me olas?l???n? %34.3 olarak bulmu?lard?r (49). Bunun yan?nda anemi ve l?kositoz varl???nda da VTE geli?imi ?zerine etkileri g?sterilmi?tir. Khorana ve arkada?lar? hemoglobin seviyesi < 10 g/dL ve kemoterapi ?ncesi l?kosit say?s? 11 x 109/L olan hastalarda VTE geli?me riskinin daha y?ksek oldu?u saptanm??t?r (9).
Kanserli hastalarda VTE i?in risk fakt?rlerinin belirlenmesi profilaksi karar? i?in b?y?k ?nem arz etmektedir. Bu hastalarda VTE riskinin belirlenmesi ve profilaksi karar?n?n verilmesinde kullan?lacak ortak skorlama y?ntemlerine ihtiya? duyulmaktad?r. Bu konuda t?m kanser hastalar?n? kapsayan bir skorlama sistemi bulunmamakla beraber yak?n zamanda Khorana ve arkada?lar? ayaktan takip edilen kanser hastalar? i?in VTE riskini belirlemede basit bir skorlama sistemi geli?tirmi?lerdir (Tablo 2) (9). Bu skorlama sistemi be? parametreden olu?makta ve ≥ 3 ?zeri risk puan? olan hastalar VTE i?in y?ksek riskli kabul edilmektedir. Daha sonra Cihan Ayve arkada?lar? bu skorlamaya D-dimer ve soluble P-selektini (sP-selectin) de ekleyerek modifiye etmi?lerdir (50). D-dimer ≥ 1.44 ?g/mL, sP-selectin ≥ 53.1 mg/mL, olan hastalar VTE i?in riskli olduklar?n? ve y?ksek grade gliomalarda y?ksek riskli kanser t?rleri aras?nda de?erlendirilmesi gerekti?ini belirtmi?lerdir.
PATOGENEZ
Kanserli hastalarda tromboz patogenezi halen net olarak a??klanabilmi? de?ildir. Bu hastalarda tromboz ?zerine etkili bir?ok fakt?r?n bulunmas? patogenezin tam olarak anla??lmas?n? zorla?t?rmaktad?r. Ancak patogenezde Wirchov'un tan?mlad??? trombozun ?? temel fakt?r? (hiperkoag?labilite, staz, endotel hasar?) ?zerinden bak?ld???nda kanser hastalar?nda bu ?? temel fakt?rde de patolojik de?i?iklikler g?r?lmektedir.
Kanserli hastalarda t?m?r h?crelerinden veya normal h?crelerden prokoag?lan ve proagregan bir?ok fakt?r salg?lanmaktad?r. Bu hastalarda gerek salg?lanan bu fakt?rler gerekse dola??mdaki inflamatuvar sitokinler arac?l???yla koag?lasyon sistemi aktiflenmektedir (51).
Kanserde artm?? prokoag?lan fakt?rlerden en ?ok bilineni doku fakt?r?d?r. Doku fakt?r? akci?er, plasenta, beyin, monosit ve endotel h?crelerinde bulunan Fakt?r VII'nin aktive olarak Fakt?r X'u aktive etmesini sa?layarak ekstrensek yolu ba?latan bir kofakt?rd?r. Vask?ler hasar olu?tu?unda vask?ler fibroblastlardan salg?lanarak koag?lasyon kaskad?n?n aktiflenmesini sa?lar. Doku fakt?r? meme, kolorektal, ba?-boyun, pankreas gibi bir?ok t?m?r h?cresi ve t?m?r i?erisindeki vask?ler endotel h?crelerinden ve t?m?rle etkile?mi? makrojajlardan salg?land??? g?sterilmi?tir. Salg?lanan doku fakt?r?n?n tromboz yan?nda t?m?r?n anjiogenezi, b?y?mesi ve metastaz?nda da ?nemli bir rol oynamaktad?r (52,53).
Dola??mdaki kan, endotel h?cresi, trombosit gibi de?i?ik h?cre orijinli bir?ok mikropartik?l i?ermektedir. Bu mikropartik?ller h?cre y?zeyinden proteolitik bir b?l?nme sonucu dola??ma sal?nan membran vesik?lleri olup prokoag?lan aktivite g?sterirler. Bu prokoag?lan aktivite fosfotidilserin ve doku fakt?r? i?eren mikropartik?ller varl???nda daha da artmaktad?r. Kanser hastalar?nda t?m?r h?crelerinin, dola??ma spontan olarak doku fakt?r? i?eren bir?ok mikropartik?ller salg?lad??? g?sterilmi?tir (54). Bu mikropartik?ller kanser hastalar?nda damar hasar? olmaks?z?n ven?z tromboz olu?umunu tetikleyebilmektedirler.
Kanser hastalar?nda doku fakt?r? i?eren mikropartik?llerin VTE riskini art?rd??? bilinmektedir. Zwicker ve arkada?lar? VTE'si olmayan kanser hastalar?ndan doku fakt?r? i?eren mikropartik?l bulunanlarda bir y?ll?k toplam VTE insidans?n? %34.8, doku fakt?r? i?ermeyen mikropartik?l bulunanlarda VTE riskinin olmad???n? saptam??lard?r (55). Daha sonra yay?nlad?klar? Microtech ?al??mas?nda da benzer ?ekilde de dola??mda y?ksek oranda doku fakt?r? i?eren mikropartik?l bulunan ileri evre kanser hastalar?nda daha az doku fakt?r? i?eren mikropartik?l i?eren hastalara g?re VTE riskinin belirgin y?ksek oldu?unu saptam??lard?r (s?ras?yla %27.2, %7.2). Bu mikropartik?llerin prokoag?lan aktivitelerinin yan?nda t?m?r?n invazivli?ini ve agresifli?ini de art?rd??? g?sterilmi?tir (56,57).
Fosfatidilserin i?eren mikropartik?ller proteinazlar?n ba?lanmas? i?in negatif y?zey olu?turarak prokoag?lan aktiviteyi art?r?rlar ancak kanserli hastalarda yap?lan ?al??malar?n ?o?unda fosfatidilserin i?eren mikropartik?llerle ven?z tromboz aras?nda bir ili?ki kurulamam??t?r (58).
Baz? kanser t?rlerinde (akci?er, sindirim, meme, genito?riner akut promiyelositik l?semi gibi) kanser prokoag?lan? ad? verilen kalsiyum ba??ml? serin proteaz yap?s?nda maddeler bulunmu?tur. Bu maddelerin doku fakt?r?/Fakt?r VII kompleksinden ba??ms?z olarak fakt?r X'u aktive ederek koag?lasyon sistemini ana yolaktan ba?latt??? g?sterilmi?tir (59,60).
Molnar ve arkada?lar? kanser hastalar?n?n %72'sinde doku fakt?r? ve %88'inde kanser prokoag?lan seviyelerinin normal pop?lasyona g?re artm?? olarak bulmu?lard?r (59). Doku fakt?r? ve kanser prokoag?lanlar? koag?lasyondaki art??a paralel olarak t?m?r h?crelerinden fibrinolitik plazminojen aktivat?r, plazminojen aktivat?r inhibit?r 1 and 2 gibi fibrinolitik proteinlerin sekresyonunu sa?layarak fibrinolizde de bozulmalara yol a?maktad?rlar (61).
Kanser hastalar?nda doku fakt?r? d???nda fibrinojen, fakt?r V, fakt?r VIII, fakt?r IX ve fakt?r X gibi bir?ok koag?lasyon fakt?rlerinde ve trombin antitrombin, protrombin fragmanlar? 1 + 2, fibrinopeptid ve D-dimer gibi koag?lasyon aktivasyon belirte?lerinde de art?? saptanm??t?r (62,63).
Kanser hastalar?nda koag?lasyon fakt?rleri d???nda trombosit say?lar?nda art?? ve trombosit fonksiyonlar?ndaki de?i?iklikler de VTE riskini art?rmaktad?r.Trombosit say?s? 443 x 109/L'nin ?zerinde olan kanserli hastalarda bu de?erin alt?nda olanlara g?re VTE riskinin belirgin olarak artt??? g?sterilmi?tir (s?ras?yla %34.3,%5.9) (49). Kanserde trombositozun patogenezi tam ayd?nlat?lamasa da patogenezde t?m?r h?crelerinden salg?lanan IL-6, IL-1 gibi inflamatuvar sitokinlerle bir?ok mediyat?r?n maj?r rol oynad??? d???n?lmektedir. IL-6'n?n kemik ili?inden trombosit ?retimini art?ran trombopoietinin (TPO) karaci?erdeki sentezini art?rarak trombositoza yol a?t??? d???n?lmekle beraber, trombositozla TPO miktar?n?n korele olmad???n? g?steren ?al??malar bu hipotezi tart??mal? hale getirmektedir (47,64). Baz? kanser t?rlerinde paraneoplastik olarak trombositoz g?r?lebilmektedir. Farelerde t?m?r h?crelerinden salg?lanan IL-6 ya ba?l? artan TPO sentezinin paraneoplastik trombositoz olu?umunda ana mekanizma oldu?u d???n?lmektedir (64).
T?m?r h?creleri trombosit aktivasyonuna yol a?abildikleri gibi trombosit agregasyonunu da ind?kleyebilirler. Bu duruma t?m?r h?crelerinin ind?kledi?i platelet agregasyonu (TH?PA) denir. Bir?ok t?m?r h?cresi farkl? molek?ller ?zerinden bu agregasyona yol a?abilir. Bunlardan en bilineni P-selektindir (65).
P-selektinler trombositler (Weibel-palade cisimcikleri) ve endotel h?creleri (alfa gran?lleri) ?zerinde bulunan adhezyon molek?lleridir. Kanser hastalar?nda P-selektinin l?kosit ve trombositlerin kanser h?crelerine adezyonunda ?nemli rol oynad??? g?sterilmi?tir. P-selektinin dola??mda bulunan ??z?nebilir (soluable P-selektin, sPS) formunun kanserli hastalarda VTE geli?iminde ?nemli rol? bulunmaktad?r. sPS trombositlerin aktivasyonu sonucu Weibel-palade cisimciklerinden sal?nan P-selektinin proteolize u?rayarak ayr??mas? ve dola??ma sal?nmas?yla ortaya ??kar (65,66). Bu formlar kanserli hastalarda platelet aktivasyonunun g?stergesi olarak kullan?lmakla beraber artm?? sPS seviyelerinin VTE riskini belirgin art?rd??? g?sterilmi?tir. 685 kanser hastas?n?n prospektif olarak incelendi?i CATS ?al??mas?nda y?ksek sPS seviyeleri olan kanser hastalar?nda VTE riskinin normal sPS seviyeli kanser hastalar?na g?re 2.6 kat art?rd??? bulunmu? ve kanserli hastalarda VTE riskini ?ng?rmede y?ksek sPS seviyelerinin ba??ms?z bir predikt?r oldu?unu savunmu?lad?r (64). sPS'lerin kanserli hastalarda trombozun yan?nda t?m?r anjiyogenezi ve metastaz? ?zerine de etkileri bulunmaktad?r (66).
Kanser hastalar?nda uygulanan kemoterap?tik ila?lar?n da VTE patogenezinde direkt etkileri bulunmaktad?r. Kemoteropatikler ba?l?ca; direkt vask?ler endotel hasar?, platelet aktivasyonu, monosit, makrofaj ve endotel h?crelerinden doku fakt?r? ekspresyonu, fibrinolitik (Antitrombin III, Protein C, S'de azalma) ve koag?lasyon molek?llerinde de?i?iklikler (PAI-1 art??) yaparak protrombotik etki g?sterirler (67).
Kanser hastalar?nda santral veya periferik kateter yerle?tirilmesi, damar l?meninin daralmas?na ve bu alanda staz olu?umuna yol a?arak tromboz riskini art?rabilir. Ayr?ca, kateterin yerle?tirilmesi s?ras?nda meydana gelen damar endotel hasar?n?n bir sonucu olarak prokoag?lan ?r?nlerin sal?n?m? da tromboz ?zerine etki g?sterebilir.
T?m?r?n vask?ler bas?s? veya invazyonuna ba?l? olarak damar i?i kan ak?m?n?n staza u?ramas? da VTE geli?imine zemin haz?rlamaktad?r. ?zelikle hematolojik malignitelerde artan hipervizkozite de VTE patogenezinde di?er ?nemli bir basamakt?r.
PROF?LAKS? ve TEDAV?
Kanser hastalar?nda VTE'nin mortalite ?zerine olumsuz etkilerinin g?sterilmesi bu hastalarda VTE profilaksisi ve tedavisinin ?nemini art?rm??t?r. Bu hastalarda VTE tedavisinde son y?llarda yay?nlanan k?lavuzlarla belirli bir standart olu?turulsa da, antikoag?lan tedavinin ya?am kalitesi ?zerine olumsuz etkileri ve kanama riskini art?rmas? nedeniyle halen tedavi rejimleri, s?releri, tedavi komplikasyonlar?n?n y?netimiyle ilgili yeni ?al??malara ihtiya? duyulmaktad?r. Profilaksi konusunda ise VTE i?in riskli hastalar?n belirlenmesi, profilaksi uygulanacak hasta gruplar?n?n se?imi, uygulanacak profilaksi rejimi ve s?resi konusunda s?n?rl? say?da veri bulunmakta, randomize prospektif ?al??malara ihtiya? duyulmaktad?r.
PROF?LAKS?
Kanserli hastalarda VTE profilaksisini ba?l?ca ?? grup alt?nda de?erlendirmek gerekir;
a. Cerrahi uygulanan hastalar
b. Medikal tedavi uygulanan hastalar
- Yatarak takip edilen hastalar
- Ayaktan takip edilen hastalar
c. Kateter uygulanan hastalar
Cerrahi Uygulanan Hastalar
Kanser cerrahisi uygulanan hastalar, kanser d??? cerrahi uygulanan hastalara nazaran postoperatif VTE geli?imi a??s?ndan daha y?ksek riske sahip olmalar? yan?nda, bu hastalarda geli?en postoperatif VTE'ler daha mortal seyretmektedirler. Kanser cerrahisi uygulanan hastalarda postoperatif geli?en VTE'lerin b?y?k k?sm? ilk iki hafta i?erisinde geli?mekte ve postoperatif bir ay i?erisindeki ?l?mlerin yar?s?ndan VTE sorumlu tutulmaktad?r (3).
Kanser hastalar?nda cerrahi VTE profilaksilerinde s?kl?kla d???k molek?l a??rl?kl? heparin [DMAH (g?nl?k tek doz)] ve unfraksiyone heparin [UFH (g?nde ?? kez)] kullan?lmaktad?r. Yap?lan ?al??malarda bu rejimlerin g?venilirlik ve etkinlikleri a??s?ndan birbirine belirgin bir ?st?nl?k sa?lamad?klar? g?sterilmi?tir (68). UFH ve DMAH d???nda nadiren de olsa fondaparinuks profilakside kullan?lmaktad?r. Cerrahi VTE profilaksilerinin ?o?unlu?u 7-10 g?nl?k bir s?re uygulanmakla beraber riskli hasta gruplar?nda bu s?reler uzayabilmektedir.
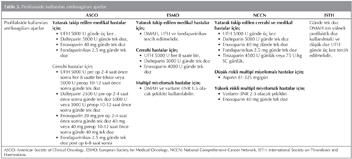
"National Comprehensive Cancer Network (NCCN)" risk fakt?r? olmayan cerrahi uygulanacak hastalarda belli bir s?re belirtmemekle beraber bu hastalar?n antikoag?lasyon i?in kontraendikasyonlar?) yoksa yatt??? s?re i?erisinde Tablo 3'te verilen profilaktik rejimlerinden birini kullan?lmas?n? ?nermektedir. VTE i?in risk fakt?rleri bulunan hastalarda ise postoperatif profilaktik tedavinin taburcu edildikten sonra d?rt haftaya kadar uzat?lmas?n? ?nermektedir (47).
"International Society on Thrombosis and Haemostasis (ISTH)" k?lavuzunda cerrahi profilakside g?nde tek doz y?ksek doz DMAH'?n preoperatif 2-12 saat ?nce ba?lanmas?n? ve postoperatif 7-10 g?n s?rd?r?lmesini ?nerilmektedir. Y?ksek VTE riski ve d???k kanama riski olan, maj?r laparatomi cerrahisi uygulanan hastalarda profilaktik tedavinin d?rt haftaya uzat?labilece?i zay?f kan?t d?zeyiyle ?nerilmektedir (69).
"American Society of Clinical Oncology (ASCO)" k?lavuzunda 30 dakikadan uzun s?ren ve antikoag?lasyon i?in kontraendikasyonu bulunmayan t?m major cerrahilerde profilaksinin preoperatif (s?re belirtilmeden) ba?lanmas?n? ve en az 7-10 g?n s?rd?r?lmesini, maj?r abdomino-pelvik cerrahi uygulananlarda, mobilitesi s?n?rlanm??larda, obezlerde, daha ?nce VTE ?yk?s? olanlarda veya daha e?lik eden risk fakt?rlerinin bulunmas? durumunda (risk fakt?rleri) bu s?renin d?rt haftaya uzat?labilece?ini ?nermektedir (70).
"European Society for Medical Oncology (ESMO)" k?lavuzunda 30 dakikadan uzun s?ren laparotomi, laporoskopi, torakoskopi ve torokotomi operasyonlar?nda profilaksinin en az 10 g?n s?rd?r?lmesini, major abdominopelvik cerrahi uygulanan hastalarda DMAH ile bu s?renin bir aya kadar uzat?lmas?n? ?nermektedir (71).
T?m k?lavuzlarda mekanik y?ntemlerin sadece farmakolojik tedavilerin kontraendike oldu?u hastalarda monoterapi olarak kullan?labilece?i belirtilmi?tir.
Medikal Tedavi Uygulanan Hastalar
Yatarak takip edilen hastalar: Herhangi bir nedenle yatarak takip edilen aktif kanserli hastalarda VTE profilaksisinin risklerini ve yararlar?n? de?erlendirmemizi sa?layacak yeterli veri yoktur. Bu konuda geni? ?l?ekli randomize ?al??malara ihtiya? duyulmaktad?r. Ancak hospitalize edilen aktif kanser hastalar?nda VTE riskinin artt??? bilinmektedir (46). G?ncel k?lavuzlar, genel olarak mobiliteyi k?s?tlayan medikal bir durum varl???nda e?er antikoag?lasyon i?in kontraendikasyon yoksa tromboprofilaksi ?nermektedir (47,71,72). Yaln?z NCCN aktif kanseri olan ve antikoag?lasyon i?in kontraendikasyonu olmayan t?m hastalarda hastanede yatt??? s?re boyunca tromboprofilaksi ?nermektedir (47).
Ayaktan takip edilen hastalar: Ayaktan takip edilen kemoterapi hastalar?nda tromboprofilaksi karar? tart??mal? bir durumdur. Bu hastalarda tromboprofilaksinin VTE riskini azaltt???n? g?steren ?al??malaryan?nda tromboprofilaksi alan hastalar?yla almayan hastalar aras?nda VTE riski y?n?nden anlaml? farkl?l?k saptamayan ?al??malarda bulunmaktad?r. PROTECHT ?al??mas?nda nadroparinin ayaktan takip edilen metastatik ve ileri evre kanser hastalar?nda tromboembolik olaylar? azaltt??? g?sterilmi?tir (72). TOPIC ?al??mas?nda ise metastatik meme kanseri ve ileri evre akci?er kanseri hastalar?nda profilaktik certoparin kullan?m?n?n VTE riskini azaltmada plaseboya ?st?nl??? g?sterilememi?tir (73).
ASCO, ESMO, ISTH ayaktan takip edilen sistemik kemoterapi alan hastalarda rutin tromboprofilaksi ?nermemektedir. Ancak ISTH ileri evre veya metastatik akci?er ve pankreas kanserlilerde d???k kanama riski olanlarda profilaksi verilebilece?ini vurgulamaktad?r (69-71).
MM hastalar i?in ASCO talidomid ve lenulomide bazl? rejimler kullanan hastalardan y?ksek riskli olanlarda DMAH ve d???k riskli olanlarda aspirin profilaksisi almas?n?, ESMO ek olarak INR 1.5 olacak ?ekilde warfarinin de kullan?labilece?ini ?nermektedir. ISTH isetalidomid/lenulomidin steroid ve di?er kemoterap?tik ajanlarla kombine rejimlerinde profilaksi ?nermekte, bu hastalarda profilakside kullan?lan warfarin, DMAH ve aspirinin VTE ?nlemede benzer etki g?sterdiklerini d???nmektedir (69-71).Uluslararas? Miyeloma ?al??ma Grubu ise bir veya birden az ki?isel risk fakt?r? i?eren hastalarda aspirin (g?nde tek doz 81-325 mg), iki veya daha fazla risk fakt?r? i?eren veya talidomid/lenulomidin y?ksek doz deksametazon ve doksorubisinle kombine rejimlerinden kullanan hastalarda DMAH ve warfarin (INR 2-3 olacak ?ekilde) profilaksisi ?nermektedir (48).
Kateter Uygulanan Hastalar
Kanser hastalar?nda vitamin K antagonistlerinin (1 mg/g?n "INR takipsiz" veya INR 1.5 olacak ?ekilde) kateterle ili?kili tromboza y?nelik profilaksi ama?l? kullan?mlar?nda semptomatik tromboz geli?imi ?zerine plaseboya bir ?st?nl??? g?sterilememi?tir. Ayn? ?ekilde DMAH'?n da profilaktik kullan?m?n?n semptomatik trombozu ?nlemede yarar? g?sterilememi?tir (74). Bu nedenlerle k?lavuzlar kateterle ili?kili tromboz olgular?nda rutin profilaksi ?nermemektedir.ISTH kateterin sa? jug?ler vene yerle?tirilmesinin daha uygun olaca??n? ?nermektedir (69,74).
G?ncel k?lavuzlar?n kanserli hastalarda VTE profilaksi ?nerileri Tablo 4'te ?zetlenmi?tir.
TEDAV?
Kanser hastalar?nda geli?en VTE'lilerde her ne kadar tedavi modaliteleri de?i?mese de bu hastalarda, tedavi esnas?nda kar??la??lan komplikasyonlar?n s?kl??? ve ciddiyeti VTE tedavi y?netimini zorla?t?rmaktad?r. ?zellikle kemoterapiye ba?l? geli?en kusma, ishal gibi dispeptik yak?nmalar oral antikoag?lanlar?n kullan?m?n? ve biyoyararlan?m?n? k?s?tlamakta, kemoterapinin karaci?er ?zerine toksik etkileri de efektik ila? doz aral???n?n ayarlanmas?n? zorla?t?rmaktad?r. DMAH ve UFH'lerin trombositopenik etkilerinin yan?nda kemoterapinin de trombosit say?lar? ve fonksiyonlar? ?zerine negatif etkileri de bu hastalarda kanama riskini art?rmaktad?r. Ayr?ca, VTE tedavisinin kanser hastalar?nda uygulanacak cerrahi ?zerine de olumsuz etkileri vard?r. Uygun antikoag?lan tedaviye ra?men tekrarlayan embolilerin s?kl??? bu hastalarda tedaviyi zorla?t?ran di?er bir etkendir.
Tedavide ama? trombos?n b?y?mesini engellemek, damar kan ak?m?n? ve rekanalizasyonunu sa?layarak uzun d?nem komplikasyonlar? azaltmak (?rn; kronik tromboembolik pulmoner hipertansiyon), ?l?mc?l ve tekrarlayan embolilerin olu?umunu ?nlemektir.
VTE tan?s? konulan hastalarda antikoag?lan tedaviye ba?lamak gerekir. Ba?lang?? tedavisi ilk 10 g?nl?k tedavi anlam?na gelir ve tedavide DMAH, UFH ve fondaparinikus kullan?labilir. Ne yaz?k ki kanser hastalar?nda do?rudan bu ajanlar aras?nda yap?lm?? kar??la?t?rmal? ?al??malar s?n?rl?d?r. Ellie ve arkada?lar? randomize kontroll? ?al??malar? i?eren meta-analizlerinde DMAH ve UFH aras?nda ve fondaparinikus ve heparin aras?nda tekrarlayan emboliler a??s?ndan fark bulamam??lard?r (75). Ancak DMAH'lar, kullan?mlar?n?n ve doz ayarlamalar?n?n kolay olmas?, laboratuvar takiplerinin gerekmemesi ve trombositopenik etkilerinin UFH heparinlere g?re daha az g?zlenmesi nedeniyle ba?lang?? tedavisinde daha ?ok tercih edilmektedirler. G?ncel k?lavuzlar her ?? ajan?n da ba?lang?? tedavisinde kullan?labilece?ini ?nerse de, ISTH ve ASCO ba?lang?? tedavisinde ?ncelikli olarak DMAH'lar?n kullan?lmas?n? ?nermektedir (69,70).
B?brek yetmezli?i olan hastalarda DMAH'lar?n (?zellikle enoksiparin) birikmi? etkilerine ba?l? maj?r kanama riski artmaktad?r. Bu nedenle kreatin klerensi < 30 mL/dk olanlarda anti-Xa d?zeyinin monit?rizasyonunun yap?lmas? ?nerilmektedir (71).
VTE tedavisinin s?resi en az 3-6 ay olmal?d?r. NCCN, PE varl???nda bu s?renin 6-12 ay aras?nda olmas? gerekti?ini ?nermektedir (47). Ancak tedavinin alt? aydan daha uzun s?rd?r?lmesi y?n?nde yeterli ?al??ma yoktur. Kanserli hastalarda uzun s?reli (alt? ay) antikoag?lan tedavilerin kar??la?t?r?lmas?nda DMAH'lar?n vitamin K antogonistleri (VKA)'ne g?re tekrarlayan VTE?leri ?nlemede daha etkili oldu?u ve maj?r kanama riskinin her iki tedavide benzer oldu?u g?sterilmi?tir (76).
K?lavuzlar uzun s?reli antikoag?lasyonda hem VTE tekrarlar? ?nlemede etkinli?i hem de VKA'lar?n etkin doz (INR 2-3) ayarlamas?nda kar??la??lan zorluklar nedeniyle DMAH tedavinin ?ncelikle tercih edilmesini ?nermektedir (47,69-71). DMAH'lar?n kullan?m?n?n uygun olmad??? durumlarda (kreatin klerensi < 30 mL/dk) VKA'lar uzun s?reli antikoag?lasyonda kullan?labilir.
Antikoag?lanlar?n kontraendike oldu?u durumlarda veya antikoag?lan tedaviye uyumda zorluk ya?anan hastalarda, uygun antikoag?lan tedaviye ra?men tekrarlayan embolileri olanlarda, birden fazla pulmoner emboli ge?iren ve kronik tromboembolik pulmoner hipertansiyon geli?mi? olanlarda vena kava filtreleri uygulanabilir (47).
Haftal?k tek doz idraparinikusun (selektif fakt?r Xa inhibit?r?) UFH ve DMAH'a g?re daha kolay kullan?m? olsa da temininde ya?an?lan zorluklar nedeniyle antikoag?lan tedavide ?nerilmemektedir. Yeni oral antikoag?lanlar da tedavi etkinli?i ?zerine yap?lm?? ?al??malar?n yetersizli?i nedeniyle hen?z antikoag?lan tedavide ?nerilmemektedir (69,70).
Antikoag?lan tedavi esnas?nda tekrarlayan tromboemboli varl???nda, hasta e?er VKA ile tedavi ediliyorsa y?ksek doz DMAH tedavisine ge?ilmeli, e?er DMAH ile tedavi ediliyorsa DMAH tedavisinin %20-25 oran?nda art?r?lmal?d?r. Bir hafta sonunda kontrollerde semptomatik iyile?me varsa uygulanan DMAH dozunda devam edilmeli, e?er semptomatik iyile?me yoksa pik anti-Xa seviyelerine bak?larak doz ayarlamas? yap?lmal?d?r (77).
Kanser hastalar?nda rastlant?sal olarak saptanan PE'liler de tedavi edilmelidir. Bu hastalarda asemptomatik olsalar dahi antikoag?lan tedavinin faydal? oldu?u g?sterilmi?tir. Sun ve arkada?lar? akci?er kanserli hastalarda, rastlant?sal saptanan PE olgular?nda antikoag?lan tedavi uygulananlarda (40 ay) uygulanmayanlara (alt? ay) g?re ortalama ya?am s?relerinin daha uzun olduklar?n? saptam??lard?r (78). O'Connell ve arkada?lar? rastlant?sal saptanan PE olgular?nda ortalama ya?am s?relerinin PE saptanmayanlara g?re daha k?sa oldu?unu saptam??lard?r (79).
Kanser hastalar?nda kateter ili?kili tromboz tedavisinde en az ?? ay antikoag?lan tedavi ?nerilmektedir.Tedavide DMAH ve VKA kullan?labilir. Tedavi esnas?nda kateterin ?ekilmesiyle ilgili standart bir yakla??m yoktur. Kateter fonksiyonelse, uygun pozisyondaysa ve infekte de?ilse ?ekilmeyebilir (74).
Santral sinir sistemi kanserlerinde ve beyin metastazlar?nda y?ksek kanama riski nedeniyle antikoag?lan tedavilerde dikkatli olunmal?d?r. Bu hastalarda vena kava filtresi uygulananlarda tekrarlayan emboliler ve ya?am s?releri ?zerine etkileri olmad??? ve intrakranial hemorajileri azaltmad??? g?sterilmi?tir. Aktif kanamas? olmayan santral sinir sistemi kanserlerinde antikoag?lan kullan?m? mutlak kontraendike de?ildir. Aktif kanama ve trombositopeni (trombosit say?s? < 50.000) veya koag?lopati varl???nda, yak?n zamanda cerrahi uygulananlarda antikoag?lasyondan ka??n?lmal?d?r (70,80).
Trombolitik tedavi endikasyonlar? kanser olmayan hastalardakilerden farl? de?ildir. Hemodinamik olarak unstabil olanlarda, a??r sa? ventrik?l disfonksiyonu olanlarda, ekstremite gangreni riski ta??yan massive iliofemoral tromb?slerde kontraendikasyon yoksa trrombolitik tedavi kullan?labilir (71). Trombolitik tedavinin kontraendike oldu?u durumlarda alternatif olarak perk?tan kateter embolektomi veya cerrahi embolektomi uygulanabilir.
G?ncel k?lavuzlar?n kanserli hastalarda VTE tedavi ?nerileri Tablo 5'te ?zetlenmi?tir.
Sonu? olarak kanserli hastalarda VTE'nin mortalite ve morbidite ?zerine ?nemli etkileri bulunmaktad?r. Bu hastalarda VTE profilaksileri ve tedavi uygulamalar?n?n ya?am s?releri ?zerine ?nemli katk?lar? bulunmaktad?r. G?n?m?zde profilaksi verilecek hastalar?n se?imi, uygulanacak tedavi rejimlerinin ve tedavi s?relerinin belirlenmesi i?in daha kapsaml? ?al??malara ihtiya? duyulmaktad?r.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Levitan N, Dowlati A, Remick SC, Tahsildar HI, Sivinski LD, Beyth R, et al. Rates of initial and recurrent thromboembolic disease among patients with malignancy versus those without malignancy. Risk analysis using Medicare claims data. Medicine (Baltimore)? 1999;78(5):285-91.
- Trousseau A. Phlegmasia alba dolens. Clin Med Hotel-Dieu Paris 1865;3:654-712.
- Agnelli G, Verso M, Management of venous thromboembolism in patients with cancer. J Throm Haemost 2011;9(Suppl 1):316-24.
- Shinagare AB, Guo M, Hatabu H, Krajewski KM, Andriole K, Van den Abbeele AD, et al. Incidence of pulmonary embolism in oncologic outpatients at a tertiary cancer center. Cancer 2011;117(16):3860-6.
- Johnson MJ, Sproule MW, Paul J. The prevalence and associated variables of deep venous thrombosis in patients with advanced cancer. Clin Oncol (R Coll Radiol) 1999;11(2):105-10.
- Chew HK, Wun T, Harvey D, Zhou H, White RH. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med 2006;166(4):458-64.
- Jones A, Stockton DL, Simpson AJ, Murchison JT. Idiopathic venous thromboembolic disease is associated with a poorer prognosis from subsequent malignancy. Br J Cancer 2009;101:840.
- Blom JW, Doggen CJ, Osanto S, Rosendaal FR. Malignancies, prothrombotic mutations, and the risk of venous thrombosis. JAMA 2005;293(6):715-22.
- Khorana AA, Francis CW, Culakova E, Lyman GH. Risk factors for chemotherapy-associated venous thromboembolism in a prospective observational study. Cancer 2005;104(12):2822-9.
- Perry JR, Julian JA, Laperriere NJ, Geerts W, Agnelli G, Rogers LR, et al. PRODIGE: a randomized placebo-controlled trial of dalteparin low molecular weight heparin (LMWH) thromboprophylaxis in patients with newly diagnosed malignant glioma. J Thromb Haemost 2010;8(9):1959-65.
- Srkalovic G, Cameron MG, Rybicki L, Deitcher SR, KAttke-MArchant K, Hussein MA. Monoclonal gammopathy of undetermined significance and multiple myeloma are associated with an increased incidence of venothromboembolic disease. Cancer 2004;101(3):558-66.
- Otten HM, Mathijssen J, ten Cate H, Soesan M, Inghels M, Richel DJ, et al. Symptomatic venous thromboembolism in cancer patients treated with chemotherapy, an underestimated phenomenon. Arch Intern Med 2004;164:190-4.
- Cheruku R, Tapazoglou E, Ensley J, Kish JA, Cummings GD, al-Sarraf M. The incidence and significance of thromboembolic complications in patients with high-grade gliomas. Cancer 1991;68:2621-4.
- Clahsen PC, van de Velde CJ, Julien JP, Floiras JL, Mignolet FY. Thromboembolic complications after perioperative chemotherapy in women with early breast cancer: a European Organization for Research and Treatment of Cancer Breast Cancer Cooperative Group study. J Clin Oncol 1994;12(6):1266-71.
- Prandoni P, Piccioli A. Venous thromboembolism and cancer: A two-way clinical association Frontiers in Bioscience 1997;2:12-21.
- Rogers JS II, Murgo AJ, Fontana JA, Raich PC. Chemotherapy for breast cancer decreases plasma protein C and protein S. J Clin Oncol 1988;6:276-81.
- Rella C, Coviello M, Giotta F, Maiello E, Colavito D, Colangelo D, et al. A prothrombotic state in breast cancer patients treated with adjuvant chemotherapy. Breast Cancer Res Treat 1996;40(2):151-9.
- Levine MN, Gent M, Hirsh J, Arnoid A, Goodyear MD, Hrynuik W, et al. The thrombogenic effect of anticancer drug therapy in women with stage II breast cancer. N Engl J Med 1988;318:404-7.
- Demirkan B, Ozcan MA, Glu AA, Y?ksel F, Undar B, Alakavuklar M. The effect of anthracycline-based (Epirubicin) adjuvant chemotherapy on plasma TAFI and PAI-1 levels in operable breast cancer. Clin Appl Thromb. Hemost 2006;12(1):9-14.
- Fisher B, Dignam J, Wolmark N, DeCillis A, Emir B, Wickerham DL, et al. Tamoxifen and chemotherapy for lymph node-negative, estrogen receptor positive breast cancer. J Natl. Cancer Inst 1997;89:1673-82.
- Pritchard KI, Paterson AH, Paul NA, Zee B, Pater J. Increased thromboembolic complications with concurrent tamoxifen and chemotherapy in a randomized trial of adjuvant therapy for women with breast cancer. National Cancer Institute of Canada Clinical Trials Group Breast Cancer Site Group. J Clin Oncol 1996;14(10):2731-7.
- Kato A, Takano H, Ichikawa A, Koshino M, Igararshi A, Hattori K, et al. Retrospective cohort study of venous thromboembolism (VTE) in 1035 Japanese myeloma patients treated with thalidomide; lower incidence without statistically significant association between specific risk factors and development of VTE and effects of thromboprophylaxis with aspirin and warfarin. Thromb Res 2013;131(2):140-4.
- Palumbo A, Rajkumar SV, Dimopoulos MA, Richardson PG, San Miguel J, Barlogie B, et al. Prevention of thalidomide and lenalidomide-associated thrombosis in myeloma. Leukemia 2008;22:414-23.
- El Accaoui RN, Shamseddeen WA, Taher AT. Thalidomide and thrombosis - A meta-analysis. Thromb Haemost 2007;97(6):1031-6.
- Wang M, Dimopoulos MA, Chen C, Cibeira MT, Attal M, Spencer A, et al; Lenalidomide plus dexamethasone is more effective than dexamethasone alone in patients with relapsed or refractory multiple myeloma regardless of prior thalidomide exposure. Blood 2008;112(12):4445-51.
- Alexander M, Teoh KC, Lingaratnam S, Kirsa S, Mellor JD. Thromboprophylaxis prescribing and thrombotic event rates in multiple myeloma patients treated with lenalidomide or thalidomide at a specialist cancer hospital. Asia Pac J Clin Oncol 2013;9(2):169-75.
- Moore RA, Adel N, Riedel E, Bhutani M, Feldman DR, Tabbara NE, et al. High incidence of thromboembolic events in patients treated with cisplatin-based chemotherapy: A large retrospective analysis. J Clin Oncol 2011;29(25):3466-73.
- Seng S, Liu Z, Chiu SK, Proverbs-Singh T, Sonpavde G, Choueiri TK, et al. Risk of venous thromboembolism in patients with cancer treated with Cisplatin: a systematic review and meta-analysis. J Clin Oncol 2012;30(35):4416-26.
- Nalluri SR, Chu D, Keresztes R, Zhu X, Wu S. Risk of venous thromboembolism with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis. JAMA. 2008;300(19):2277-85.
- Ranpura V, Hapani S, Chuang J, Wu S. Risk of cardiac ischemia and arterial thromboembolic events with the angiogenesis inhibitor bevacizumab in cancer patients: a meta-analysis of randomized controlled trials. Acta Oncol 2010;49(3):287-9728.
- Bennett CL, Spiegel DM, Macdougall IC, Norris L, Qureshi ZP, Sartor O, et al. A review of safety, efficacy, and utilization of erythropoietin, darbepoetin, and peginesatide for patients with cancer or chronic kidney disease: A report from the southern network on adverse reactions (SONAR).Semin Thromb Hemost 2012;38(8):783-96.
- Tonia T, Mettler A, Robert N, Schwarzer G, Seidenfeld J, Weingart O, et al. Erythropoietin or darbepoetin for patients with cancer. Cochrane Database Syst Rev 2012;12:CD003407
- Truelove E, Fielding AK, Hunt BJ. The coagulopathy and thrombotic risk associated with L-asparaginase treatment in adults with acute lymphoblastic leukaemia. Leukemia 2013;27(3):553-9.
- Dubashi B, Jain A. L-Asparginase induced cortical venous thrombosis in a patient with acute leukemia. J Pharmacol Pharmacother 2012;3(2):194-5.
- Guzm?n-Uribe P, Rosas-L?pez A, Zepeda-Le?n J, Crespo-Sol?s E. Incidence of thrombosis in adults with acute leukemia: a single center experience in Mexico. Rev Invest Clin 2013;65(2):130-40.
- Hammond J, Kozma C, Hart JC, Nigam S, Daskiran M, Paris A, et al. Rates of venous thromboembolism among patients with major surgery for cancer. Ann Surg Oncol 2011;18:3240-7.
- Agnelli G, Bolis G, Capussotti L, Scarpa RM, Tonelli F, Bonizzoni E, et al. A clinical outcome-based prospective study on venous thromboembolism after cancer surgery the @RISTOS project. Ann Surg 2006;243(1):89-95.
- Christensen TD, Vad H, Pedersen S, Hvas AM, Wotton R, Naidu B, et al. Venous thromboembolism in patients undergoing operations for lung cancer: a systematic review. Ann Thorac Surg 2014;97:394-400.
- Hennessey P, Semenov YR, Gourin CG. The effect of deep venous thrombosis on short-term outcomes and cost of care after head and neck cancer surgery. Laryngoscope 2012;122(10):2199-204.
- Lee AY, Levine MN, Butler G, Webb C, Costantini L, Gu C, et al. Incidence, risk factors, and outcomes of catheter-related thrombosis in adult patients with cancer. J Clin Oncol 2006;24:1404-8.
- Verso M, Agnelli G, Bertoglio S, Di Somma FC, Paoletti F, Ageno W, et al. Enoxaparin for the prevention of venous thromboembolism associated with central vein catheter: a doubleblind, placebo-controlled, randomized study in cancer patients. J Clin Oncol 2005;23:4057-62.
- Verso M, Agnelli G. Venous thromboembolism associated with long-term use of central venous catheters in cancer patients. J Clin Oncol 2003;21(19):3665-75.
- Gaddh M, Antun A, Yamada K, Gupta P, Tran H, El Rassi F, et al Venous access catheter-related thrombosis in patients with cancer. Leuk Lymphoma 2014;55(3):501-8.
- Saber W, Moua T, Williams EC, Verso M, Agnelli G, Couban S, et al. Risk factors for catheter-related thrombosis (CRT) in cancer patients: a patient-level data (IPD) meta-analysis of clinical trials and prospective studies. J Thromb Haemost 2011;9:312-9.
- Kuter DJ. Thrombotic complications of central venous catheters in cancer patients. Oncologist 2004;9(2):207-16.
- Khorana AA, Francis CW, Culakova E, Kuderer NM, Lyman GH. Frequency, risk factors, and trends for venous thromboembolism among hospitalized cancer patients. Cancer 2007;110(10):2339-46.
- Streiff MB, Bockenstedt PL, Cataland SR, Chesney C, Eby C, Fanikos J, et al Venous thromboembolic disease. J Natl Compr Canc Netw 2011;9:714-77.
- Palumbo A, Rajkumar SV, Dimopoulos MA, Richardson PG, San Miguel J, Barlogie B, et al. Prevention of thalidomide-and lenalidomide-associated thrombosis in myeloma. Leukemia 2008;22:414-23.
- Simanek R, Vormittag R, Ay G, Alguel G, Dunkler D, Schwarzinger I, et al. High platelet count associated with venous thromboembolism in cancer patients: results from the Vienna Cancer and Thrombosis Study (CATS). J Thromb Haemost 2010;8(1):114-20.
- Ay C, Dunkler D, Marosi C, Chiriac AL, Vormittag R, Simanek R, et al. Prediction of venous thromboembolism in cancer patients. Blood 2010;116(24)5377-82.
- Miller GJ, Bauer KA, Howarth DJ, Cooper JA, Humphries SE, Rosenberg RD. Increased incidence of neoplasia of the digestive tract in men with persistent activation of the coagulant pathway. J Thromb Haemost 2004;2:2107-14.
- Welsh J, Smith JD, Yates KR, Greenman J, Maravevas A, Madden LA. Tissue factor expression determines tumour cell coagulation kinetics. Int J Lab Hematol, 2012;34(4):396-402.
- Kasthuri RS, Taubman MB, Mackman N. Role of tissue factor in cancer. J Clin Oncol 2009;27(29):4834-8.
- Davila M, Amirkhosravi A, Coll E, Desai H, Robles L, Colon J, et al. Tissue factor-bearing microparticles derived from tumor cells: impact on coagulation activation. J Thromb Haemost 2008;6:1517-24.
- Zwicker JI, Liebman HA, Neuberg D, Lacroix R, Bauer KA, Furie BC, et al. Tumor-derived tissue factor-bearing microparticles are associated with venous thromboembolic events in malignancy. Clin Cancer Res 2009;15:6830-40.
- Zwicker JI, Liebman HA, Bauer KA, Caughey T, Campigotto F, Rosovsky R, et al. Prediction and prevention of thromboembolic events with enoxaparin in cancer patients with elevated tissue factor-bearing microparticles: a randomized-controlled phase II trial (the Microtec study). Br J Haematol 2013;160(4):530-7.
- Zhang X, Yu H, Lou JR, Zheng J, Zhu H, Popescu NI, et al. MicroRNA-19 (miR-19) regulates tissue factor expression in breast cancer cells. J Biol Chem 2011;286:1429-35.
- Rautou PE, Mackman N. Microvesicles as risk markers for venous thrombosis. Expert Rev Hematol 2013;6(1):91-101.
- Molnar S, Guglielmone H, Lavarda M, Rizzi ML, Jarchum G. Procoagulant factors in patients with cancer. Hematology 2007;12(6):555-9.
- Falanga A, Lacoviello L, Evangelista V, Belotti D, Consonni R, D'Orazio A, et al. Loss of blast cell procoagulant activity and improvement of hemostatic variables in patients with acute promyelocytic leukemia administered all-trans-retinoic acid. Blood 1995;86:1072-81.
- Prandoni P, Lensing AW, Piccioli A, Bernardi E, Simioni P, Girolami B, et al; Recurrent venous thromboembolism and bleeding complications during anticoagulant treatment in patients with cancer and venous thrombosis. Blood 2002;100:3484-8.
- Zwicker JI, Furie BC, Furie B. Cancer-associated thrombosis. Crit Rev Oncol Hematol 2007;62:126-36.
- Hoffman R, Haim N, Brenner B. Cancer and thrombosis revisited. Blood Rev 2001;15:61-7.
- Sood A, Stone RL, Afshar-Kharghan V. Causes and consequences of cancer-associated thrombocytosis. Blood 2013;122(21):SCI-33.
- Riedl J, Pabinger I, Ay C. Platelets in cancer and thrombosis.Hamostaseologie 2014;34(1):54-62.
- Chen M, Geng JG. P-selectin mediates adhesion of leukocytes, platelets, and cancer cells in inflammation, thrombosis, and cancer growth and metastasis. Arch Immunol Ther Exp (Warsz) 2006;54:75-84.
- Haddad TC, Greeno EW. Chemotherapy-induced thrombosis. Thromb Res 2006;118(5):555-68.
- Mismetti P, Laporte S, Darmon JY, Buchm?ller A, Decousus H. Meta-analysis of low molecular weight heparin in the prevention of venous thromboembolism in general surgery.Br J Surg 2001;88(7):913-30.
- Farge D, Debourdeau P, Beckers M, Baglin C, Bauersachs RM, Brenner B, et al. International clinical practice guidelines for the treatment and prophylaxis of venous thromboembolism in patients with cancer. J Thromb Haemost 2013;11(1):56-70.
- Lyman GH, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, Balaban EP, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology Clinical Practice Guideline update. J Clin Oncol 2013;31(17):2189-204.
- Mandal? M, Falanga A, Roila F; ESMO Guidelines Working Group. Management of venous thromboembolism (VTE) in cancer patients: ESMO Clinical Practice Guidelines. Ann Oncol 2011;22(Suppl 6):vi85-92.
- Agnelli G, Gussoni G, Bianchini C, Verso M, Mandal? M, Cavanna L, et al. Nadroparin for the prevention of thromboembolic events in ambulatory patients with metastatic or locally advanced solid cancer receiving chemotherapy: a randomised, placebo-controlled, double-blind study. Lancet Oncol 2009;10(10):943-9.
- Haas SK, Freund M, Heigener D, Heilmann L, Kemkes-Matthes B, von Tempelhoff GF, et al. Low-molecular-weight heparin versus placebo for the prevention of venous thromboembolism in metastatic breast cancer or stage III/IV lung cancer. Clin Appl Thromb Hemost 2012;18(2):159-65.
- Debourdeau P, Farge D, Beckers M, Baglin C, Bauersachs RM, Brenner B, et al. International clinical practice guidelines for the treatment and prophylaxis of thrombosis associated with central venous catheters in patients with cancer. J Thromb Haemost 2013;11:71-80.
- Akl EA, Labedi N, Barba M, Terranato I, Sperati F, Muti P, et al. Anticoagulation for the long-term treatment of venous thromboembolism in patients with cancer. Cochrane Database Syst Rev 2011;15(6):CD006650.
- Lee AY, Levine MN, Baker RI, Bowden C, Kakkar AK, Prins M, et al. Low-molecular-weight heparin versus a coumarin for the prevention of recurrent venous thromboembolism in patients with cancer. N Engl J Med 2003;349:146-53.
- Lee AA, Peterson EA. Treatment of cancer-associated thrombosis Blood 2013;122(14):2310-7.
- Sun JM, Kim TS, Lee J, Park YH, Ahn JS, Kim H, et al. Unsuspected pulmonary emboli in lung cancer patients: the impact on survival and the significance of anticoagulation therapy. Lung Cancer 2010;69:330-6.
- O'Connell C, Razavi P, Ghalichi M, Boyle S, Vasan S, Mark L, et al. Unsuspected pulmonary emboli adversely impact survival in patients with cancer undergoing routine staging multi-row dedector computed tomography scanning. J Thromb Haemost 2011;9:305-11.
- Lyman GH, Khorana AA, Falanga A, Clarke-Pearson D, Flowers C, Jahanzeb M,? et al. American society of clinical oncology guideline: recommendations for venous thromboembolism prophylaxis and treatment in patients with cancer. J Clin Oncol 2007;25:5490-5.
Yaz??ma Adresi (Address for Correspondence)
Dr. O?uzhan OKUTAN
Gata ?aml?ca G???s Hastal?klar? Hastanesi,?
Ac?badem, ?STANBUL - TURKEY
e-mail: oguzhanokutan@gmail.com