REVIEW
Doi: 10.5578/tt.8317
Tuberk Toraks 2014;62(3):215-230

Toraks dif?zyon manyetik rezonans g?r?nt?leme
Adem KARAMAN1, Mustafa KAHRAMAN2, Erol BOZDO?AN3, Fatih ALPER4, Metin AKG?N5
1 Atat?rk ?niversitesi T?p Fak?ltesi, Radyoloji Anabilim Dal?, Erzurum, T?rkiye
1 Department of Radiology, Faculty of Medicine, Ataturk University, Erzurum, Turkey
2 Erzurum B?lge E?itim ve Ara?t?rma Hastanesi, Radyoloji B?l?m?, Erzurum, T?rkiye
2 Department of Radiology, Erzurum Regional Training and Research Hospital, Erzurum, Turkey
3 ?zel Sevgi Can Hastanesi, Radyoloji B?l?m?, Adana, T?rkiye
3 Department of Radiology, Private Sevgi Can Hospital, Adana, Turkey
4 Atat?rk ?niversitesi T?p Fak?ltesi, Aziziye Ara?t?rma Hastanesi, Radyoloji B?l?m?, Erzurum, T?rkiye
4 Department of Radiology, Faculty of Medicine, Ataturk University, Aziziye Research Hospital, Erzurum, Turkey
5 Atat?rk ?niversitesi T?p Fak?ltesi, Aziziye Ara?t?rma Hastanesi, G???s Hastal?klar? B?l?m?, Erzurum, T?rkiye
5 Department of Chest Diseases, Faculty of Medicine, Ataturk University, Aziziye Research Hospital, Erzurum, Turkey
?ZET
Toraks dif?zyon manyetik rezonans g?r?nt?leme
Toraksta manyetik rezonans g?r?nt?leme (MRG) ile sadece morfolojik de?erlendirme yapabilmekteyken art?k g?n?m?zde dif?zyon a??rl?kl? g?r?nt?leme gibi fonksiyonel incelemeleri de kullanabilmekteyiz. Hareketi azalt?c? yaz?l?mlar, ?oklu kanal kullan?m?, paralel g?r?nt?leme ve h?zl? sekanslar gibi yeni teknolojiler sayesinde toraksta art?k doyurucu kalitede g?r?nt?ler al?nmaktad?r. Son y?llarda ?ok say?da toraks MRG ?al??malar?nda umut verici sonu?lar yay?nlanm??t?r. Radyasyon i?ermedi?i i?in baz? endikasyonlar da bilgisayarl? tomografinin alternatifi olabilece?i g?r?lmektedir. Bu derlemede dif?zyon MR incelemenin akci?er ve mediasten patolojilerinde hangi durumlarda nas?l uyguland???yla ilgili yap?lan g?ncel ?al??malar? g?zden ge?irdik ve toraks patolojilerinin tan?mlanmas?nda, karakterizasyonunda ne t?r bilgiler sa?lad???n? ortaya koymaya ?al??t?k.
Anahtar kelimeler: Dif?zyon MRG, toraks, nod?l, kanser
SUMMARY
Diffusion magnetic resonance imaging of thorax
Although magnetic resonance imaging (MRI) of Thorax is only useful for morphological evaluation, currently we can use it for functional evaluation such as diffusion weighted imaging. Currently, we can obtain higher quality images because of new technologies such as software that decrease motion artefact, use of multi-channel, parallel imaging and fast sequences. Many promising results of thorax MRI have been published. It may also be an alternative to thorax computed tomography in some indications without radiation exposure risk. In this review, we evaluated current literature on use of DWI MRI examination on the pathologies of lungs and mediastinum and aimed to present what kind of information is provided on recognition and characterization of thoracic pathologies.
Key words: Diffusion MRI, thorax, nodule, cancer
G?R??
Manyetik rezonans g?r?nt?lemenin (MRG) toraksta kullan?m? son y?llarda giderek artmaktad?r. Toraksta solunum-kalp hareketleri, vask?ler at?mlar, hava ve dokulardaki aray?zlerden kaynaklanan duyarl?l?k artefaktlar? ile akci?erlerdeki d???k yo?unluktan kaynaklanan d???k proton miktar? MRG kullan?m?nda ?nemli k?s?tlay?c?lard?r. ?nceleri toraksta sadece morfolojik de?erlendirme yap?labilirken, teknolojinin geli?mesi sonucu, dif?zyon a??rl?kl? g?r?nt?leme (DAG), perf?zyon a??rl?kl? g?r?nt?leme, hareketli sine MRG ve ventilasyon-perf?zyon gibi fonksiyonel g?r?nt?leme y?ntemleri rutin kullan?ma girmeye ba?lam??t?r. Radyasyon riski olmad??? i?in MRG ile ayn? hastaya ?ok say?da tetkik yap?labilmekte, takipte bilgisayarl? tomografiye (BT) alternatif olabilecek bilgi verebilmektedir. Bu y?zden toraksta MR kullan?m?n?n giderek yayg?nla?t??? g?r?lmektedir.
Toraks patolojilerine y?nelik g?ncel tan? rehberlerindeki algoritmalarda yayg?n olarak direkt grafi, BT ve pozitron emisyon tomografisi (PET)/BT bulunmaktad?r (1,2). MRG'de hareket artefakt?n? engelleyici yaz?l?mlar, ?oklu kanal kullan?m?, paralel g?r?nt?leme ve h?zl? sekanslar gibi yeni teknolojiler sayesinde toraksta art?k istenilen kalitede g?r?nt?ler al?nabilmektedir. Son y?llarda yap?lan toraks MR ?al??malar? ilerleyen zamanlarda MR'?n toraks patolojilerinin tan? rehberlerindeki yerinin ve ?neminin daha da artaca??n? g?stermektedir.
Toraksta rutin olarak al?nan T1, T2, "Short Time Inversion Recovery (STIR)", "Steady State Gradient Echo" sekanslar? ve kontrastl? seriler morfolojik a??dan ?nemli bilgiler vermektedir. Ancak bulgular?n ?o?unlukla nonspesifik olmas? ve morfolojik bilgi d?zeyinde kalmas? nedeniyle ilave sekanslara ihtiya? duyulmaktad?r. Fonksiyonel de?erlendirme olana?? veren DAG ?zellikle akci?erin primer ve metastatik t?m?ral patolojileri ile lenf nodlar?n?n de?erlendirilmesine tan?sal a??dan ?nemli role sahiptir. Bu derlemede dif?zyon MRG'de akci?er, mediasten ve g???s duvar? patolojilerindeki kullan?m alan? ile ilgili yap?lan g?ncel ?al??malar? g?zden ge?irmeyi, toraks patolojilerinin tan?mlanmas?nda ve karakterizasyonundaki rol?n? ortaya koymaya ?al??t?k.
D?F?ZYON A?IRLIKLI G?R?NT?LEMEN?N PRENS?PLER?
Dif?zyon olarak kastedilen durum, su molek?llerinin termal enerjiyle doku i?erisindeki rastgele mikroskobik hareketidir. DAG ise h?crenin mikro yap?s?nda bilgi elde etmeye yard?mc? olan fonksiyonel MRG tekni?idir. Dif?zyon a??rl?kl? g?r?nt? elde etmek i?in en s?k ya? bask?lamal? "single shot spin-echo (SE)" ve "echo-planar" sekanslar? uygulanmaktad?r. DAG'da b olarak isimlendirilen bir de?er kullan?lmaktad?r. Bu de?er artt?k?a dif?zyon de?eri de belirli bir seviyeye kadar artmaktad?r. ?l??mler, ilk ?nce b= 0 sn/mm2 ve sonra incelenecek b de?erleri olarak uygulan?r, "b" de?erinin de?i?mesi ise dif?zyonun incelemedeki a??rl???n? de?i?tirecektir. DAG'da ?o?u ara?t?rmac? genellikle b de?eri olarak (s/mm2) 0 ve 1000 kullanm??t?r. Ancak baz? ara?t?rmac?lar da 0/300/600, 50/400 ve 68/577 de?erlerini kullanm??t?r (3-5). Biz toraks ?al??malar?nda b= 0, 500, 1000 veya b= 50, 800 de?erlerini kullanmaktay?z. "Apparent diffusion coefficient (ADC)" haritalar? ise dif?zyon incelemede bizlere say?sal de?erler verebilmektedir (6).
Dif?zyon a??rl?kl? g?r?nt?lerde g?r?nt?n?n yo?unlu?u molek?llerin dif?zyon kabiliyetleriyle artmakta veya azalmaktad?r (7). Bu hareket normal ve patolojik dokular aras?nda farkl?l?k g?sterir. Y?ksek ADC de?erleri, yani dif?zyonun normal veya artt??? durumlar, sa?l?kl? dokularda ya da benin patolojilerde g?r?l?r. Bu lezyonlarda geni? ekstrasel?ler alanlar ve h?cre yo?unlu?unda azalma vard?r. Bunun tam tersi olarak dif?zyonun k?s?tlanmas? yani d???k ADC de?erleri, hipersel?lariteyi, sitotoksik ?demi veya yo?unla?m?? i?eri?i (hemoraji veya protein) g?sterir. Malin h?crelerde ?ekirdek/sitoplazma oran?n?n geni? h?cre ?ekirdekleri nedeniyle art?? g?stermesi, olu?an h?cre say?s?ndaki art??, makromolek?llerin kanser h?crelerindeki art??? ve h?creler aras? mesafenin azalmas? gibi nedenlerden dolay? suyun hareket alan? daralmakta ve dif?zyonu k?s?tlanmaktad?r. Buna ba?l? olarak ADC de?erlerinde d???? saptanmaktad?r. Bu ?zelli?i nedeniyle DAG, malin-benin hastal?k ay?r?c? tan?s?nda kullan?lmaktad?r. Ancak malin hastalarda nekroz nedeniyle dif?zyonda yan?lt?c? istenmeyen bir art??a neden olmakta veya malin olmayan hemorajik bir lezyonda? dif?zyon k?s?tl?l??? nedeniyle DAG'da beklenmeyen yan?lt?c? sonu?lar olu?abilmektedir.
Dif?zyon MRG'de ?ok g??l? manyetik gradientler e?li?inde milisaniyeler i?erisinde g?r?nt? olu?turabilen sekanslar kullanarak su molek?llerinin hareketlerini g?r?nt?lemek m?mk?n olmaktad?r. Toraksta DAG kullan?m?n?n en ?nemli handikap? solunum ve kalp hareketleri sonucu olu?an artefaktlard?r. Ancak son y?llarda kardiyak ve solunumsal tetiklemeli ?ekimler ve h?zl? ?ekim sekanslar?n?n kullan?m? bu durumun k?smen ?n?ne ge?ilmi?tir. ?zellikle yeni MRG cihazlar?nda hareketi giderici yaz?l?mlar geli?tirilmi? olup, hem fonksiyonel incelemeler hem de kontrast sonras? yap?lan e?risel ?l??mler daha hassas hale getirilmi?tir. G?r?nt?ler toraksta ?oklu nefes tutmayla elde edilir (3-4 x 20 s). E?er hasta nefes tutam?yorsa nefes tutmaks?z?n solunumsal tetikleme uygulanabilir ancak bu durum ?ekim s?resini 4-5 dakika uzat?r. Bu sekansta geometrik ??z?n?rl?k az oldu?u i?in g?r?nt? kalitesi rutin sekanslardan daha d???kt?r. Manyetik rezonans protokol se?iminde DAG, toraks kitlelerinin de?erlendirilmesinde (yakla??k 20 dk) ve kitlenin vask?ler invazyonunun ara?t?r?lmas?nda (yakla??k 25 dk) incelemeye dahil edilmelidir (8). Baz? ara?t?rmac?lar ise DAG'da sekans olarak STIR-EPI veya "split acquisition of fast spin-echo signals for diffusion imaging (SPLICE)" sekans?n? kullanm??lard?r.
Dif?zyonda 1.5 ve ?zeri tesla MRG'lerde ba?ar?l? sonu?lar al?nabilmektedir ?ekim s?ras?nda olu?abilecek hareket artefaktlar?n? engellemek amac?yla EKG problar? kullan?larak ?ekim yap?labilmektedir. ?nce MRG'de t?m toraks ve ?st bat?n? i?erecek tarzda aksiyel d?zlemde T2-trueFISP g?r?nt?ler (TR: 10.2 ms, TE: 4.7 ms) al?narak incelenecek b?lge lokalize edilmektedir. Rutin konvansiyonel sekanslar aksiyel (T1, T2, STIR) elde olunmaktad?r. Sonras?nda b 50, 800 sekanslar? al?n?r. Toplam tetkik s?resi yakla??k 20 dakika olarak ayarlanmaktad?r. DAG'da (TR: 4100 msn, TE: 81 msn, matriks: 195 x 156 ve kesit kal?nl???= 8 mm, kesit bo?lu?u= 2 mm) her bir kesit i?in 50 mm2/sn ve 800 mm2/sn olan b de?erleri kullan?lmaktad?r. De?erler de?i?ken olup b 1000 de?eri de kullan?labilir.
Filmleri de?erlendirme a?amas?nda ?ncelikle konvansiyonel T1, T2 ve STIR a??rl?kl? g?r?nt?lerde lezyonun sinyal ?zellikleri, kenar yap?s?, kom?u dokularla olan ili?kileri ve varsa invazyonlar? de?erlendirilir. Standart g?r?nt?lerle de?erlendirmenin ard?ndan y?ksek b de?erleri (800/1000) ve ADC haritalar? incelenir. De?erlendirme, sadece g?rsel kalitatif olabilece?i gibi ADC haritalar?nda ilgi alan? "region of interest (ROI)" ?l??mleri kullan?larak kantitatif de yap?labilir. Dif?zyonda k?s?tl?l?k oldu?unu s?yleyebilmek i?in b 1000'de parlakl?k yani hiperintensite ve ADC'de ise kararma yani hipointensite tesbit edilmi? olmal?d?r. Tam tersi durumda ise serbest dif?zyon veya dif?zyonda art??tan bahsedilmelidir. Lezyonlara yerle?tirilmi? ROI, e?er lezyon homojenite g?steriyorsa sadece bir alandan, heterojen davran?? g?steriyor ise muhtelif b?lgelerden birka? defa ?rnekleme yap?larak de?erlendirilmelidir. Yakla??k ROI vol?mleri 0.2-4 cm2 aral???nda olmaktad?r. ?l??mlerde standart ROI kullan?labilece?i gibi kas veya spinal kord ?l??mleri g?z ?n?ne al?narak r?latif ROI da kullan?labilir (3-5,9-12). R?latif ROI kullan?lmas?n?n ba?l?ca nedeni her hastan?n ?ekiminde manyetik alan?n ayn? homojeniteyi g?stermemesi ve ayn? hastada farkl? zamanlarda yap?lan ?ekimlerde doku intensitelerinin sabit olmamas?d?r. Bu nedenle dif?zyon MR de?erlendirmede r?latif ROI de?erlerinin daha anlaml? oldu?u kabul edilmektedir.
KL?N?K KULLANIM ALANLARI
Akci?er Lezyonlar?
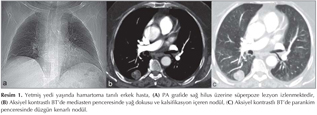
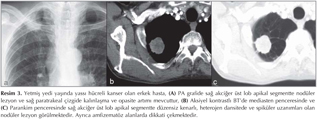
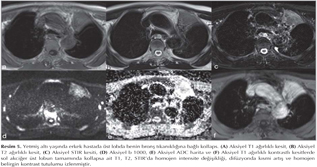
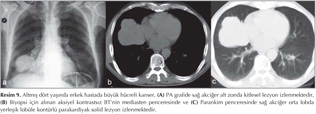
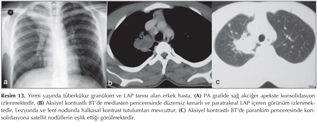
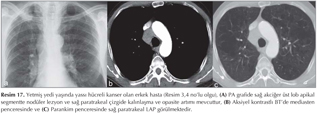
Pulmoner nod?ller: G?ncel klinik uygulamalarda pulmoner nod?l tan? ve takibinde genellikle BT kullan?lmaktad?r (1,2). BT tetkikiyle yap?lan k?sa aral?kl? takipler hastan?n maruz kald??? X ???n? miktar?n? art?rmakta ve ?zellikle kad?n hastalarda radyasyona ba?l? risk art???na neden olmaktad?r (Resim 1,2). Bu durum pulmoner nod?l?n tan? ve takibinde yeni aray??lara gereksinim duyulmas?na neden olmu?tur. Konvansiyonel MR sekanslar? ve STIR ile yap?lan ?al??malar pulmoner nod?l tespitinde ?ok iyi sonu?lar vermi?tir (13). Multidedekt?r bilgisayarl? tomografi (MDBT) ile kar??la?t?rmal? bir ?al??mada ise 3 mm'den b?y?k nod?llerde MR'?n STIR sekans?n?n duyarl?l???n?n daha fazla oldu?u g?sterilmi?tir (14). Malin lezyonlarda h?cresel art??, dokunun daha d?zensiz hale gelmesi ve ekstrasel?ler bo?luktaki tortiozite art??? nedeniyle interstisyel suyun dif?zyonu k?s?tlanmaktad?r (Resim 3,4).
Pulmoner nod?llerin karakterizasyonunda PET yararl? olmas?na ra?men ?zellikle adenokarsinomlarda s?n?rl? rol? bulunmakta, inflamatuvar patolojilerde ise yalanc? pozitif sonu?lar vermektedir (15). Dinamik kontrastl? MR, nod?llerin benin ve malin ayr?m?nda MDBT ve PET/BT'den daha iyi ?zg?ll?k ve do?ruluk oranlar?na sahiptir (16). Fakat dinamik kontrastl? MR incelemelerinde de baz? inflamatuvar patolojilerin malin nod?ller gibi erken evre kontrast tutulumu g?stermesi tan?sal a??dan problem olu?turmaktad?r (17).
Pulmoner nod?llerin DAG ile de?erlendirip ve MDBT ile kar??la?t?rd??? bir ?al??mada DAG g?r?nt?lerin duyarl?l???n?n 5 mm'den k???k nod?llerde %43.8; 6-9 mm boyutundaki nod?llerde %86,4; 10 mm ve ?zeri nod?llerde ise %97.0 oldu?u tespit edilmi?tir (8). Sonu? olarak bu ?al??mada DAG'?n 6 mm'den b?y?k nod?llerin tespitinde %86.4 duyarl?l??a sahip oldu?u ve MDBT'nin yanl?? pozitif sonu?lar?n? azaltabilece?i ?ng?r?lm??t?r. Asl?nda bu ?al??mada DAG'?n fonksiyonel ?zelli?inden ziyade morfolojik ?zelli?i kullan?lm??t?r (18). K???k h?creli d??? akci?er kanserli (KHDAK) hastalarda t?m v?cut DAG MR ile yap?lan ba?ka bir ?al??mada ise DAG'?n 10 mm'den k???k 5 pulmoner metastaz?n 3'?nde negatif oldu?u g?r?lm??t?r (19). Pulmoner adenokarsinomun tespitinde STIR sekans?n?n DAG'dan daha hassas oldu?u bir ?al??mada g?sterilmi?tir (17). Nod?l?n ?ap? ve g?r?nt? kalitesi artt?k?a DAG'?n duyarl?l??? da artmaktad?r.
Cerrahi ?ncesi 58 hastada, 58 malin ve 18 benin nod?l hem 1.5 ve 3 Tesla MR ile hem de PET ile de?erlendirilmi?, her 3 tetkikin de benin malin ayr?m?nda benzer duyarl?l?k ve ?zg?ll??e sahip oldu?u g?r?lm??t?r (18). Bu ?al??mada kullan?lan 1.5 ve 3 T MR ile al?nan DAG'?n malin nod?llerin de?erlendirilmesinde e?it derecede faydal? oldu?u g?r?lm??t?r (20). Pulmoner metastaz?n tespitine y?nelik olarak t?m v?cut DAG ve PET/BT ile yap?lan di?er ?al??malarda da benzer sonu?lar bulunmu?tur (21).
Akci?er nod?llerinde malin benin ayr?m? a??s?ndan b 1000 g?r?nt?lerde spinal korda g?re 5 grupta g?rsel k?yaslama yap?lan bir ?al??mada; 51 hastada 54 nod?l incelenmi?tir. Dif?zyon MRG'de duyarl?l?k %88.9, ?zg?ll?k %61.0 ve pozitif prediktif de?er ise %79.6 olarak tespit edilmi?tir (12). K???k metastatik nod?ller ve solid olmayan adenokarsinom olmamas? gereken d???k de?erlerde skorlan?rken (yalanc? negatif), baz? gran?lomlar ve aktif inflamatuvar nod?ller ise yan?lt?c? olarak y?ksek de?erlerde skorlanm??t?r (yalanc? pozitif). Bu durumlar d???nda dif?zyon MRG malin ve benin ayr?m?nda faydal? bilgiler vermektedir (12).
Operasyon ?ncesi 104 hastada (140 nod?l/kitle) DAG ve PET bulgular? kar??la?t?r?larak ADC de?erleri ve SUV de?erleri ?l??lm??, duyarl?l???n her iki y?ntemde e?it oldu?u ?zg?ll???n ise DAG'da daha y?ksek oldu?u bulunmu?tur. Bu durum aktif inflamatuvar lezyonlarda DAG'da yanl?? pozitiflik oran?n daha d???k olmas?na ba?lanm?? ve DAG'?n PET yerine kullan?labilece?i ?ne s?r?lm??t?r (22).
Malin-benin ay?r?m?nda ADC de?erleri ile y?ksek b de?erlerinde, lezyon ve spinal korddan al?nan de?erlerin oran?n?n (lezyon/spinal kord oran?, LSO) kar??la?t?r?ld??? bir ?al??mada; hastalarda b0 ve b1000 de?erleri kullan?lm?? olup, bu de?erlerle ADC haritalama yap?lm??t?r. Yirmi sekiz hastada BT'de izlenen lezyonlar DAG ile incelenmi?tir. Bu ?al??mada malin nod?ller ile benin nod?ller aras?nda LSO de?erlerinde istatistiksel anlaml? fark bulunmu? ancak ADC de?erlerinde anlaml? fark bulunamam??t?r. E?ik de?eri olarak 1.135 kullan?ld???nda LSO'nun pozitif prediktif de?eri %93.8 ve negatif prediktif de?eri %75.0 olarak bulunmu?tur (23).
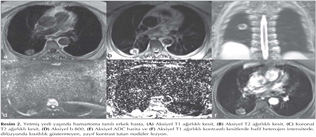
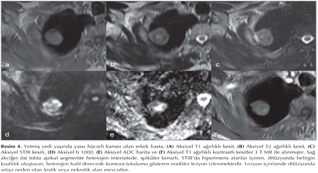
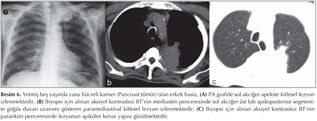
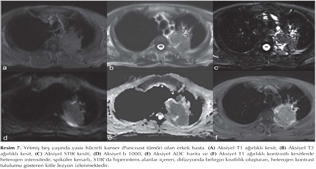
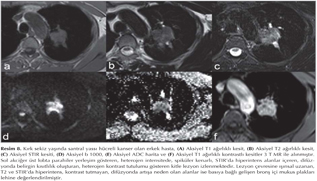
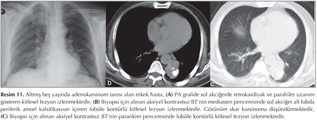
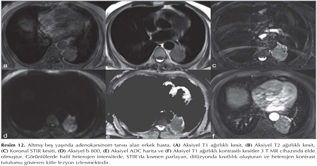
Akci?er t?m?rleri: DAG; toraksta kitlelerin karakterizasyonu, t?m?r ile atelektazi, t?m?r ile postobstr?ktif pn?moni ayr?m?, erken d?nemde kemoterapi yan?t?n?n de?erlendirilmesi ve t?m?r invazyonun tespiti gibi bir?ok alanda kullan?lmaktad?r (Resim 5). Akci?er t?m?rlerinde t?m?r?n histopatolojik tipine g?re farkl? oranlarda dif?zyon k?s?tl?l?klar? izlemekteyiz (Resim 6,7,8,99,10,11,12).
Periferik yerle?imli, plevral ba?lant?l? olan solid lezyonlu 36 hastan?n de?erlendirildi?i tez ?al??mas?nda, %25'i benin ve %75'i malin olan lezyonlar de?erlendirilmi?tir. ?al??mada ADC de?erlerinden al?nan, lezyondan al?nan ROI ile lezyon ile ayn? kesitte yer alan paraspinal kaslardan al?nan ROI de?erlerinin oranland???, ortalama r?latif ROI de?erleri kullan?lm??t?r. Ortalama r?latif ROI oran? benin lezyonlarda 2.23 ? 0.50, malin lezyonlarda ise 1.10 ? 0.37 olarak ?l??lm??t?r. Sonu? olarak solid lezyonlar?n malin-benin ay?r?m?nda r?latif ROI oranlar?n?n malin lezyonlarda benin olanlara g?re istatistiksel olarak anlaml? farkl? oldu?u bulunmu?tur (11).
Ba?ka bir ?al??mada iyi diferansiye adenokarsinomlar?n di?er histopatolojik tiplere g?re daha y?ksek ADC de?erlerine sahip oldu?u g?sterilmi? ve ADC de?erleri ile t?m?r sell?laritesi aras?nda anlaml? bir ili?ki oldu?u ortaya konmu?tur. Bu ?al??mada prospektif olarak DAG ile doku karakterizasyonu de?erlendirmi?tir. ?al??mada 30 hastada y?ksek ve d???k b de?erleri kullan?larak ADC de?erleri ?l??lm??, ADC de?eri adenokarsinomda 2.12 ? 0.60 x 10-3 mm2/sn, yass? h?creli karsinomda 1.63 ? 0.50 x 10-3 mm2/sn b?y?k h?creli kanserde 1.30 ? 0.40 x 10-3 mm2/sn ve k???k h?creli kanserde 2.09 ? 0.30 x 10-3 mm2/sn bulunmu?tur. Histopatolojik tipler aras?nda istatistiksel olarak anlaml? farkl? ADC de?erleri elde edilmi? olmas?na ra?men birbiriyle ?rt??en de?erler de tespit edilmi?tir.
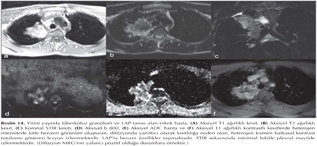
DAG'daki de?erler ile periferal akci?er adenokarsinomun histopatolojik tipleri aras?nda ili?ki oldu?unu g?steren ba?ka bir ?al??mada histopatolojik olarak bronkoalveoler kanser (BAC), ilerlemi? BAC, kar???k subtip ve non-BAC olarak s?n?fland?r?lan akci?er adenoklarsinomlar? de?erlendirilmi?tir (24). Bu karsinomlardan BAC prognoz bak?m?ndan iyi noninvaziv bir t?m?r olarak de?erlendirilirken ilerlemi? BAC ve non-BAC alt-tipleri biyolojik olarak invaziv karsinom olarak kabul edilmektedir. Bu ?al??mada 47 hastada 3 cm veya daha k???k lezyonlarda cerrahi rezeksiyon veya histopatolojik ?rnekleme ?ncesi DAG g?r?nt?leme yap?lm??t?r. Her t?m?r d?rt alt gruba ayr?lm??, sinyal yok 1, zay?f 2, orta 3, kuvvetli 4 olarak skorlanm??t?r. DAG bulgular?nda orta ve g??l? sinyal intensiteleri ilerlemi?, BAC (%79.2) ve non-BAC'da (%88.9), BAC'a (%95.2) g?re istatistiksel olarak anlaml? ?ekilde fazla izlenmi?tir. DAG ile g??l? sinyal intensitesi olanlar veya dinamik kontrastl? serilerde kuvvetli kontrast madde tutanlar?n malin oldu?una karar verilmi?tir. Duyarl?l?k %97.0, ?zg?ll?k %76.9 ve do?ruluk oran? %91.3 bulunmu?tur. Ancak ba?ka bir ?al??mada 33 adenokarsinomlu hastada b 1000 de?eri kullanarak DAG ?al??mas?nda ADC de?erlerinin adenokarsinomun subtiplerin ayr?m?nda yararl? olmad??? s?ylenmektedir (13). DAG g?r?nt?lemede en ?nemli yalanc? pozitif sebep olu?turan patolojiler t?berk?loz veya di?er infektif orijinli gran?lasyon i?eren lenf nodlar? ve konsolidasyonlard?r (Resim 13,14) (25).
Evre IA KHDAK hastalar?nda yap?lan bir ?al??mada DAG'?n t?m?r invazivli?inin de?erlendirilmesindeki ?ng?r?s? ara?t?r?lm??t?r (9). Bu hastalarda cerrahiden ?nce PET/BT ve DAG ?ekimleri yap?lm??t?r. T?m nod?ller histopatolojik olarak de?erlendirilmi?tir. Nodal, lenfovask?ler veya plevral invazyon varl??? invaziv akci?er kanseri olarak kabul edilmi?, bu bulgular?n varl???na g?re t?m?rler invaziv ve noninvaziv olarak s?n?fland?r?lm??t?r. Dif?zyon a??rl?kl? g?r?nt?lemenin evre IA KHDAK'larda invazivli?inin de?erlendirilmesinde ba??ms?z bir prediktif fakt?r olarak kullan?labilece?i s?ylenmektedir. Bununla birlikte evre IA olgular?n?n %20'sinde lenf nodu metastaz? saptand???ndan prognozlar? hala k?t? olarak de?erlendirilmektedir. DAG kullan?larak yap?lan s?n?flama sisteminin invaziv karsinomu tespit etmede duyarl?l??? %90, ?zg?ll??? %81, pozitif prediktif de?eri %60 ve negatif prediktif de?eri %96 olarak bulunmu?tur. Operasyon ?ncesi hastalarda invaziv t?m?r varl???n?n tespiti cerrahi karar?n? ve tedavi protokol?n? de?i?tirebilece?i belirtilmi?tir.
Ba?ka bir ?al??mada ise 96 KHDAK ve 28 benin lezyonu bulunan hastalarda PET/BT ve DAG bulgular? kar??la?t?r?lm??t?r (25). Evre IA, IB ve di?er ileri evrelerde PET/BT ile Flor18 ile i?aretli deoksi glukoz (FDG) tutulumunun istatistiksel olarak anlaml? oldu?unu ancak DAG'da ADC de?erlerinde anlaml? fark olmad???n? bulmu?lard?r. DAG sadece KHDAK ve benin nod?llerin ay?r?m?nda PET/BT ile benzer davran?? g?stermektedir.
Postobstr?ktif pn?moni-t?m?ral lezyon ay?r?m?: Santral akci?er kanserlerinde direkt veya dolayl? bas?ya ba?l? olarak postobstr?ktif pn?moni veya periferal akci?er kollaps? olu?abilir. Bu durumda santral t?m?r ile etraf?ndaki konsolide alan?n ayr?m? zorla??r. T?m?r boyutu hastaya ait t?m tedavi s?re?lerinde en hayati komponentlerden biri olup do?ru ?l??lmesi gereklidir. Bu ay?r?m? yapabilmek i?in DAG kullan?m?n?n ara?t?r?ld???, 27 hastan?n yer ald???, b 0 ve b 1000 de?erleri kullan?lan bir ?al??mada hem postobstr?ktif alanlardan hem de t?m?ral lezyondan ADC de?erleri hesaplanm??t?r (26). Bu de?erler aras?nda istatistiksel olarak anlaml? fark bulunmu?tur. Santral akci?er kanserlerinin evrelenmesinde DAG g?r?nt?lemenin yararl? oldu?unu g?stermi?lerdir.
Akci?er kanseri ve buna sekonder kollaps? bulunan 33 olguda IV kontrast madde sonras? ?ekilen BT ile DAG sonu?lar? kar??la?t?r?lm??, bu hastalarda kontrastl? BT ile 14 hastada, T2 g?r?nt?lerde 21 hastada kollabe akci?er ile t?m?r ay?r?m? yap?labilirken DAG ile 26 hastada yap?labilmi?tir. Sekiz olguda T2 g?r?nt?ler ile ay?rt edilmesi m?mk?n olmayan lezyonlar DAG ile ay?rt edilebilir hale gelmi?tir. Bu ?al??mada sonu? olarak DAG ile T2 g?r?nt?leri birlikte kullanman?n %88 (29/33) oranda kollabe akci?er ile t?m?r ay?r?m?n? yapabildi?ini g?stermi? ve kontrastl? BT'den daha iyi sonu?lar elde edildi?i saptanm??t?r (27).
Kemoterapi sonras? cevab?n de?erlendirilmesi: Kemoterapi sonras? t?m?r?n tedaviye cevab?n?n erken d?nemde bilinmesi kemoterapiye y?n vermede yararl? olup hastan?n surveyine katk? sa?layabilmektedir. Yak?n zamanda yap?lan bir ?al??mada KHDAK hastalarda kemoterapi sonras? cevab?n de?erlendirilmesinde evre 3B ve evre 4 KHDAK tan?l? 28 hasta kemoterapi ?ncesi ve sonras?nda, dinamik kontrastl? MRG ve DAG ile de?erlendirilmi?tir (28). DAG g?r?nt?ler i?in 1,5 T MR cihaz? ile kemoterapiden 1 hafta ?nce ve 3-4 hafta sonra de?erlendirmeler yap?lm??t?r. Hareket artefaktlar?n? azaltmak amac?yla kardiyak ve solunumsal tetikleme kullan?lm??t?r. Dif?zyon de?erler olarak b 0 ve b 1000 olarak al?nm??t?r. ?al??mada t?m?r boyutlar?ndaki azalma ile ADC de?erindeki de?i?iklik kar??la?t?r?lm?? olup erken d?nem ADC de?i?ikli?iyle t?m?r boyutundaki azalman?n istatistiksel olarak uyumlu oldu?u tespit edilmi?tir. Bu ?al??ma ?zellikle t?m?r?n erken d?nemde boyutsal ve hemodinamisinde de?i?iklik ba?lamadan ?nce ADC de?erlerinde de?i?ikli?in oldu?u g?r?lmektedir. Erken d?nem tedaviye cevab?n de?erlendirilmesi a??s?ndan olumlu sonu?lar i?ermektedir.
Kemoterapiye cevab?n de?erlendirilmesinde DAG'? ara?t?ran ba?ka bir ?al??mada ise; 19 hastada kemoterapiden 1 hafta ?nce ve 1 ay sonra konvansiyonel MR ve DAG kullanm??lar, ADC de?erleri ile t?m?r?n k?sa, uzun aks? ve ortalama uzunlu?unu kar??la?t?rm??lar (29). ADC de?erleri ile uzun aks aras? negatif korelasyon bulunmu?tur. ADC de?erlerindeki de?i?iklik ile k?sa-uzun aks? ve ortalama uzunlu?u aras?nda pozitif korelasyon bulunmu?tur. ADC de?erlerindeki de?i?ikli?in erken d?nem cevab?n de?erlendirilmesinde hassas oldu?u ve morfolojik bulgularla birlikte kemoterapinin dinamik monit?rizasyonunda kullan?labilece?i s?ylenmi?tir (29).
T?m?r M evrelemesi: Prospektif olarak yap?lan bir ?al??mada 203 KHDAK'l? hastada M evreleme i?in DAG i?eren ve i?ermeyen t?m v?cut MR tetkiki PET/BT ile birlikte kar??la?t?r?lm??, DAG i?eren t?m v?cut MR incelemenin t?m?r?n M evrelemesinde PET/BT kadar do?rulu?a sahip oldu?u g?sterilmi?tir (21).
Yine bu konu ile ilgili yap?lan di?er bir ?al??mada ise 115 KHDAK'l? hastada prospektif olarak M evreleme i?in DAG i?eren ve i?ermeyen t?m v?cut MR tetkiki, PET/BT ve kemik sintigrafi kullan?lm??t?r (30). Belirli e?ik de?erleri uyguland???nda DAG'l? t?m v?cut MR'?n ?zg?ll?k ve do?ruluk oran?, sintigrafi ve PET/BT'den anlaml? olarak y?ksek bulunmu?tur. ?al??maya g?re DAG'?n, KHDAK'l? hastalarda kemik metastaz?n?n saptanmas?nda sintigrafi ve/veya PET/BT kadar do?ru de?erlendirilebilece?i s?ylenmektedir.
Mediastinal Lezyonlar
Mediastinal lenf nodu: KHDAK'l? hastalarda lenf nodu evrelemesi ?nemlidir. Akci?er kanseri ??phesi olan hastalarda BT inceleme temel g?r?nt?leme y?ntemi olmakla birlikte lenf nodu tutulumunu g?stermede duyarl?l?k ve ?zg?ll??? sadece boyut kriteri kulland??? i?in k?s?tl?d?r. Son y?llarda PET/BT'nin kullan?ma girmesi ile 1 cm'den daha k???k boyuttaki lenf nodlar? bile y?ksek duyarl?l?kta saptanmaya ba?lanm??t?r (31). PET/BT'nin bilinen en ?nemli dezavantaj? e?lik eden inflamatuvar lenfadenitli hastalarda b?y?k bir oranda ortaya ??kan yanl?? pozitif sonu?lard?r (32). Mediastinal lenf nodlar?nda da dif?zyon MRG ?al??malar? umut verici sonu?lar vermektedir.
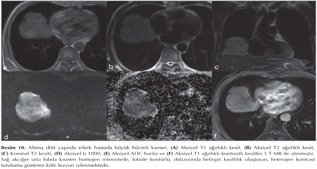
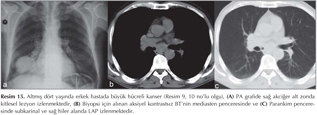
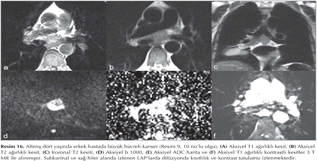
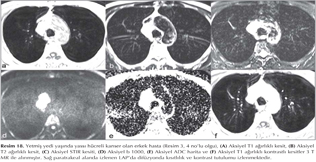
KHDAK'l? hastalarda DAG'?n etkinli?ini ara?t?ran bir ?al??mada operasyon ?ncesinde 42 hastada nefes tutmadan STIR-EPI sekans ile tespit edilen lenf nodlar?, operasyon sonras? rezeke edilen lenf nodlar? ile kar??la?t?r?lm??t?r (10). MR'da lenf nodu metastaz?, boyutundan ba??ms?z olarak bir lenf nodu lokalizasyonunda benzer T2 a??rl?kl? g?r?nt?de izlenen hipointens odak olarak tan?mlanm??t?r. Bu ?al??mada DAG, histopatolojik olarak kan?tlanm?? her 5 lenf nodundan 4 (%80)'?n? tespit etmi? ve mediastinal lenf nodu metastaz? olmayan 37 hastadan 36 (%97)'s?n?? ay?rt edebilmi?tir. Yani DAG y?ksek negatif prediktif de?ere sahiptir. ?zellikle KHDAK'larda mediastinal lenf nodu de?erlendirilmesinde alternatif noninvazif bir teknik olarak kullan?labilir. B?ylece PET ve mediastinoskopi ihtiyac?n? azaltabilir (Resim 15,16,17,18).
Daha g?ncel bir ?al??mada ise, toraks BT sonucunda akci?er kanserinden ??phelenilen 35 hastada 95 lenf nodu (8'i KHDAK, 10'u k???k h?creli kanser, 50'si sarkoidoz, 14'? reaktif lenf nodu ve 8'i ise nekrotizan gran?lomat?z lenfadenit) benin malin ay?r?m? i?in kantitatif ADC de?erleri kullanarak mediastinoskopi veya cerrahi sonu?lar ile kar??la?t?r?lm??t?r (4). Bu ?al??mada benin lenf nodlar? ile kar??la?t?r?ld?klar?nda malin lenf nodlar?n?n belirgin olarak daha d???k ADC de?erlerine sahip olduklar? g?sterilmi?tir.
Ba?ka bir ?al??mada ise DAG ve PET/BT'nin KHDAK'l? hastalar?n N evrelemesinde do?ruluk oranlar? kar??la?t?r?lm??t?r (33). Bu ?er?evede 88 hastaya operasyon ?ncesi hem DAG hem de PET/BT yap?lm?? ve ??kar?lan lenf nodlar? histopatolojik olarak Naruke haritalamas? ile analiz edilmi?tir. DAG, 1.5 T MR ile y?ksek b de?erinin kullan?ld??? (1000 mm2/s) ekoplanar g?r?nt?leme sekans?nda ger?ekle?tirilmi?tir. Toplam 734 lenf nodu analiz edilmi? ve histopatolojik inceleme sonucu bu lenf nodlar?ndan 36's?n?n metastatik, 698'inin metastatik olmad??? bulunmu?tur. Metastatik lenf nodu tespitinde DAG ile PET/BT aras?nda kayda de?er bir farkl?l?k izlenmemi?tir. Metastatik olmayan lenf nodlar?n? tespitinde ise DAG'?n, PET/BT'ye g?re, daha d???k yanl?? pozitif oran?na sahip oldu?u bildirilmi?tir. ?lgin? olarak DAG'daki yanl?? pozitif sonu?lar?n tamam?n?n t?berk?loz ve di?er nedenlere ba?l? gran?lomlardan kaynakland??? histopatolojik olarak g?sterilmi?tir.
Akci?er kanserli hastalarda yap?lan bir ?al??mada dif?zyon MRG ile PET/BT lenf nodu evrelendirmesinde kar??la?t?r?lm?? olup, 20 hastal?k seride dif?zyon MR, PET/BT'ye g?re 1 hastada ileri, 4 hastada d???k, 15 hastada ise olmas? gereken N evresi bulunmu?tur (34). ?leri evre olarak belirlenen hastada supraklavik?ler 4-7 mm ebatl? lenf nodu saptanm??t?r. D???k evre olarak saptanan hastalar?n ???nde lenf nodlar? MR ve DAG ile g?r?lememi?tir. Bir hastada ise konvansiyonel MR ile saptanan lenf nodu DAG ve PET/BT ile saptanamam??t?r. Sonu? olarak DAG'?n k???k lenf nodu tespitinde her ne kadar faydal? olsa da konvansiyonel MR'a g?re avantajl? olmad??? fikrine var?lm??t?r. Konvansiyonel MR'?n tek ba??na veya DAG ile birlikte kullan?ld???nda PET/BT'ye benzer sonu?lar elde edildi?i g?sterilmi?tir.
Bir ?al??mada KHDAK olan 250 hastada STIR, DAG ve PET bulgular? kar??la?t?r?lm??t?r (35). STIR'da lenf nodu/serum fizyolojik ve lenf nodu/kas oranlar?, DAG'da ADC de?eri ve PET'te ise SUV de?erleri elde edilmi?tir. ?ncelemeler hem kantitatif hem de kalitatif olarak yap?lm??t?r. STIR'da lenf nodu/serum fizyolojik ve lenf nodu/kas oranlar?nda duyarl?l?k %82.8 ve do?ruluk %86.8 olup ADC'de ise s?ras?yla %74.2 ve %84.4 bulunmu?tur. STIR sekans? sonu?lar? hem DAG ve hem de PET'ten daha hassas ve do?ru oldu?u s?ylenmektedir.
Mediastinal kitle lezyonlar: Mediastinal kitlelere y?nelik yap?lan bir ?al??mada; tipik tiroid kitlesi ve vask?ler lezyonlar ?al??ma d??? tutulup, di?er kitlesel patolojiler de?erlendirilmi?tir (36). Boyutlar?n?n 15 mm'nin ?st?nde oldu?u 53 histopatolojik veya klinik olarak tan?s? konmu? lezyonda benin malin ay?r?m?nda kantitatif ADC de?erleri kullan?larak kar??la?t?rma yap?lm??t?r. 3 T MR cihaz? kullan?lan ?al??mada hareket artefaktlar?n? azaltmak i?in nefes tutmal? ve kardiyak tetiklemeli sekans uygulanm?? ve rutin MR sekanslar? ve DAG g?r?nt?ler (b 0 ve b 1000) elde edilmi?tir. Elde edilen sonu?lara g?re benin lezyonlar ile malin lezyonlar aras?nda istatistiksel anlaml? farkl?l?k saptanm??t?r. Malin lezyonlarda ADC de?eri daha d???k ?l??lmesine ra?men adenokarsinomlu bir hastada y?ksek ADC de?erleri saptanm??t?r. Bu olguda nekrotik alanlar mevcut oldu?undan ADC de?erleri y?ksek olarak ?l??lm??t?r. ?al??madaki mevcut verilere g?re DAG'?n benin-malin ay?r?m?nda duyarl?l??? %95 ve ?zg?ll??? %87 olarak de?erlendirilmi?tir.
"Single-shot echo-planar" MR sekans? ile elde edilen DAG g?r?nt?leme ile mediastinal t?m?rlerin de?erlendirildi?i bir ?al??mada ADC de?erleri histopatolojik bulgularla kar??la?t?r?lm??t?r (37). Malin mediastinal t?m?rlerde 1.09 ? 0.25 x 10-3 mm2/sn ve benin t?m?rlerde 2.38 ? 0.56 x 10-3 mm2/sn bulunmu?tur. ADC'de e?ik de?eri 1.56 al?nd???nda duyarl?l?k %95, ?zg?ll?k %94, pozitif prediktif de?er %94 ve negatif prediktif de?er ise %96 bulunmu?tur.
Yirmi d?rt ?ocuk hastada mediastinal lezyonlar?n de?erlendirildi?i ?al??mada malin lezyonlarda ADC de?erleri 0.91 ? 0.17 x 10-3 mm2/sn ve benin olanlarda ise 1.8 ? 0.33 x 10-3 mm2/sn bulunmu?tur (38). ADC'de e?ik de?eri 1.2 al?nd???nda duyarl?l?k %92, ?zg?ll?k %94, pozitif prediktif de?er %94 ve negatif prediktif de?er ise %92 bulunmu?tur.
Her ?? ?al??maya g?re de mediastinal lezyonlarda dif?zyon MRG tek ba??na de?erli bilgiler vermektedir. T?m v?cut DAG ile birlikte yap?lan MR ?al??malar?nda, DAG sonu?lar? lenfoma evrelemesinde BT veya PET/BT'ye e?de?er bulunmu?tur (36-38).
SONU?
Dif?zyon MRG ile yap?lan ?al??malar, ?zellikle nod?l ve kitle gibi t?m?ral patolojilerde yo?unla?m?? olup, benin malin ayr?m?na ?nemli katk? sa?lamaktad?r. Akci?er kanserlerinde ise DAG'?n TNM s?n?flamas?nda; T evresinde, t?m?r?n ger?ek ?ap?n?n hesaplanmas?nda, t?m?r?n atelektazi, kollaps, postobstr?ktif de?i?iklikten ayr?lmas?nda ve kemoterapiye erken cevab?n de?erlendirilmesinde ilave ?nemli bilgiler verdi?i g?r?lmektedir. N ve M de?erlendirmede ise di?er modalitelere benzer sonu?lar g?sterdi?i bildirilmektedir. Plevral, mediastinal ve kardiyak patolojilerde de katk? sa?layabilece?ine dair ?al??malar mevcuttur ancak bu alanlarda daha geni? serilere ihtiya? oldu?unu d???nmekteyiz. Ayr?ca, toraksta dif?zyon MRG ?o?u ?al??mada tekil incelenmi? olup ?zellikle konvansiyonel MR sekanslar?, dinamik kontrastl? MR ve STIR sekans? gibi di?er sekanslar ile birlikte ?oklu de?erlendirmeye ihtiya? oldu?u g?r?lmektedir. Bu sayede DAG'la birlikte MR inceleme, toraks patolojilerindeki algoritmada hak etti?i noktaya varacakt?r.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Eisenberg RL; Fleischner Society. Ways to improve radiologists' adherence to Fleischner Society guidelines for management of pulmonary nodules. J Am Coll Radiol 2013;10:439-41.
- Lacson R, Prevedello LM, Andriole KP, Gill R, Lenoci-Edwards J, Roy C, et al; Fleischner Society. Factors associated with radiologists' adherence to Fleischner Society guidelines for management of pulmonary nodules. J Am Coll Radiol 2012;9:468-73.
- Matoba M, Tonami H, Kondou T, Yokota H, Higashi K, Toga H, et al. Lung carcinoma: diffusion-weighted mr imaging--preliminary evaluation with apparent diffusion coefficient. Radiology 2007;243:570-7.
- Ko?ucu P, Tekinba? C, Erol M, Sari A, Kavgaci H, Oztuna F, et al. Mediastinal lymph nodes: assessment with diffusion-weighted MR imaging. J Magn Reson Imaging 2009;30:292-7.
- Razek AA, Elmorsy A, Elshafey M, Elhadedy T, Hamza O. Assessment of mediastinal tumors with diffusion-weighted single-shot echo-planar MRI. J Magn Reson Imaging 2009;30:535-40.
- Modesti G, Zimmermann B, B?rsch M, Herrmann A, Saalw?chter K. Diffusion in Model Networks as Studied by NMR and Fluorescence Correlation Spectroscopy. Macromolecules 2009;42:4681-9.
- Gilllard JH, Waldman AD, Barker PB. Clinical MR Neuroimaging Diffusion, Perfusion and Spectroscopy. In: Jones, D.K. ed, Fundamentals of diffusion MR imaging, Cambridge: Cambridge Univ. Pres., 2005:54-86.
- Biederer J, Beer M, Hirsch W, Wild J, Fabel M, Puderbach M, et al. MRI of the lung (2/3). Why ? when ? how? Insights Imaging 2012;3:355-71.
- Kanauchi N, Oizumi H, Honma T, Kato H, Endo M, Suzuki J, et al. M. Role of diffusion-weighted magnetic resonance imaging for predicting of tumor invasiveness for clinical stage IA non-small cell lung cancer. Eur J Cardiothorac Surg 2009;35:706-10.
- Hasegawa I, Boiselle PM, Kuwabara K, Sawafuji M, Sugiura H. Mediastinal lymph nodes in patients with non-small cell lung cancer: preliminary experience with diffusion-weighted MR imaging. J Thorac Imaging 2008;23:157-61.
- Kahraman M. Plevral patolojisi olan hastalarda dif?zyon manyetik rezonans incelemenin benign malign ayr?m?nda yeri ve ?nemi (tez). Erzurum: Atat?rk ?niversitesi T?p Fak?ltesi; 2012.
- Satoh S, Kitazume Y, Ohdama S, Kimula Y, Taura S, Endo Y. Can malignant andbenign pulmonary nodules be differentiated with diffusion-weighted MRI? AJR Am J Roentgenol. 2008;191:464-70.
- Koyama H, Ohno Y, Kono A, Takenaka D, Maniwa Y, Nishimura Y, et al. Quantitative and qualitative assessment of non-contrast-enhanced pulmonary MR imaging for management of pulmonary nodules in 161 subjects. Eur Radiol 2008;18:2120-31.
- Frericks BB, Meyer BC, Martus P, Wendt M, Wolf KJ, Wacker F. MRI of the thorax during whole-body MRI: evaluation of different MR sequences and comparison to thoracic multidetector computed tomography (MDCT). J Magn Reson Imaging 2008;27:538-45.
- Higashi K, Ueda Y, Sakuma T, Seki H, Oguchi M, Taniguchi M, et al. Comparison of [(18)F]FDG PET and (201)Tl SPECT in evaluation of pulmonary nodules. J Nucl Med 2001;42:1489-96.
- Ohno Y, Koyama H, Takenaka D, Nogami M, Maniwa Y, Nishimura Y, et al. Dynamic MRI, dynamic multidetector-row computed tomography (MDCT), and coregistered 2-[fluorine-18]-fluoro-2-deoxy-D-glucose-positron emission tomography (FDG-PET)/CT: comparative study of capability for management of pulmonary nodules. J Magn Reson Imaging 2008;27:1284-95.
- Girvin F, Ko JP. Pulmonary nodules: detection, assessment, and CAD. AJR Am J Roentgenol 2008;191:1057-69.
- Regier M, Schwarz D, Henes FO, Groth M, Kooijman H, Begemann PG, et al. Diffusion-weighted MR-imaging for the detection of pulmonary nodules at 1.5 Tesla: intraindividual comparison with multidetector computed tomography. J Med Imaging Radiat Oncol 2011;55:266-74.
- Chen W, Jian W, Li HT, Li C, Zhang YK, Xie B, et al. Whole-body diffusion-weighted imaging vs. FDG-PET for the detection of non-small-cell lung cancer. How do they measure up? Magn Reson Imaging 2010;28:613-20.
- Ohba Y, Nomori H, Mori T, Shiraishi K, Namimoto T, Katahira K. Diffusion-weighted magnetic resonance for pulmonary nodules: 1.5 vs. 3 Tesla. Asian Cardiovasc Thorac Ann 2011;19:108-14.
- Ohno Y, Koyama H, Onishi Y, Takenaka D, Nogami M, Yoshikawa T, et al. Non-small cell lung cancer: whole-body MR examination for M-stage assessment--utility for whole-body diffusion-weighted imaging compared with integrated FDG PET/CT. Radiology 2008;248:643-54.
- Mori T, Nomori H, Ikeda K, Kawanaka K, Shiraishi S, Katahira K, et al. Diffusion-weighted magnetic resonance imaging for diagnosing malignant pulmonary nodules/masses: comparison with positron emission tomography. J Thorac Oncol 2008;3:358-64.
- Uto T, Takehara Y, Nakamura Y, Naito T, Hashimoto D, Inui N, et al. Higher sensitivity and specificity for diffusion-weighted imaging of malignant lung lesions without apparent diffusion coefficient quantification. Radiology 2009;252:247-54.
- Tanaka R, Horikoshi H, Nakazato Y, Seki E, Minato K, Iijima M, et al. Magnetic resonance imaging in peripheral lung adenocarcinoma: correlation with histopathologic features. J Thorac Imaging 2009;24:4-9.
- Luna A, S?nchez-Gonzalez J, Caro P. Diffusion-weighted imaging of the chest. Magn Reson Imaging Clin N Am 2011;19:69-94.
- Baysal T, Mutlu DY, Yologlu S. Diffusion-weighted magnetic resonance imaging in differentiation of postobstructive consolidation from central lung carcinoma. Magn Reson Imaging 2009;27:1447-54.
- Qi LP, Zhang XP, Tang L, Li J, Sun YS, Zhu GY. Using diffusion-weighted MR imaging for tumor detection in the collapsed lung: a preliminary study. Eur Radiol 2009;19:333-41.
- Yabuuchi H, Hatakenaka M, Takayama K, Matsuo Y, Sunami S, Kamitani T, et al. Non-small cell lung cancer: detection of early response to chemotherapy by using contrast-enhanced dynamic and diffusion-weighted MR imaging. Radiology 2011;261:598-604.
- Zhou R, Yu T, Feng C, Ma L, Wang Y, Li W, et al. Diffusion-weighted imaging for assessment of lung cancer response to chemotherapy. Zhongguo Fei Ai Za Zhi 2011;14:256-60.
- Takenaka D, Ohno Y, Matsumoto K, Aoyama N, Onishi Y, Koyama H, et al. Detection of bone metastases in non-small cell lung cancer patients: comparison of whole-body diffusion-weighted imaging (DWI), whole-body MR imaging without and with DWI, whole-body FDG-PET/CT, and bone scintigraphy. J Magn Reson Imaging 2009;30:298-308.
- Nomori H, Watanabe K, Ohtsuka T, Naruke T, Suemasu K, Kobayashi T, et al. Fluorine 18-tagged fluorodeoxyglucose positron emission tomographic scanning to predict lymph node metastasis, invasiveness, or both, in clinical T1 N0 M0 lung adenocarcinoma. J Thorac Cardiovasc Surg 2004;128:396-401.
- Roberts PF, Follette DM, von Haag D, Park JA, Valk PE, Pounds TR, et al. Factors associated with false-positive staging of lung cancer by positron emission tomography. Ann Thorac Surg 2000;70:1154-9.
- Nomori H, Mori T, Ikeda K, Kawanaka K, Shiraishi S, Katahira K, et al. Diffusion-weighted magnetic resonance imaging can be used in place of positron emission tomography for N staging of non-small cell lung cancer with fewer false-positive results. J Thorac Cardiovasc Surg 2008;135:816-22.
- Pauls S, Schmidt SA, Juchems MS, Klass O, Luster M, Reske SN, et al. Diffusion-weighted MR imaging in comparison to integrated [?⁸F]- DG PET/CT for N-staging in patients with lung cancer. Eur J Radiol 2012;81:178-82.
- Ohno Y, Koyama H, Yoshikawa T, Nishio M, Aoyama N, Onishi Y, et al. N stage disease in patients with non-small cell lung cancer: efficacy of quantitative and qualitative assessment with STIR turbo spin-echo imaging, diffusion-weighted MR imaging, and fluorodeoxyglucose PET/CT. Radiology 2011;261:605-15.
- G?m??ta? S, Inan N, Sarisoy HT, Anik Y, Arslan A, Cift?i E, et al. Malignant versus benign mediastinal lesions: quantitative assessment with diffusion weighted MR imaging. Eur Radiol 2011;21:2255-60.
- Abdel Razek AA, Soliman N, Elashery R. Apparent diffusion coefficient values of mediastinal masses in children. Eur J Radiol 2012;81:1311-4.
- Lin C, Luciani A, Itti E, El-Gnaoui T, Vignaud A, Beaussart P, et al. Whole-body diffusion-weighted magnetic resonance imaging with apparent diffusion coefficient mapping for staging patients with diffuse large B-cell lymphoma. Eur Radiol 2010;20:2027-38.
Yaz??ma Adresi (Address for Correspondence)
Dr. Adem KARAMAN
Atat?rk ?niversitesi T?p Fak?ltesi,
Radyoloji Anabilim Dal?,
ERZURUM - TURKEY
e-mail: drkaraman77@yahoo.com