REVIEW
Doi: 10.5578/tt.6818
Tuberk Toraks 2014;62(2):165-169

Ast?m, ?evre ve epigenetik
Serap DURU1, Emine Bahar KURT2
1 D??kap? Y?ld?r?m Beyaz?t E?itim ve Ara?t?rma Hastanesi, G???s Hastal?klar? Klini?i, Ankara, T?rkiye
1 Clinic of Chest Diseases, Diskapi Yildirim Beyazit Training and Research Hospital, Ankara, Turkey
2 Abant ?zzet Baysal ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Bolu, T?rkiye
2 Department of Chest Diseases, Faculty of Medicine, Abant Izzet Baysal University, Bolu, Turkey
?ZET
Ast?m, ?evre ve epigenetik
Epigenetik, gen ifadesinde DNA'n?n baz diziliminin d???ndaki kal?c? de?i?iklikleri ifade etmekte kullan?lmaktad?r. Son kan?tlar epigenetik mekanizmalar?n imm?n yan?t ve ast?mda rol ald???n? g?stermektedir. Bu yaz?n?n amac? ast?mdaki temel epigenetik mekanizmalar? g?zden ge?irmektir.
Anahtar kelimeler: Ast?m, epigenetik, ?evre
SUMMARY
Asthma, environment and epigenetic
Epigenetic defines long-lasting changes in gene expression independently from DNA sequence. Current evidence revealed that epigenetic mechanisms may have role into immune response and asthma. The purpose of this article is to review basic epigenetic mechanisms in asthma.
Key words: Asthma, epigenetic, environment
G?R??
Hava yollar?n?n kronik inflamatuvar bir hastal??? olan ast?m?n d?nyada yakla??k olarak 300 milyon ki?iyi etkiledi?i d???n?lmektedir. Son y?llarda prevalans? giderek artan ast?m kronik hava yolu inflamasyonunun sonucu olarak nefes darl???, h???lt?l? solunum, ?ks?r?k ve g???ste s?k??ma hissiyle ataklar halinde seyreden bir hastal?kt?r. Fizyopatogenezi halen tam olarak bilinmeyen ast?mda poligenik ge?i?li genetik yatk?nl?k ve ?zellikle g?n?m?zde artan ?evresel maruziyet etyolojide birlikte rol almaktad?r (1). Son y?llarda ast?mda epigenetik de?i?ikliklerin patogenezdeki rol? ?zerinde ?al??malar giderek artmaktad?r. Bu nedenle derleme yaz?m?zda ast?mda g?r?len epigenetik mekanizmalar?n ?nemini vurgulamay? ama?lad?k.
Epigenetik, genotipik ?zelliklerden ba??ms?z olarak gen ekspresyonundaki kal?tsal fenotipik de?i?ikliklerin incelenmesi olarak adland?r?lmaktad?r (2,3). DNA metilasyonu, histon modifikasyonu, histon asetilasyonu ve RNA ile ind?klenen sessizle?me (RNA-induced silencing) gibi epigenetik mekanizmalar gen ifadesini farkl?la?t?rmaktad?r (4,5). Epigenetik mekanizmalar DNA ve histonlar aras?ndaki ili?kiyi d?zenleyerek, genlerin transkripsiyonel olarak aktif veya inaktif olmalar?n? sa?larlar. DNA metilasyonu ve histon modifikasyonlar?n?n geri d?n???ml? epigenetik kal?b?yla kromatinin dinamik yap?s? kontrol edilmektedir (6). DNA metilasyonu, h?cre fonksiyonlar?n? de?i?tiren bir metil grubunun kovalent ?ekilde DNA metiltransferaz katalizinde bir sitozinfosfoguanin (CpG) din?kleotidindeki sitozinin 5 karbonundan yap?ya eklenmesidir. CpG alanlar?n?n metillenmesi o genin s?rekli sessiz kalmas?na neden olmaktad?r. ?nsanda ba?l?ca epigenetik de?i?iklik, CpG din?kleotitleri i?inde bulunan sitozinlerin metilasyonudur (7). DNA metilasyonu transkripsiyon ba?lang?? b?lgesini etkileyerek gen ifadesini de?i?tirebilir. Allerjik, aspirin ile ili?kili ast?m ve persistan wheezingde ast?m ile ili?kili genlerde DNA'da hipo ve hipermetilasyon alanlar? saptanm??t?r (8).
Histon modifikasyonlar?, metilasyon, asetilasyon, fosforilasyon, ubikutinasyon/sumolasyon ve ADP-ribozi-lasyonudur (9). Metilasyon histonlarda lizin ve arjininin azot atomlar?nda post-translasyonel olarak ger?ekle?en bir modifikasyondur. Lizin metilasyonu, n?kleozom de?i?ikliklerini sa?layan kromatinin remodelingine neden olurken, arjinin metilasyonu ise histon asetilasyonuyla birlikte ?e?itli genlerin transkripsiyonel aktivitesiyle ili?kilidir.
Asetilasyon ile kromatin katlanmalar?n?n de?i?imi ve aktif kromatin olu?umu ifade edilirken, deasetilasyon ile kromatinin s?k?ca sar?larak genlerin inaktif duruma ge?mesi ifade edilmektedir. Fosforilasyon histon H3'?n aminoterminalinde bulunan 10. pozisyonundaki serin'in fosforillenmesi, ubikutinasyonu artan gen ifadesiyle ili?kili iken, histon sumolasyonu ise azalm?? gen ifadesi ile ili?kilidir (10). ADP-ribozilasyonu ise DNA hasar?na kar?? olu?an h?cresel cevaptaki post-translasyonel bir modifikasyondur (11). Negatif y?kl? poli-ADP-riboz zinciri DNA ile histonlar aras?ndaki etkile?imi azaltarak, kromatinde b?lgesel a??lmalara neden olmaktad?r. Kodlanmayan RNA histon modifikasyonu ve DNA metilasyonunu kolayla?t?rarak, gen ifadelerinin susturulmas?n? ind?kleyebilir (12). Kal?tsal ya da kazan?lm?? bu epigenetik mekanizmalar genler ve ?evresel etkile?imin bir sonucudur. Meydana gelen de?i?iklikler organizmay? do?rudan etkilemekte ancak DNA dizisinde bir de?i?ikli?e yol a?mamaktad?r. Kazan?lan epigenetik ?zellikler bireyin t?m ya?am? boyunca korunmaktad?r. Bu ?zelliklerde meydana gelebilecek de?i?iklikler konjenital bozukluklara, kanser gibi ?e?itli hastal?klara yatk?nl??a yol a?maktad?r. Baz? diyetler, ila?lar, ya?lanma, hastal?klar epigenetik destabilizasyona yol a?abilir (13).
Ast?mda CD4+ T helper 2 (Th2) h?creler, mast h?creleri, eozinofiller, dendritik h?creler, n?trofiller inflamasyonda rol oynamaktad?r (14,15). Allerjenin solunum yoluyla v?cuda al?nmas? ile antijen sunan dendritik h?crelerden sal?nan IL-25 ve IL-33 arac?l???yla CD4+ T lenfositler Th2 fenotipine modifiye olur ve bu h?crelerden IL-4, IL-5, IL-9, IL-13 salg?lan?r. Th2 h?creler salg?lad??? sitokinler ile rol alan di?er h?crelerin inflamasyon b?lgesine gelmesine neden olur. Th2'den salg?lanan IL-4 ve IL-13 arac?l???yla plazma h?creleri B lenfositlere d?n??erek IgE sentezi ger?ekle?ir. Ayr?ca, interferon-gama ve IL-2 gibi di?er TH1 sitokinlerin sal?n?m? da bask?lan?r. Son y?llarda Th17'nin ke?fi n?trofilik ast?m ?zerinde ???k tutmu?tur. CD4+ T lenfositlerin Th2 ve Th17 fenotipine d?n??mesi ast?m ve di?er hava yolu disfonksiyonlar?na yol a?maktad?r. Allerjen spesifik IgE resept?r? ta??yan mast h?creleri tekrar antijen ile kar??la?ma sonucunda ba?ta histamin olmak ?zere l?kotrien, prostoglandinlerin sal?n?m? sonucunda inflamasyonu ba?lat?r. Ortamdaki makrofajlarda inflamasyonda rol alan h?crelerdir. ?nflamatuvar olaylar sonucunda "remodeling" ad? verilen bazal membran kal?nla?mas?, yeni vask?ler ve sinir yap?lar?n olu?umu, goblet h?cre hiperplazisi gibi ekstrasel?ler matriksin yeniden yap?land?r?lmas? meydana gelmektedir.
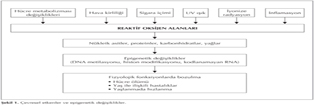
?lk kez 1942 y?l?nda Waddington taraf?ndan gen-?evre etkile?iminden s?z edildi?inden beri bu konuda yap?lan ara?t?rmalarda pek ?ok ?evresel fakt?r?n reaktif oksijen alanlar?yla ili?kili olarak n?kleik asit, protein, karbonhidrat ve ya?larda yap?sal bozukluklar ile epigenetik etkilerini meydana getirdi?i d???nd?rmektedir (16). ?ekil 1'de ba?l?ca ?evresel fakt?rler ve etkileri g?r?lmektedir (17). G?ncel yay?nlar ast?m olu?um basamaklar?nda epigenetik defektlerin rol?n? ortaya koymaktad?r. Epigenetik mekanizmalar ile reg?le edilen ast?m ile ili?kili pek ?ok gen oldu?u bilinmektedir. Gestasyonel d?nemde Th2 fenotipine d?n???mde g?r?len hipermetilasyon allerjik hava yolu hastal?klar? riskini art?rmaktad?r (18). Ya?lanmada DNA metilasyonu ve gen ekspresyonunda de?i?ikliklere yol a?abilir (19). Sigara i?imi alveoler makrofajlarda t?m histon deasetilaz (HDAC) ve HDAC2 aktivitesini bask?layarak inflamatuvar mediyat?rlerin (GM-CSF, IL-8, IL-1β, TNF-α) ekspresyonunu art?rmaktad?r (20). Yap?lan ?al??malarda gebelik d?neminde annenin sigara i?mesinin ?ocuklarda ast?ma yatk?nl??? art?rd??? g?r?lm??t?r (21,22). Ayr?ca, folat ve metiyonin gibi metil don?rlerinin diyetteki yetersizli?i global bir hipometilasyona yol a?arak ast?m olu?umuna katk?da bulunabilir.
Ast?mda epigenetik de?i?ikliklere yol a?an ?evresel etkenler ve etkiledi?i genler Tablo 1'de g?sterilmi?tir.
Epigenetik mekanizmalar ile olu?an kromozomal karars?zl?k yaln?zca ast?mda de?il kronik obstr?ktif akci?er hastal???, interstisyel akci?er hastal???, akci?er kanserleri gibi pek ?ok akci?er hastal???nda g?ndemdedir. Epigenetik mekanizmalar ve gen ifadesi ?zerindeki etkilerinin net bir ?ekilde ortaya konmas? ?mit edilen gelecek g?nlerde ast?m gibi pek ?ok hastal???n erken tan? ve tedavisi m?mk?n olabilecektir.
SONU?
Gebelikte ba?layan imm?n ve n?roendokrin sistemi etkileyen ?evresel fakt?rler histon modifikasyonlar? ve DNA metilasyonundaki de?i?iklikler gibi epigenetik mekanizmalar ast?m olu?umuna katk?da bulunmaktad?r. ?leriki y?llarda yap?lacak ara?t?rmalar hangi epigenetik mekanizmalar?n ast?mda g?revli genleri d?zenledi?ini tam olarak anlamam?z? sa?layabilir.
DNA metilasyonu ve histon modifikasyonunu hedef alan tedavi stratejileri ast?m?n ?nlenmesi ve tedavisi i?in yeni yakla??mlar getirebilir. Sonu? olarak pek ?ok hastal?kta oldu?u gibi ast?m?n s?rr? da epigenetik mekanizmalar i?inde sakl? gibi g?r?nmektedir. Bu konuda yap?lacak ?al??malar epigeneti?i tam olarak ??zmeyi sa?layacakt?r.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Global Initiative for Asthma (GINA). Global strategy for asthma management and prevention. Revised 2012.
- Feinberg A. The Epigenetitics of cancer etiology. Cancer Biology 2004;14:427-32.
- Allis CD, Jenuwein T, Reinberg D (eds). Epigenetics. Cold Spring Harbor, NY: Cold Spring Harbor Laboratory Press; 2009.
- Egger G, Liang G, Aparicio A, Jones PA. Epigenetics in human disease and prospects for epigenetic therapy. Nature? 2004;429(6990):457-63.
- Waggoner D. Mechanisms of disease: epigenesis. Semin Pediatr Neurol 2007;14:7-14.
- Rodenhiser D, Mann M. Epigenetics and human disease: translating basic biology into clinical applications. CMAJ 2006;174:341-8.
- Etseller M, Herman J. Cancer as an epigenetic disease: DNA methylation and chromatin alterations in human tumours. J Pathol 2002;196:1-7.
- Devries A, Vercelii D. Epigenetics of human asthma and allergy: promises to keep. Abstract Asian Pac J Allergy Immunol 2013;31:183-9.
- Lu Q, Qiu X, Hu N, Wen H, Su Y, Richardson B. Epigenetics, diseases and therapeutic interventions. Ageing Research Reviews 2006;5:449-67.
- Santos-Rosa H, Caldas C. Chromatin modifier enzymes, the histone code and cancer. Eur J Cancer 2005;41:2381-402.
- Morin V, Diaz F, Montecino M, Fothergill-Gilmore L, Puchi M, Imschenetzky M. Poly (ADP-ribosylation) protects maternally derived histones from proteolysis after fertilization. Bochem J 1999;343:95-98.
- Peedicayil J. Epigenetic therapy-a new development in pharmacology. Indian J Med Res 2006;123:17-24.
- Bjornsson HT, Sigurdsson MI, Fallin MD, Irizarry RA, Aspelund T, Cui H, et al. Intraindividual change over time in DNA methylation with familial clustering. JAMA 2008;299:2877-83.
- Bousquet J, Jeffery PK, Busse WW, Johnson M, Vignola AM. Asthma. From bronchoconstriction to airways inflammation and remodeling. Am J Respir Crit Care Med 2000;161:1720-45.
- Lemanske RF Jr, Busse WW. Asthma: clinical expression and molecular mechanisms. J Allergy Clin Immunol 2010;12:95-102.
- Waddington CH. Theepigenotype. Endeavour 1942;1:18-20.
- Cencioni C, Spallotta F, Martelli F, Valente S, Mai A, Zeiher AM, et al. Oxidative stress and epigenetic regulation in ageing and age-related diseases. Int J Mol Sci 2013;28:17643-63.
- Yang IV, Schwartz DA. Epigenetic control of gene expression in the lung. Am J Respir Crit Care Med 2011;183:1295-301.
- Fraga MF, Ballestar E, Paz MF, Ropero S, Setien F, Ballestar ML, et al. Epigenetic differences arise during the lifetime of monozygotic twins. Proc Natl Acad Sci USA 2005;102:10604-9.
- Cos?o BG, Mann B, Ito K, Jazrawi E, Barnes PJ, Chung KF,? et al. Histone acetylase and deacetylase activity in alveolar macrophages and blood mononocytes in asthma. Am J Respir Crit Care Med 2004;170: 141-7.
- Henderson AJ, Newson RB, Rose-Zerilli M, Ring SM, Holloway JW. Maternal Nrf2 and gluthathione-S-transferase polymorphisms do not modify associations of prenatal tobacco smoke exposure with asthma and lung function in school-aged children. Thorax 2010;65:897-902.
- Hylkema MN, Blacquiere MJ. Intrauterine effects of maternal smoking on sensitization, asthma, and chronic obstructive pulmonary disease. Proc Am Thorac Soc 2009;6:660-2.
- Schembri F, Sridhar S, Perdomo C, Gustafson AM, Zhang X, Ergun A,? et al. MicroRNAs as modulators of smoking-induced gene expression changes in human airway epithelium. Proc Natl Acad Sci USA 2009;106:2319-24.
- Breton CV, Byun HM, Wenten M, Pan F, Yang A, Gilliland FD. Prenatal tobacco smoke exposure affects global and gene-specific DNA methylation. Am J Respir Crit Care Med 2009;180:462-7.
- Nadeau K, McDonald-Hyman C, Noth EM, Pratt B, Hammond SK, Balmes J, et al. Ambient air pollution impairs regulatory T-cell function in asthma. J Allergy Clin Immunol 2010;126:845-52.
- Breton CV, Salam MT, Wang X, Byun HM, Siegmund KD, Gilliland FD. Particulate matter, DNA methylation in nitric oxide synthase, and childhood respiratory disease. Environmental Health Perspectives 2012;120:1320-6.
- Perera F, Tang WY, Herbstman J, Tang D, Levin L, Miller R, et al. Relation of DNA methylation of 5'-CpG island of ACSL3 to transplacental exposure to airborne polycyclic aromatic hydrocarbons and childhood asthma. PloS one 2009;4:e4488.
- Pascual M, Suzuki M, Isidoro-Garcia M, Padron J, Turner T, Lorente F, et al. Epigenetic changes in B lymphocytes associated with house dust mite allergic asthma. Epigenetics 2011;6:1131-7.
- Morales E, Bustamante M, Vilahur N, Escaramis G, Montfort M, de Cid R, et al. DNA hypomethylation at ALOX12 is associated with persistent wheezing in childhood. Am J Respir Crit Care Med 2012;185:937-43.
- Fu A, Leaderer BP, Gent JF, Leaderer D, Zhu Y. An environmental epigenetic study of ADRB2 5'-UTR methylation and childhood asthma severity. Clin Exp Allergy 2012;42:1575-81.
- Ferreira MA, Oates NA, van Vliet J, Zhao ZZ, Ehrich M, Martin NG, et al. Characterization of the methylation patterns of MS4A2 in atopic cases and controls. Allergy 2010;65:333-7.
- Michel S, Busato F, Genuneit J, Pekkanen J, Dalphin JC, Riedler J, et al. Farm exposure and time trends in early childhood may influence DNA methylation in genes related to asthma and allergy. Allergy 2013;68:355-64.
- Teneng I, Montoya-Durango DE, Quertermous JL, Lacy ME, Ramos KS. Reactivation of L1 retrotransposon by benzo(a)pyrene involves complex genetic and epigenetic regulation.Epigenetics 2011;6:355-67.
- Paul G, Brehm J, Alcorn J, Holguin F, Aujla S, Celed?n J. Vitamin D and asthma. Am J Respir and Crit Care Med 2012;15:124-32.
- Sundar IK, Rahman J. Vitamin D and suscpetibility of chronic lung diseases: role of epiegentics. Front Pharmacol 2011;2:1-10.
- Hollingsworth JW, Maruoka S, Boon K, Garantziotis S, Li Z, Tomfohr J, et al. In utero supplementation with methyl-donors enhances allergic airway disease in mice. J Clin Invest 2008;118:3462-9.
- Isidoro-Garcia M, Sanz C, Garcia-Solaesa V, Pascual M, Pescador DB, Lorente F, et al. PTGDR gene in asthma: a functional, genetic, and epigenetic study. Allergy 2011;66:1553-62.
- Fu A, Leaderer BP, Gent JF, Leaderer D, Zhu Y. An environmental epigenetic study of ADRB2 5'-UTR methylation and childhood asthma severity. Clin Exp Allergy 2012;42:1575-81.
- Franco R, Schoneveld O, Georgakilas AG, Panayiotidis MI. Oxidative stress, DNA methylation and carcinogenesis. Cancer Lett 2008;266:6-11.
Yaz??ma Adresi (Address for Correspondence)
Dr. Serap Duru
D??kap? Y?ld?r?m Beyaz?t E?itim ve
Ara?t?rma Hastanesi,
G???s Hastal?klar? Klini?i,
ANKARA - TURKEY
e-mail: akcalis@hotmail.com