Bronkoalveoler lavaj (BAL) ve bron?iyal lavaj yap?lan
hastalardaki
Pneumocystis jirovecii kolonizasyonu ve tan?da kullan?lan y?ntemlerin
kar??la?t?rmas?
Ahmet ?ZMEN1, Re?it MISTIK1,? Oktay ALVER2,? Funda CO?KUN3, Ahmet URSAVA?3, Esra UZASLAN3
1 Uluda? ?niversitesi T?p Fak?ltesi, ?nfeksiyon Hastal?klar? ve Klinik Mikrobiyoloji Anabilim Dal?, Bursa,
2 Uluda? ?niversitesi T?p Fak?ltesi, Mikrobiyoloji Anabilim Dal?, Bursa,
3 Uluda? ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Bursa.
?ZET
Bronkoalveoler lavaj (BAL) ve bron?iyal lavaj yap?lan hastalardaki Pneumocystis? jirovecii kolonizasyonu ve tan?da kullan?lan y?ntemlerin kar??la?t?rmas?
Giri?: Pneumocystis jirovecii'nin neden oldu?u Pneumocystis pn?monisi (PCP) ba????kl?k sistemi bask?lanm?? hastalarda en s?k ve ciddi olarak g?zlenen f?rsat?? infeksiyonlardan biridir. ?al??mam?zda g???s hastal?klar? anabilim dal? taraf?ndan klinik ya da poliklinik ortam?nda takip edilen ve tan? ama?l? bronkoskopi yap?lan toplam 100 hastaya ait? bronkoalveoler lavaj (BAL) ve bron?iyal lavaj ?rnekleri de?erlendirildi.
Materyal ve Metod: Al?nan BAL ve bron?iyal lavaj ?rnekleri metenamin g?m?? (Gomori/Grocott), toluidin mavisi O, Wright-Giemsa, boyamalar? ve imm?n floresans antikor (IFA),? nested polimeraz zincir reaksiyonu (PCR) ile de?erlendirildi.
Bulgular: BAL ve bron?iyal lavaj ?rneklerinde metenamin g?m?? (Gomori/Grocott), toluidin mavisi O, Wright-Giemsa boyamalar? ile etken saptanmad?. IFA testiyle 13 hastada P. jirovecii'nin kistleri saptan?rken; nested PCR? ile 16 hastada P. jirovecii'nin DNA's? saptand?. Hem PCR hem IFA testi ile P. jirovecii saptanan toplam 8 hasta mevcuttu. P. jirovecii saptanan hasta ?rnekleri incelendi?inde bu ?rneklerin 13'?n?n BAL oldu?u ve 8'inin bron?iyal lavaj oldu?u g?r?ld?. Olgu gruplar?nda bak?lan ya?, cinsiyet, sigara kullan?m?, hipertansiyon, diabetes mellitus, kronik obstr?ktif akci?er hastal??? (KOAH), serebrovask?ler olay (SVO), konjestif kalp yetmezli?i (KKY), son ?? ayda hastanede yatma ?yk?s?, antibiyotik kullan?m? ve radyolojik bulgular? a??s?ndan de?erlendirildi?inde P. jirovecii pozitifli?iyle aralar?nda istatistiksel olarak anlaml?l?k saptanmad?. Olgu gruplar? PCR ve IFA pozitifliklerine g?re gruplara ayr?larak de?erlendirme yap?ld???nda IFA veya PCR pozitif olgularda imm?ns?presyon a??s?ndan anlaml? farkl?l?k saptand? (p= 0.003). Pozitif olgular?n %28.6's? imm?ns?presif saptan?rken, PCR veya IFA negatif olgular?n %3.8'i imm?ns?presifti. PCR y?ntemi tan?da alt?n standart olarak kabul edilen IFA ile duyarl?l?k ve ?zg?ll?k a??s?ndan k?yasland???nda duyarl?l?k %61.5 ve ?zg?ll?k %90.8 olarak belirlendi.? McNemar testiyle IFA ve PCR tan? testi sonu?lar?n?n uyumlu olduklar? saptand? (p= 0.581).
Sonu?: Bursa b?lgesinde yap?lan bu ?al??mada HIV negatif olgularda imm?ns?prese hastalarda P.? jirovecii g?stermeye y?nelik? boyama y?ntemlerinin duyarl?l??? d???k oldu?u ayr?ca IFA ile nested PCR y?nteminin paralel sonu?lar vermedi?i g?r?lm??t?r.
Anahtar Kelimeler: Pneumocystis jirovecii, bronkoalveoler lavaj, bron?iyal lavaj, imm?ns?presyon, IFA, nested PCR.??
SUMMARY
The Pneumocystis jirovecii colonization in bronchoalveolar lavage (BAL) and bronchial washing and the comparison of methods which are used in diagnosis
Ahmet ?ZMEN1, Re?it MISTIK1,? Oktay ALVER2, Funda CO?KUN3, Ahmet URSAVA?3, Esra UZASLAN3
1 Department of Infectious Diseases and Clinical Microbiology, Faculty of Medicine, Uludag University,
Bursa, Turkey,
2 Department of Microbiology, Faculty of Medicine, Uludag University, Bursa, Turkey,
3 Department of Chest Diseases, Faculty of Medicine, Uludag University, Bursa, Turkey.
Introduction: Pneumocystis pneumonia (PCP) which is caused by Pneumocystis jirovecii is usually seen in the patients whose immune system is supressed. It is seriously seen an opportunist infection. In our study; totally 100 bronchoalveolar lavage (BAL) and bronchial washing samples collected by pulmonary disease department. Which belong to the patients in the clinics, and out patient clinic of the bronchoscopy material were evaluated.
Materials and Methods: The BAL and bronchial washing were evaluated by the help of methenamine silver stain (Gomori/Grocott), toluidine blue O stain, Wright-Giemsa stain, immun fluorescent antibody (IFA) stain, nested polymerase chain reaction (PCR).
Results: In the BAL and bronchial washing samples the agent couldn't be shown by the help of methenamine silver (Gomori/Grocott), toluidine blue O, Wright-Giemsa staining. In 13 patients with IFA test the cysts of P. jirovecii were determined. In 16 patients with nested PCR; the DNA of P. jirovecii were determined. In 8 patients by using PCR and IFA test P. jirovecii was determined. When the samples which had P. jirovecii were analyzed; 13 of them? were BAL and 8 of them were bronchial washing. When the phenomenon groups were evaluated? according to age, gender, smoking, hypertension, diabetes mellitus, chronic obstructive pulmonary disease (COPD), cerebrovascular accident (CVA), congestive cardiac failure (CCF), staying in the hospital in the last three months, using antibiotics and radiological findings; there wasn't a statistical meaningful relation between P. jirovecii positivity? and these situations. When the phenomenon groups were evaluated? according to PCR and IFA positivity; in IFA and PCR positive patients for immunosupressive there was a meaningful differances (p= 0.003). The positive 28.6 % of cases were immunosuppressed and the 3.8% of PCR or IFA negative cases were immunosupressed. When PCR method was compared with IFA which is called gold standard for sensitivity and specificity; sensitivity was found 61.5% and specificity was found 90.8%. IFA and PCR diagnosis test results were compatible (With McNemar test p= 0.581).
Conclusion: Diagnostic sensitivity of staining methods for P. jirovecii in immunocompromised HIV negative patients are found to be low and it was shown that IFA and nested PCR methods have not parallel results.
Key Words: Pneumocystis jirovecii, bronchoalveolar lavage, bronchial washing, immunosupression, IFA, nested PCR.??
Tuberk Toraks 2013; 61(4): 303-311 • doi:10.5578/tt.2954
Geli? Tarihi/Received: 22/10/2011 • Kabul Edili? Tarihi/Accepted: 28/07/2013
G?R??
Pneumocystis jirovecii'nin neden oldu?u Pneumocystis pn?monisi (PCP) imm?ns?prese hastalarda en s?k ve ciddi olarak g?zlenen f?rsat?? infeksiyonlardan biridir (1,2).
P. jirovecii'nin bula?ma yolu tam olarak anla??lamad??? gibi ?evresel kayna?? da tan?mlanamam??t?r (3). Latent infeksiyonun reaktivasyonu savunulmakla birlikte; ?evresel kaynaklardan bula??n yan? s?ra ki?iden ki?iye hava yoluyla bula??n da olas? yol oldu?una dair kan?tlar vard?r (2,3). ?nfekte olmayan ki?iler Pneumocystis'in asemptomatik ta??y?c?s? da olabilirler (3). G?ncel ?al??malar; Pneumocystis'in imm?nkompetan bireylerde veya aktif infeksiyon veya klinik hastal?k bulgusu olmayan HIV pozitif hastalarda da d???k miktarda bulunabildi?ini ortaya koymu?tur (4,5). Tekrar inceleme ile organizmalar?n saptanamamas?, ge?ici asemptomatik P. jirovecii ta??y?c?l??? olabilece?ini d???nd?rmektedir. Buna ek olarak, say?s? g?n ge?tik?e artan yay?nlarda, altta yatan hastal??? olan ba????kl?k sistemi sa?lam konaklarda, P. jirovecii'nin asemptomatik akci?er kolonizasyonu yapabilece?i bildirilmektedir (6,7,8,9,10).
Primer infeksiyonun ?ok yayg?n ve erkenden ge?irildi?ine dair kan?tlar serokonversiyona dayal?d?r. Yirmi ayl?k s?t ?ocuklar?nda antikor pozitifli?i oran? %85 olarak bulunmu?tur (2).
Duyarl? bir konakta PCP'nin ana semptomlar? dispne, ate?, balgams?z ?ks?r?kt?r (11). Hastal???n semptom ve bulgular?yla, g???s radyolojisi bulgular?n?n hi?bir kombinasyonu PCP i?in tan? koydurucu de?ildir (12).
Solunumla ilgili ?ikayetleri, ate?i ve anormal g???s radyografileri olan ve imm?ns?prese herhangi bir hastada PCP d???n?lmelidir (11).
PCP'nin kesin tan?s? balgam, ind?klenmi? balgam, bronkoalveoler lavaj (BAL), bron?iyal lavaj (BL), trakeal aspirasyon veya bron?iyal f?r?alama, AC biyopsisi ve plevral s?v? ?rneklerinde mantar?n morfolojik olarak g?sterilmesiyle konur.
Bu ?rneklerden Pneumocystis'i tan?mlamak i?in ?e?itli boyalar kullan?lmaktad?r. Metenamin g?m?? (Gomori/Grocott), toluidin mavisi O, gibi boyalar kistlerin h?cre duvarlar?n? boyarken, Wright-Giemsa, Gram-Weigert gibi boyalar trofik formu ve intrakistik cisimcikleri boyar (3,11,12,13).
Pneumocystis'in k?lt?rde ?retilememesi ve mikroskobik inceleme i?in ?o?u zaman invaziv bir giri?im gerekmesi nedeniyle molek?ler tan? cazip hale gelmi?tir. PCR testleri BAL, ind?klenmi? balgam ve a??z y?kama s?v?s? ?rneklerinde ?al???lm??t?r (12).
Yap?lan bu ?al??ma ile; BAL ve BL yap?lan hastalardaki kolonizasyon; klinik ve laboratuvar bulgular? uyumlu ise pn?moni tan?s?n?n konulmas?, BAL ve BL ?rneklerinde P. jirovecii saptanan hastalar?n demografik bilgileri, altta yatan hastal?klar?, olas? risk fakt?rleri g?z ?n?nde bulundurularak bu unsurlar?n hastal?kla ili?kisi, hastal?k semptom ve bulgular?n? ta??maks?z?n BAL ve BL ?rneklerinde P. jirovecii tespit edilen hastalar?n yukar?da bahsedilen hasta bilgileri dikkate al?narak kolonizasyon geli?iminde etkili olabilecek unsurlar?n belirlenmesi hedeflenmi?tir.
Yine bu ?al??mada hastalardan al?nan BAL ve BL ?rneklerine May Grunwald/Giemsa, toluidin mavisi, metenamin g?m?? (MS), imm?n floresans antikor (IFA) ve polimeraz zincir reaksiyonu (PCR) uygulayarak bu y?ntemlerin tan?daki duyarl?l?klar? ortaya konulmaya ?al???lm??t?r.
MATERYAL ve METOD
?al??ma Uluda? ?niversitesi T?p Fak?ltesi Hastanesinde Nisan 2010 ile Mart 2011 aras?nda bir y?ll?k s?re i?erisinde toplam 100 hastan?n kat?l?m?yla, yat?r?larak ya da ayaktan takip edilen; gerek?esi ne olursa olsun BAL ya da BL yap?lan hastalar ve bu hastalar?n al?nan BAL ve BL ?rneklerinin Klinik Mikrobiyoloji ve ?nfeksiyon Hastal?klar? Anabilim Dal? Laboratuvar?nda incelenmesiyle yap?ld?.
Al?nan BAL ve BL ?rnekleri ?rnekler santrif?j t?plerine ortalama 5 mL olacak ?ekilde konuldu ve 21?C s?cakl?kta 2000 rpm'de 15 dakika santrif?j edildi. Bu i?lem sonras?nda santrif?j t?p?n?n dibindeki ??keltiden yararlan?larak boyama, PCR, MS, IFA ama?l? 1'er mL Eppendorf t?p?ne konuldu.
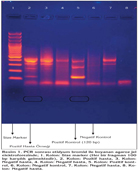
Boyama olarak Modifiye toluidin mavisi ve May Gr?nwald-Giemsa yap?ld?. Metenamin G?m?? boyama SILVER METHENAMINE P.A.S.M.04-043822/L kiti ile ?retici firma olan Bio Optica Milano s.p.a. talimatlar? do?rultusunda ger?ekle?tirilmi?tir. ?mm?n Floresans Antikor Testi Pneumocel D?rect IF Test Ticari Kiti ile ger?ekle?tirildi. Polimeraz zincir reaksiyonu (PCR) i?in al?nan materyaller daha sonra ?al???lmak ?zere -80?C derin dondurucuya kald?r?ld?. Pneumocystis DNA ekstraksiyonu DNA izolasyon kiti (Dr Zeydanl? DNA ?zolasyon Kiti) kullan?larak yap?ld?. Kullan?lan primerler ile P. jirovecii DNA's?n?n mitokondriyal ribozomal RNA's?n?n spesifik 362 bp ve 120 bp sekanslar?n?n amplifikasyonu nested PCR ile ger?ekle?tirildi. Birinci d?ng? PCR primer ?ifti: pAZ102-E (5?-GATGGCTGTTTCCAAGCCCA-3?), pAZ102- H (5?-GTGTACGTTGCAAAGTACTC-3?). Birinci PCR ?r?n? 362 bp. ?kinci d?ng? PCR primer ?ifti (nested PCR; birinci PCR ?r?n? a?a??daki primer ?ifti ile amplifiye edildi): pAZ102- E (5?- GATGGCTGTTTCCAAGCCCA-3?), pAZ102-L2 (5?-ATAAGGTAGATAGTCGAAAG-3?). Nested PCR ?r?n? 120bp.
?lk a?amada her bir hasta ?rne?i i?in 5 ?L Buffer, 1 ?L dNTP (dNTP haz?rlamak i?in dATP, dGTP, dCTP, dTTP her birinden 10 ?L al?nd? 60 ?L distile su ilave edilerek 100 ?L'ye tamamland?) (SibEnzyme), 0.5 ?L pAZ102-E, 0.5 ?L pAZ102-H, 0.4 ?L taq (SibEnzyme) ve 32.6 ?L distile su ilave edilerek 40 ?L reaksiyon kar???m? elde edildi. Elde edilen kar???mdan 40 ?L al?nd? ve hasta ?rne?inden 10 ?L konuldu. PCR'nin ilk a?amas? elde edilen toplam 50 ?L ?rneklerin Thermal Cycler'a (Esco's Swift Maxi Thermal Cycler) yerle?tirilmesiyle tamamland?.
?kinci a?amada her bir hasta ?rne?i i?in 5 ?L Buffer, 1 ?L dNTP, 0.5 ?L pAZ102-E, 0.5 ?L pAZ102-L2, 0.2 ?L taq ve 40.8 ?L distile su ilave edilerek 48 ?L reaksiyon kar???m? elde edildi. Elde edilen kar???mdan 46 ?L al?nd? ve hasta ?rne?inden 4 ?L konuldu. PCR'nin ikinci a?amas? elde edilen toplam 50 ?L ?rneklerin Thermal Cycler' a yerle?tirilmesi ile tamamland?.
?ki a?amal? PCR Thermal Cycler'da 94?C 5 dakika, 94?C 30 saniye, 56?C 30 saniye, 72?C 30 saniye toplam 40 siklus ve 72?C 7 dakika ?eklinde ger?ekle?tirildi.
Bantlar? g?r?nt?lemek i?in PCR ?r?nleri ethidium bromid i?eren %1.5'lik agaroz jelde 45 dakika elektroforez i?lemine tabii tutuldu.
Testte pozitif kontrol (9 Eyl?l ?niversitesi T?p Fak?ltesi Parazitoloji Anabilim Dal?'ndan temin edilen mikroskobik olarak PCP tan?s? konulan hastadan elde edilen BAL ?rne?i) ve olas? kontaminasyonu g?zlemlemek i?in negatif kontrol (steril distile su) ?al??maya dahil edildi.
Olgu gruplar? SPSS 15.0 program? ile de?erlendirildi. Sonu?lar ortalama ? standart hata olarak verildi. Kategorize edilen verilerde ki-kare testi kullanarak istatiksel anlaml?l?k ara?t?r?ld?. p< 0.05 de?eri anlaml? olarak kabul edildi. IFA ve PCR sonu?lar?n?n uyumluluklar? McNemar testiyle de?erlendirildi.
BULGULAR
Al?nan ?rneklerin 47'si BAL, 53'? BL'd?. Bronkoskopi yap?lan hastalar 66 (%66) erkek ve 34 (%34) kad?ndan olu?maktayd?. Hastalar?n ya?lar? 30 ile 81 aras?nda olup, median ya? 58, ortalama ya? 58.89 ? 1.25 olarak bulundu.
P. jirovecii pozitifli?i 100 hastan?n 21'inde saptand?. Pozitiflik saptanan hasta grubu 12 (%57) erkek, 9 (%43) kad?n hastadan olu?maktayd?. Hastalar?n ya?lar? 31 ile 74 aras?nda olup, median ya? 57; ortalama ya? 57.6 olarak bulundu.
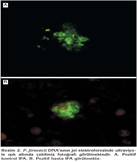
BAL ve BL ?rneklerinde metenamin g?m?? (Gomori/Grocott), toluidin mavisi, Wright-Giemsa boyamalar? ile etken saptanmad?. Nested PCR ile 16 hastada P. jirovecii'nin DNA's? saptand? (Resim 1). ?mm?n floresans antikor (IFA) testiyle 13 hastada P. jirovecii'nin kistleri saptand? (Resim 2 A,B).
Hem PCR hem IFA testiyle P. jirovecii saptanan toplam 8 hasta mevcuttu. PCR y?ntemi tan?da alt?n standart olarak kabul edilen IFA ile duyarl?l?k ve ?zg?ll?k a??s?ndan k?yasland???nda duyarl?l?k %61.5 ve ?zg?ll?k %90.8 olarak belirlendi. McNemar testiyle IFA ve PCR tan? testi sonu?lar?n?n uyumlu olduklar? saptand? (p= 0.581). ?l??m?n hassasiyeti %87, prevalans %50, pozitif kestirim de?eri %50, negatif kestirim de?eri %94, yanl?? negatif oran %38.5 ve yanl?? pozitif oran % 9.2 olarak belirlendi.
Ek hastal??? olan 11 (%52.3) hasta mevcut olup; 6 (%28.5) hastada birden fazla hastal?k mevcuttu. Ek hastal?klar incelendi?inde iki hastada malignite (akci?er kanseri ve primeri belli olmayan metastatik akci?er kanseri), sekiz hastada hipertansiyon, iki hastada diabetes mellitus (DM), d?rt hastada kronik obstr?ktif akci?er hastal??? (KOAH), bir hastada serebrovask?ler olay (SVO), ?? hastada konjestif kalp yetmezli?i (KKY) mevcuttu. Pozitiflik saptanan alt? hastada son ?? ay i?inde imm?ns?presif tedavi al?m ?yk?s? vard? (Tablo 1). ?mm?ns?presif tedavi iki hastada malignite nedeniyle di?er hastalarda ise kollajen doku hastal??? nedeniyle verilmekteydi.
Pozitiflik saptanan 21 hastan?n 13'?nde son ?? ay i?inde hastanede yat?? ?yk?s? mevcuttu.
Pozitiflik saptanan hasta grubunda bronkoskopi; akci?er kanseri, t?berk?loz, sarkoidoz, kronik infeksiyon, interstisyel akci?er hastal???, primer hastal???n akci?er tutulumu, lenfoma, eozinofilik alveolit, pn?moni, diyafram y?ksekli?i, akci?er apsesi, silikozis ve pn?mokonyoz endikasyonlar? ile yap?ld?. Bronkoskopi sonucunda ise akci?er kanseri, t?berk?loz, sarkoidoz, kronik infeksiyon, primer hastal???n akci?er tutulumu, antrakoz, lenfoma, eozinofilik alveolit tan?lar?na ula??ld?.
Pozitiflik saptanan hasta grubundaki hastalar?n klinik bulgular? incelendi?inde ?ks?r?k, balgam, dispne, hemoptizi, g???s a?r?s?, ate? y?ksekli?i ve gece terlemesi oldu?u g?r?ld?. Olgu grubundaki iki hastada ise hi?bir klinik bulgu yoktu (Tablo 2).
Pozitiflik saptanan 10 hastada bronkoskopinin yap?ld??? g?nden itibaren son ?? ay i?inde takip edildikleri merkezler taraf?ndan ampirik olarak ba?lanan sefalosporin, kinolon, azol, beta-laktam/beta-laktamaz inhibit?r kombinasyonu, makrolit, karbapenem grubu antibiyotiklerin de?i?en s?relerde kullan?m? mevcuttu.
Pozitiflik saptanan hasta grubunda bulunan 12 hastada sigara kullan?m? mevcuttu.
Olgu gruplar?nda bak?lan ya?, cinsiyet, sigara kullan?m?, hipertansiyon, DM , KOAH, SVO, KKY, son 3 ayda hastanede yatma ?yk?s? ve antibiyotik kullan?m?, kullan?lan antibiyotiklerin tekli ve ?oklu kullan?m? de?erlendirildi?inde P. jirovecii pozitifli?iyle aralar?nda istatistiksel olarak anlaml?l?k saptanmad?.
Olgu gruplar? PCR ve IFA pozitifliklerine g?re gruplara ayr?larak de?erlendirme yap?ld???nda IFA veya PCR pozitif olgularda imm?ns?presyon a??s?ndan anlaml? farkl?l?k saptand? (p= 0.003). Pozitif olgular?n %28.6's? imm?ns?prese iken, PCR veya IFA negatif olgular?n %3.8'i imm?ns?prese idi (?ekil 1).
Radyolojik olarak PCP d???n?len 23 hastan?n 7'sinde IFA ya da PCR ile pozitiflik saptand?. ?statistiksel farkl?l?k saptanmad?.
TARTI?MA
P. jirovecii HIV pozitif bireylerde, konnektif doku hastal??? ile hematolojik malignitesi olanlarda ve organ transplantasyonu yap?lan hastalarda hayat? tehdit eden infeksiyona neden olan f?rsat?? bir patojendir (14). ?zellikle HIV pozitif hastalarda PCP insidans? antiretroviral tedavinin kullan?ma girmesiyle belirgin olarak azalm??t?r (15).
Yap?lan serolojik ?al??malar ?ok say?da ?ocukta etkene kar?? ya?am?n erken d?neminde spesifik antikor olu?tu?unu g?stermi?tir (16,17,18). Bununla beraber yap?lan insan ve hayvan ?al??malar? etkenin infeksiyondan sonra v?cuttan b?y?k ?l??de elimine edildi?i ancak s?n?rl? say?da organizman?n latent kald??? ?eklindedir (19,20).
PCP latent infeksiyonun reaktivasyonundan ya da kendili?inden meydana gelebilir (21). Bununla beraber mikroskobik ya da imm?n floresan y?ntemlerin kullan?ld??? otopsi ?al??malar? g?stermi?tir ki imm?nkompetan hastalarda P. jirovecii yoktur ya da son derece d???k (< %1) d?zeydedir (22,23,24). PCR mikroskopi ya da imm?n floresana g?re son derece duyarl? bir y?ntemdir ve P. jirovecii trofozoitlerinin d?zeyi ?ok d???k olsa bile PCR ile saptanmaktad?r. Yine de imm?nkompetan olan pozitiflik saptanmayan bireylerde postmortem akci?er dokusundan ?al???lan PCR ?rnekleri ile P. jirovecii'nin varl??? g?sterilmi?tir (25). ?te yandan kan?tlanm?? P. jirovecii infeksiyonu olmayan imm?ns?prese hastalar?n BAL ?rnekleri de dahil solunum ?rneklerinden d???k trofozoid d?zeyleri nedeniyle etken mikroskobik y?ntemlerle g?sterilememekte ama PCR ile saptanmaktad?r. Az say?daki trofozoit varl??? kolonizasyon olarak yorumlanabilir (26). Yak?n zamanda HIV pozitif bireyler aras?nda y?ksek oranda mutant P. jirovecii genlerinin bulundu?u bunlar?n belli b?lgelerde lokalize oldu?u ki?iden ki?iye direkt ya da ?evresel kaynaklardan olmak ?zere aktar?ld??? kan?tlanm??t?r (27). Ayn? zamanda P. jirovecii'nin yay?l?m?nda PCP (+) imm?ns?prese hastayla temas? olan sa?l?k ?al??anlar?n?n da arac? oldu?u kan?tlanm??t?r (28). PCP'li hastalar, imm?nsuprese ta??y?c?lar ya da imm?nkompetan olup ge?i?i olarak parazitemili ki?iler Pneumocystis infeksiyonu i?in kaynak olu?turmaktad?r (29). Herhangi bir kronik akci?er hastal??? olan imm?nkompetan bireylerde solunum sistemi ?rneklerinin imm?n floresan boyama ve PCR ile incelenmesiyle ta??y?c?l?k %10-40 olarak bulunmu?tur (27,28).
Bizim ?al??mam?zda bronkoskopi yap?lan 100 hastan?n 21'inde P. jirovecii pozitifli?ini IFA ve nested PCR y?ntemi ile saptad?k. BAL ve BL ?rneklerinde metenamin g?m?? (Gomori/Grocott), toluidin mavisi, Wright-Giemsa boyamalar? ile etken saptanmad?. ?mm?n floresans (IFA) testi ile 13 hastada P. jirovecii'nin kistleri saptand?. Nested PCR ile 16 hastada P. jirovecii'nin DNA's? saptand?. Hem PCR hem IFA testi ile P. jirovecii saptanan toplam 8 hasta mevcuttu.
Tipirneni ve arkada?lar? hastane personeli aras?nda yapt?klar? bir ?al??mada g???s hastal?klar?, yo?un bak?m HIV/AIDS hastalar?n?n bak?m?n?n yap?ld??? b?l?mlerde ?al??an HIV ile infekte veya PCP ?li hastalara klinik ve laboratuvar hizmeti vermekte olan 126 personeli incelemi?lerdir (30). Kat?lan personelde P. jirovecii maj?r y?zey glikoprotein d?zeylerine bak?lm??t?r, (MsgC HIV infekte hastalar aras?nda PCP olanlar? ay?rt etmek i?in kullan?lan temel antijenik belirte?tir). Klinik ?al??anlar?nda MsgC1 antikor d?zeyleri klinik d??? ?al??ma grubuna g?re ?nemli derecede y?ksek saptanm??t?r. Bu bulgularla PCP'li hastalarla ya da P. jirovecii ile kolonize ?ah?slar ile temas? olan hastane personelinde P. jirovecii ile kolonizasyon olabilir ?eklinde bir sonuca varm??lard?r.
Medrano ve arkada?lar? son bir y?l i?inde hastane ?evresine maruz kalmam?? ve herhangi bir nedenden imm?ns?presyonu, malignitesi ya da kronik akci?er hastal??? ya da ??phesi olmayan 50 ki?inin kat?l?m?yla bir ?al??ma yapm??t?r (31). P. jirovecii PCR'? yap?lm??t?r. Olgular?n %20'sinde pozitifliklik saptanm??. P. jirovecii'nin sa?l?kl? bireylerin solunum sistemlerinden izole edildi?i ve genel pop?lasyondaki bu bireylerin hastal?k i?in kaynak olduklar? sonucuna var?lm??t?r.
Bizim ?al??mam?zda olgular herhangi bir g???s hastal?klar? semptomu ile bronkoskopi yap?lma endikasyonu alan hastalardan olu?maktayd?. Hastalardaki mevcut klinik bulgular altta yatan akci?er hastal?klar?na ba?l? oldu?u d???n?lm?? olup; antibiyotik kullan?m? olan hastalarda verilen tedavi nonspesifik olup PCP ile ili?kili de?ildir. Saptanan pozitiflikler kolonizasyon lehine yorumlanm??t?r. Tipirneni ve Medrano'nun ?al??malar? da asl?nda hasta olmayan grupta bile temas ile kolonizasyon geli?ebilece?ini g?stermektedir (30,31).
Takahashi ve arkada?lar? solunum sistemi bulgular? ya da anormal g???s radyoloji bulgular? olan 81 hastan?n BAL ?rneklerini incelemi?lerdir (32). ?rnekler HIV pozitif, imm?ns?prese ve primer pulmoner hastal??? olan hastadan elde edilmi? ve PCP tan?s? ?rneklerin boyanmas? ve P. jirovecii'nin DNA's?n?n PCR ile tesbiti ile konulmu?tur. P. jirovecii boyama ile HIV pozitif olan olgularda %57.7, HIV negatif olan imm?ns?prese hastalarda %20 olarak tespit edilmi?tir. Boyama negatif oldu?u halde PCR ile HIV pozitif 7 (%26.9) hastada; imm?ns?prese 4 (%8.9) hastada P. jirovecii tespit ettiklerini bildirmi?lerdir.
Bizim ?al??mam?zda HIV pozitif hasta yoktu. Ancak steroid ve kemoterapotik kullan?m? nedeniyle imm?ns?prese kabul edilen hastalar mevcuttu. Olgular PCR ve IFA pozitifliklerine g?re gruplara ayr?larak de?erlendirme yap?ld???nda IFA veya PCR pozitif olgularda imm?ns?presyon a??s?ndan anlaml? farkl?l?k saptand? (p= 0.003). Pozitif olgular?n %28.6's? imm?ns?prese saptan?rken, PCR veya IFA negatif olgular?n %3.8'i imm?ns?preseydi. Bu da kolonizasyon ya da infeksiyonun do?rudan imm?ns?presyon ve/veya imm?nyetmezlikle ili?kili oldu?unu g?sterebilir.
?al??malar g?stermektedir ki IFA geleneksel sitokimyasal boyamalara (Giemsa, metenamin g?m??, ve modifiye toluidin mavisi) g?re daha ?st?nd?r ve bu y?ntem PCP tan?s?nda alt?n standart olarak kan?tlanm?? bir y?ntemdir (33,34). PCP'nin laboratuvar tan?s?nda esas olarak BAL ile al?nan ?rnekler kullan?lmaktad?r. PCP tan?s?nda P. jirovecii genlerinin kullan?ld??? PCR y?ntemi de duyarl?l??? y?ksek bir y?ntemdir. ?al??mam?zda al?nan BAL ve BL ?rneklerinde geleneksel sitokimyasal boyama ile P. jirovecii saptamad?k. Bunun bir?ok sebebi olabilir. Bunlar aras?nda laboratuvar?m?zda daha ?nce bu ?al??malar?n yap?lmam?? olu?u, de?erlendirme i?in deneyim gereksinimi ve ayn? zamanda HIV negatif olan olgu grubumuzda ki hastalar?n mantar y?k?n?n d???k ve belki de geleneksel boyama y?ntemlerinin duyarl?l???n?n da d???k olu?u say?labilir.
Caliendo ve arkada?lar?n?n solunum yolu ?rneklerinde PCP tan?s?n? koymada PCR'nin performans?n? de?erlendirmek i?in yapt?klar? ?al??mada 168 hastadan 232 klinik ?rnek (120 ind?klenmi? balgam ve 112 BAL) elde edilmi?; hastalar HIV pozitif olanlar, transplant al?c?lar? ve imm?ns?presif tedavi alanlardan olu?uyormu? (35). Al?nan ?rnekler PCR ve IFA ile de?erlendirilmi?. BAL ?rneklerinin PCR ve IFA ile duyarl?l??? ve ?zg?ll??? k?yasland???nda s?ras?yla %100 ve %98 bulunmu?tur. ?nd?klenmi? balgam ?rneklerinin IFA ve PCR ile duyarl?l??? s?ras?yla %82 ve %95 olarak hesaplanm??t?r. ?al??mam?zda PCR y?ntemi IFA'ya g?re literat?rle uyumsuz ?ekilde daha az duyarl? ??km??t?r. Bizim ?al??mam?zda IFA ile 13 hastada P. jirovecii'nin kistleri saptand?. Nested PCR ile 16 hastada P. jirovecii'nin DNA's? saptand?. Hem PCR hem IFA testi ile P. jirovecii saptanan toplam 8 hasta mevcuttu. PCR y?ntemi tan?da alt?n standart olarak kabul edilen IFA ile duyarl?l?k ve ?zg?ll?k a??s?ndan k?yasland???nda duyarl?l?k %61.5 ve ?zg?ll?k %90.8 olarak belirlendi. McNemar testi IFA ve PCR tan? testi sonu?lar?n?n uyumlu olduklar? saptand? (p= 0.581). PCR'nin tan?da kullan?lan son derece duyarl? bir y?ntem olmas?na ra?men PCR ile IFA aras?nda tam korelasyonun sa?lanamamas? kulland???m?z nested PCR y?nteminin in house olarak optimize edilen ve standardize edilememi? bir y?ntem olmas?na ba?l? olabilir.
P. jirovecii'nin klinik, radyolojik ve laboratuvar y?ntemleriyle tan?s?n? koymak son derece g??t?r. Ayr?ca, pratik uygulamada kolonizasyon ile infeksiyonu ay?rt ettirecek bir tan? y?ntemi de yoktur. PCP ile yap?lan ?al??malar HIV pozitif hasta grubu ?zerinde yo?unluk kazanmaktad?r. Bu hastalarda imm?nyetmezli?in ciddi boyutlarda olmas? CD4 h?cre say?s?n?n d???kl??? ve v?cutta ki P. jirovecii y?k?n?n y?ksekli?i nedeniyle konvansiyonel boyama y?ntemleriyle etkeni ortaya koymak m?mk?n olmaktad?r. Ancak bizim inceledi?imiz hasta grubunda etkin bir imm?ns?presyonun olmamas? ve dolay?s?yla etken mikroorganizma y?k?n?n d???kl??? nedeniyle konvansiyonel boyama y?ntemleriyle P. jirovecii saptanamad?.
Molek?ler y?ntemler P. jirovecii DNA's?n? saptamak amac?yla kullan?lan y?ksek duyarl?l??a sahip y?ntemlerdir. PCR kullan?larak asemptomatik (kolonize) ya da subklinik infeksiyonu olan hastalar? ortaya koymak m?mk?nd?r. Molek?ler y?ntemler i?inde de real t?me PCR nested PCR'ye g?re ?st?nl??? olan bir y?ntemdir. Ayr?ca, real time PCR'de kantitatif sonu? elde edilmektedir ve belli cut off de?erleri baz al?narak hastada PCP ya da kolonizasyon y?n?nde yorum yapmak m?mk?n olmaktad?r.
SONU?
Sonu? olarak? Bursa b?lgesinde yap?lan bu ?al??mada HIV negatif olgularda imm?ns?prese hastalarda P. jirovecii g?stermeye y?nelik boyama y?ntemlerinin duyarl?l??? d???k oldu?u ayr?ca IFA ile nested PCR y?nteminin paralel sonu?lar vermedi?i g?r?lm??t?r. Ayn? hasta ?rneklerinde alt?n standart olan IFA standart ticari kiti ile saptanan pozitifliklerin daha anlaml? olaca?? a??kt?r. IFA ile yap?lan testlerde deneyimli bir g?zle hasta ?rnekleri de?erlendirildi?inde kesin pozitiflikten bahsedilebilir. ?mm?nsupresif hastalarda P. jirovecii kolonizasyonu anlaml? derecede y?ksek bulunmu?tur fakat bunun hastal?k ya da kolonizasyon hakk?nda yorum yapmak i?in yeterli olmad??? da g?r?lm??t?r.
?IKAR?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Medrano FJ, Montes-Cano M, Conde M, de la Horra C, Respaldiza N, Gasch A, et al. Pneumocytis jirovecii in general population. Emerg Infect Dis 2005; 11: 245-250.
- Stringer JR. Antigenic variation in pneumocystis. J Eukaryot Microbiol 2007; 54: 8-13.
- Thomas CFJ, Limper AH. Pneumocytis pneumoniae. N Engl J Med 2004; 350: 2487-98.
- Weishbroth SH. Pneumocytis: newer knowledge abouth the biology of this group of organisms in laboratory rats and mice. Lab Anim (NY) 2006; 35: 55-61.
- Kaneshiro ES. Sterol metabolism in the opportunistic pathogen Pneumocytis: advances and new insights. Lipids 2004; 39: 753-61.
- Daly KR, Koch J, Levin L, Walzer PD. Emzyme-linked immunosorbent assay and serologic responses to Pneumocytis jirovecii. Emerg Infect Dis 2004; 10: 848-54.
- Medrano FJ, Montes-Cano M, Conde M, de la Horra C, Respaldiza N, Gasch A, et al. Pneumocytis jirovecii in general population. Emerg Infect Dis 2005; 11: 245-50.
- Peterson JC, Cushion MT. Pneumocytis: not just pneumonia. Curr Opin Microbiol 2005; 8: 393-8.
- Miller RF, Ambrose HE, Wakefield AE. Pneumocystis carini f. sp. hominis DNA in immunocompetent healthcare workers in contact with patients with P. carinii pneumonia. J Clin Microbiol 2001; 39: 3877-82.
- Wakefield AE, Lindley AR, Ambrose HE, Denis CM, Miller RF.? Limited asymptomatic carriage of Pneumocystis jirovecii in human immunodeficiency virus-infected patients. J Infect Dis 2003; 187: 901-8.
- Walzer PD, Smulian AG. Pneumocytis species. In: Mandell GL, Bennett JE, Dolin R (eds). Principles and Practatice of Infectious Diseases. Philadelphia: Elsevier Churchill Livingstone, 2010: 3377-87.
- Sing A, Roggenkamp A, Autenrieth IB, Heesemann J. Pneumocystis carinii carriage in immunocompetent patients with primary pulmonary disorders as detected by single or nested PCR. J Clin Microbiol 1999; 37: 3409-10.
- Morris A, Sciurba FC, Lebedeva IP, Githaiga A, Elliott WM, Hogg JC, et al. Association of chronic obstructive pulmonary disease severity and Pneumocystis colonization. Am J Respir Crit Care Med 2004; 170: 408-13.
- Durand-Joly I, Soula F, Chabe M, Dalle JH, Lafitte JJ, Senechal M, et al. Long-term colonization with Pneumocystis jirovecii in hospital staffs: a challenge to prevent nosocomial pneumocystosis. J Eukaryot Microbiol 2003; 50(Suppl): 614-5.
- Bartlett MS, Vermund SH, Jacobs R, Durant PJ, Shaw MM, Smith JW, et al. Detection of Pneumocystis carinii DNA in air samples: likely environmental risk to susceptible persons. J Clin Microbiol 1997; 35: 2511-3.
- Olsson M, Lidman C, Latouche S, Bj?rkman A, Roux P, Linder E, et al. Identification of Pneumocystis carini f. sp. hominis gene sequences in filtered air in hospital environments. J Clin Microbiol 1998; 36: 1737-40.
- Nevez G, Raccurt C, Jounieaux V, Dei-Cas E, Mazars E. Pneumocystosis versus pulmonary Pneumocystis carinii colonization in HIV-negative and HIV-positive patients. AIDS 1999; 13: 535-56.
- Dei-Cas E. Pneumocystis infections: the iceberg? Med Mycol 2000; 38(Suppl 1): 23-32.
- Hughes WT. Pneumocystis carinii pneumonia. N Engl J Med 1977; 297: 1381-3.
- Weverling GJ, Mocroft A, Ledergerber B, Kirk O, Gonz?les-Lahoz J, d'Arminio Monforte A, et al. Discontinuation of Pneumocystis carinii pneumonia prophylaxis after start of highly active antiretroviral therapy in HIV-1 infection. Lancet 1999; 353: 1293-8.
- Meuwissen JH, Tauber I, Leeuwenberg AD, Beckers PJ, Sieben M. Parasitologic and serologic observations of infection with Pneumocystis in humans. J Infect Dis 1977; 136: 43-9.
- Pifer LL, Hughes WT, Stagno S, Woods D. Pneumocystis carini infection: evidence for high prevalence in normal and immunosuppressed children. Pediatrics 1978; 61: 35-41.
- Medrano FJ, Respaldiza N, Medrano A, Varela JM, Montes-Cano M, de La Horra C, et al. Seroprevalence of Pneumocystis human infection in southern Spain. J Eukaryot Microbiol 2003; 50(Suppl): 649-50.
- Chen F, Gigliotti F, Harmsen AG. Latency is not an inevitable outcome of infection with Pneumocystis carinii. Infect Immun 1993; 61: 5406-9.
- O'Donnell WJ, Pieciak W, Chertow GM, Sanabria J, Lahive KC. Clearance of Pneumocystis carinii cystic in acute P. carinii pneumonia: assessment serial sputum induction. Chest 1998; 114: 1264-8.
- Vogel CL, Cohen MH, Powell RD, DeVita VT. Pneumocystis carinii pneumonia. Ann Intern Med 1968; 68: 97-108.
- Millard PR, Heryet AR. Observations favouring Pneumocystis carinii pneumonia as a primary infection: a monoclonal antibody study on paraffin sections. J Pathol 1988; 154: 365-70.
- Peter SE, Wakefield AE, Sinclair K, Millard PR, Hopkin JM. A search for Pneumocystis carinii in post-mortem lungs by DNA amplification. J Pathol 1992; 166: 195-8.
- Miller RF, Ambrose HE, Wakefield AE. Pneumocystis carinii f. sp hominis DNA in immunocompetent health care workers in contact with patients with P. carinii pneumonia. J Clin Microbiol 2001; 39: 3877-82.
- Vargas SL, Ponce CA, Gigliotti F, Ulloa AV, Prieto S, Mu?oz MP, et al. Transmission of Pneumocystis carinii DNA from a patient with P. carinii pneumonia to immunocompetent contact health care workers. J Clin Microbiol 2000; 38: 1536-8.
- Eisen D, Ross BC, Fairbairn J, Warren RJ, Baird RW, Dwyer B. Comparison of Pneumocystis carinii detection by toluidine blue O staining, direct immunofluorescence and DNA amplification in sputum specimens from HIV patients. Pathology 1994; 26: 198-200.
- Helweg-Larsen J, Jensen JS, Benfield T, Svendsen UG, Lundgren JD, Lundgren B. Diagnostic use of PCR for detection of Pneumocystis carinii in oral wash samples. J Clin Microbiol 1998; 36: 2068-72.
- Tipirneni R, Daly KR, Jarlsberg LG, Koch JV, Swartzman A, Roth BM, et al. Healthcare worker occupation and immune response to Pneumocystis jirovecii. Emerg Infect Dis? 2009; 15: 1590-7.
- Medrano FJ, Montes-Cano M, Conde M, Horra C, Respaldiza N, Gasch A, Perez-Lozano MJ, Varela JM and Caldero EJ. Pneumocystis jirovecii in General Population. Emerging Infectious Diseases • www.cdc.gov/eid • 2005; 11: 245-50.
- Hadley? WK & NG, V.? Pneumocystis. In: Murray PR,? Baron? EJ, Pfaller? MA,? Tenover FC, Yolken RH (eds). Manual of Clinical Microbiology. 6th ed. Washington: ASM Press, 1995:? 738-48.
Yaz??ma Adresi (Address for Correspondence):
Dr. Funda CO?KUN,
Uluda? Universitesi T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
BURSA - TURKEY
e-mail: fundacoskun@gmail.com