Plazma D-dimer d?zeyleri akci?er kanserinde prognoz i?in bir belirte? olabilir mi?
Bahar KURT, ?zlem KAR KURT, Defne KALAYCI, Tuncer TU?, Fahrettin TALAY
Abant ?zzet Baysal ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Bolu.
?ZET
Plazma D-dimer d?zeyleri akci?er kanserinde prognoz i?in bir belirte? olabilir mi?
Giri?: T?m?r b?y?mesi ve yay?lmas?yla ili?kili olabilen hemostatik aktivasyonun dola??mdaki belirte?lerinin plazma konsantrasyonlar? malignitede prognozu tahmin etti?i g?sterilmi?tir. Bu ?al??ma akci?er kanserinde plazma D-dimer d?zeyinin prognostik de?erini ara?t?rmak i?in tasarlanm??t?r.
Materyal ve Metod: Akci?er kanserli 138 hastada [98 k???k h?creli d??? akci?er kanseri (KHDAK), 40 k???k h?creli akci?er kanseri (KHAK)] plazma D-dimer d?zeyleri herhangi bir tedavi ba?lamadan ?nce ve her kemoterapi ?ncesi ?l??ld?.
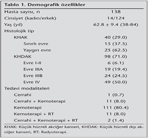
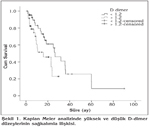
Bulgular: ?al??mada 124 (%89.9) erkek ve 14 (%10.1) kad?n vard?. Ortalama ya?? 62.8 y?l (aral??? 38-84) idi. KHDAK hastalar? i?in histopatolojik tipler aras?nda istatistiksel olarak anlaml? bir fark yoktu. Evre IIIA KHDAK grubu, evre I-II ve IV'e g?re istatistiksel olarak anlaml? derecede y?ksek D-dimer d?zeyine sahipti. Progresif hasta grubunda 4. k?r sonras?nda D-dimer d?zeyinin anlaml? ?ekilde artt??? g?r?ld?. KHDAK hastalar?nda ortanca sa?kal?m s?resi, d???k D-dimer d?zeyi (≤ 1.2 ng/L) olan hastalarda 26.6 ay (%95 GA 17.6-35.6) ve y?ksek D-dimer (> 1.2 ng/L) olanlarda ise 15.9 ay (%95 GA, 4.2-27.7; p= 0.037) idi. Cox-regresyon analizinde, D-dimer plazma seviyesi ve t?m?r evresi sa?kal?m?n ba??ms?z prediktif fakt?rleri olarak tespit edilmi?tir.
Sonu?: Bu sonu?lar plazma D-dimer d?zeyinin akci?er kanserinde azalm?? sa?kal?m ve tedaviye k?t? yan?t?n bir belirteci olarak kullan?labilece?ini d???nd?rm??t?r.
Anahtar Kelimeler: Akci?er kanseri; D-dimer; sa?kal?m; prognoz.
SUMMARY
Could plasma D-dimer levels be a predictive marker for prognosis in lung cancer?
Bahar KURT, ?zlem KAR KURT, Defne KALAYCI, Tuncer TU?, Fahrettin TALAY
Department of Chest Diseases, Faculty of Medicine, Abant Izzet Baysal University, Bolu, Turkey.
Introduction: Plasma concentrations of circulatory markers of hemostatic activation which may be associated with tumor growth and dissemination have been shown to predict prognosis in malignancy. The present study was designed to investigate the prognostic value of plasma D-dimer level in lung cancer.
Materials and Methods: Plasma levels of the D-dimer in 138 lung cancer patients [98 non-small cell lung cancer (NSCLC), 40 small cell lung cancer (SCLC)] were measured before the initiation of any therapy and each chemotherapy.
Results: There were 124 (89.9%) men and 14 (10.1%) women with a mean age of 62.8 years (range 38-84). There were no statistically significant differences among the histopathologic types for NSCLC patients. Stage IIIA NSCLC group had statistically significant higher D-dimer level than stages I-II and IV. D-dimer levels were increased significantly after 4 cycles of chemotherapy in progressive disease. The median survival times in NSCLC patients were 26.6 months (95% CI, 17.6-35.6) and 15.9 months (95% CI, 4.2-27.7; p= 0.037) respectively, for patients with a low D-dimer level (≤ 1.2 ng/L) and a high D-dimer level (> 1.2 ng/L).With the cox-regression analysis, the plasma level of D-dimer and tumour stage were identified as independent predictive factors of the survival.
Conclusion: These results suggest that plasmalevel of D-dimer can act as a predictive factor of decreased survival and a poor response to the treatment in lung cancer.
Key Words: Lung cancer; D-dimer; survival; prognosis.
Tuberk Toraks 2013; 61(4): 269-274 • doi:10.5578/tt.6128
Geli? Tarihi/Received: 10/05/2013 • Kabul Edili? Tarihi/Accepted: 05/09/2013
G?R??
Kanser ve hemostaz aras?ndaki ili?ki, yap?lan deneysel ve klinik ?al??malarla g?sterilmi?tir. Kanser hastalar?nda ven?z tromboemboli olmaks?z?n koag?lasyon sisteminin aktivasyonu ve prokoag?lan de?i?iklikler s?kl?kla g?zlenmi?tir (1,2). ?stelik trombin olu?umu ile fibrin olu?umu ve y?k?m?n? i?eren koag?lasyon aktivasyonu anjiyogenez, t?m?r invazyonu, progresyonu ve metastazda da sorumlu tutulmu?tur. T?m?r h?creleri, hemotojen yay?l?mla t?m?r stroma olu?umunda ?nemli rol? olan fibrinin depolanmas?n? ve koag?lasyon sistemini lokal olarak aktive eden g??l? prokoag?lan maddeler salarlar (3). Fibrin y?k?m ?r?nlerinin g??l? anjiyogenik ?zelliklere sahip oldu?u g?sterilmi?tir (4). D-dimer, fibrin y?k?m ?r?n? olup, hemostaz ve fibrinoliz aktivasyonunu g?steren bir biyolojik belirte?tir. Akut ven?z tromboemboli (VTE)'den ??phe edilen durumlarda klinik parametrelerle birlikte bak?lmaktad?r. D-dimer, ayn? zamanda kanser, gebelik, infeksiyon, travma ve cerrahi gibi durumlarda da y?kselir (5). Kanser s?kl?kla koag?lasyon sisteminin aktivasyonuyla ili?kilidir ve bu aktivasyonun yayg?nl??? meme, kolorektal ve akci?er kanserinde ileri t?m?r evresi, olumsuz sonu?lar ve hastan?n prognozuyla ili?kili oldu?u bildirilmi?tir (6). Bu durum ?e?itli kanser tiplerinde k?t? prognozla ili?kili bulunmu?tur.
Bu ?al??mada ama?, akci?er kanserli hastalarda takipte D-dimer de?erlerinin tedavi yan?t? ve progresyon de?erlendirmesi i?in bir belirte? olup olamayaca??n?n ?l??lmesidir.
MATERYAL ve METOD
Klini?imizde 2006-2012 y?llar? aras?nda, histolojik ve/veya sitolojik olarak akci?er kanseri tan?s? konulan ?e?itli evrelerde toplam 138 hasta ?al??maya dahil edildi. ?al??mayla ilgili hastanemiz lokal etik kurulundan onay al?nd? ve hastalar?m?za bilgilendirilmi? onam formlar? imzalat?ld?. Histolojik t?m?r tipi D?nya Sa?l?k ?rg?t? (DS?) Uluslararas? histolojik s?n?flamas?na g?re belirlenmi?tir. Hastalar?n evresi, konvansiyonel radyografi, toraks ve beyin bilgisayarl? tomografi (BT) incelemeleri, abdominal ultrasonografi (USG), t?m v?cut kemik sintigrafisi ve fiberoptik bronkoskopik incelemeleri sonucunda TNM s?n?flamas?na g?re belirlendi. Hastalar k???k h?creli akci?er kanseri (KHAK) s?n?rl? ve yayg?n hastal?k, k???k h?creli d??? akci?er kanseri (KHDAK) evre I, II, IIIA, IIIB ve IV olmak ?zere grupland?. Tan?dan itibaren ba?lang?? ve her kemoterapi ?ncesi serum D-dimer de?erleri STA-Liatest D-Di kitiyle imm?not?rbidimetrik y?ntem kullan?larak ?l??ld?, cut-off de?eri 1.2 ng/L kabul edildi. Tedaviye yan?t RECIST kriterlerine g?re yap?ld?. Takip program? 3-4 haftal?k aral?klarla yap?lan klinik ve laboratuvar de?erlendirmeden olu?uyordu. BT ve USG ile her ?? k?r kemoterapi sonras?nda yan?t de?erlendirildi Takip program?n? terk eden hastalar?n durumu hakk?nda hasta veya ailesiyle telefon g?r??mesi yap?ld?. Genel sa?kal?m tan? tarihinden itibaren son kontrol tarihi veya ?l?m tarihine kadar d?nem olarak tan?mland?.
?statistik
?statistiksel analizler SPSS versiyon 20 yaz?l?m? kullan?larak yap?ld?. De?i?kenlerin normal da??l?ma uygunlu?u g?rsel ve analitik y?ntemlerle (Kolmogrov-Smirnov/Shapiro-Wilk testleri) incelendi. Her kemoterapi sonras? bak?lan D-dimer de?erlerinin de?i?iminin istatistiksel anlaml?l??? Friedman testi kullan?larak incelendi. Gere?i halinde ikili kar??la?t?rmalar Wilcoxon testi kullan?larak yap?ld? ve Bonferroni d?zeltmesi kullan?larak de?erlendirildi. Sa?kal?m h?zlar? Kaplan-Meier y?ntemiyle hesapland?. Sa?kal?m? etkileyen ba??ms?z etkenler Cox regresyon analizi kullan?larak incelendi. p de?erinin 0.05'in alt?nda oldu?u durumlar istatistiksel olarak anlaml? sonu?lar olarak de?erlendirildi.
BULGULAR
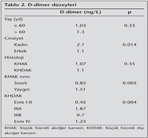
Hastalar?n 124 (%89.9)'? erkek, 14 (%10.1)'? kad?n, ya? ortalamas? 62.8 ? 9.4 (38-84) idi (Tablo 1). KHAK'l? hasta say?s? 40 (%29.0), KHDAK'l? hastalar?n say?s? ise 98 (%71.0) idi. KHDAK'da histoloji tipleri aras?nda ba?lang?? D-dimer d?zeyleri aras?nda farkl?l?k saptanmad?. Altm?? ya? ve alt?ndaki grup ile 60 ya??n ?zerindeki hastalar?n ortanca D-dimer seviyeleri farkl? de?ildi (Tablo 2). Kad?nlarda ortanca D-dimer seviyesi, erkeklerden fazlayd? (2.7 ng/L'ye kar??n 1.1 ng/L; p= 0.014). KHAK ile KHDAK aras?nda tedavi ?ncesi bak?lan D-dimer d?zeyleri aras?nda farkl?l?k saptanmad?. KHAK yayg?n hastal?kta ortanca D-dimer seviyesi (1.51 ng/L), s?n?rl? hastal?ktan (0.85 ng/L), istatistiksel anlaml? olarak y?ksek saptand? (p= 0.005). KHDAK evre I-II'de D-dimer d?zeyi 0.45 ng/L, IIIA'da 1.87 ng/L, IIIB'de 0.70 ng/L ve evre IV'te 1.23 ng/L saptand?, farkl?l?k istatistiksel olarak anlaml?yd? (p= 0.004). Yan?t de?erlendirilmesi yap?lan 69 hastan?n, 4 (%5.8)'?nde tam yan?t, 17 (%24.6)'sinde k?smi yan?t, 3 (%4.3)'?nde stabil hastal?k ve 45 (%65.2)'inde progresyon izlendi. Bu gruplar aras?nda ba?lang?? D-dimer d?zeyleri aras?nda farkl?l?k saptanmad?. Ancak 4. k?rden itibaren D-dimer d?zeyleri progresif hastal?kta anlaml? olarak y?kselmekteydi.
KHDAK'da ba?lang??ta bak?lan D-dimer seviyesi ≤ 1.2 olan grupta ortanca sa?kal?m 26.6 ay (%95 CI 17.6-35.6), > 1.2 olan grupta 15.9 (%95 CI, 4.2-27.7), p= 0.037 saptand? (?ekil 1). KHAK'da D-dimer seviyesi ≤ 1.2 ve > 1.2 olan gruplar aras?nda sa?kal?m y?n?nden istatistiksel farkl?l?k saptanmad?. Cox regression modelinde KHDAK ve KHAK'da evre ile birlikte D-dimer prognozu belirleyen fakt?rlerdi (Tablo 3).
TARTI?MA
Hemostatik sisteminin aktivasyonu, t?m?r geli?imi, t?m?r?n yay?lmas? ve metastastaz?nda ?nemli bir rol oynamaktad?r (7,8,9,10,11). Trombin, fibrin olu?umuna yol a?ar ve bu t?m?r h?cresinin b?y?mesi ve anjiyogenezinde bir rol oynar. Ayr?ca, kanser dokusu i?inde fibrin birikmesinin inflamatuvar h?crelere kar?? koruyucu bir bariyer olarak hareket etti?i g?sterilmi?tir (9). Plazminojen aktivat?rleri, bir aktif serin proteazolan plazmin ?retir. Plazmin t?m?r?n invazyonunda ve t?m?r h?crelerinin dola??m sistemine girmesinde rol oynar (8,10,11,12). Koag?lasyon ve fibrinolizin artmas?n? yans?tan D-dimer d?zeyinin y?ksekli?i, beyin t?m?rleri, lenfoma, meme, akci?er, mide, kolorektal, pankreas ve prostat kanserlerinde artm?? mortalite riskiyle ili?kili bulunmu?tur (6). VTE kanser hastalar?nda s?k bir komplikasyon olup, kanser hastalar?nda ?nde gelen ?l?m nedenleri aras?nda yer almaktad?r. Epidemiyolojik ?al??malarda, genel kanser pop?lasyonunda VTE k?t? prognozla ve mortalitede ?? kat artm?? riskle ili?kili bulunmu?tur (13). T?m kanser t?rlerinde, VTE geli?mesi bir y?l mortalitenin tahmininde ?nemli bir belirleyicidir ve bu lokalize, b?lgesel veya metastatik evre hastal??? olan hastalar i?in de ge?erlidir (13). Bu bulgular metastatik pankreas, mide, b?brek, mesane, uterus veya akci?er kanseri hastalar?nda primer tromboprofilaksinin potansiyel olarak d???n?lmesine neden olmu?tur. D???k molek?l a??rl?kl? heparin (DMAH), VTE ili?kili mortaliteyi engelleyerek veya antimetastatik etkilerini g?stererek akci?er kanserinde sa?kal?m? art?rabilir (14). Y?ksek D-dimer seviyesi bulunan hastalarda antikoag?lan tedavi yan?t? olumlu etkileyebilir (11). Akci?er kanserli hastalarda profilaktik DMAH ba?lama endikasyonlar? uluslararas? rehberlerde belirtilmi?tir (15).
Buccheri ve arkada?lar?n?n yapt?klar? ?al??mada, artm?? D-dimer d?zeylerinin ?zellikle adenokanser tan?l? hastalarda k?t? prognozla ili?kili oldu?unu g?sterdiler ve ayr?ca cerrahi olarak k?r kabul edilen hastalarda D-dimer ile adjuvan tedavi aday? hastalar?n belirlenebilece?ini ?ne s?rd?ler (10). Ancak di?er ?al??malarda, akci?er kanserinin histolojik tipleri ile D-dimer d?zeyleri aras?nda farkl?l?k saptanmad? (11,12,16). Bir ?al??mda evre IIIB ve IV aras?nda farkl?l?k saptanmazken, farkl?l???n evre I, II, III'?n evre IV ile kar??la?t?r?lmas?ndan kaynakland??? g?r?ld? (12). Di?er bir ?al??mada evreler aras?nda sadece IIA ve IV aras?ndaki D-dimer d?zeyleri farkl?l?k saptand? (16). ?al??mam?zda, D-dimer seviyesi KHAK'?n evreleriyle ili?kili saptand?, yayg?n hastal?kta, s?n?rl? hastal??a g?re y?ksek bulundu. KHDAK histolojik subtipleri aras?nda D-dimer d?zeyleri farkl? de?ildi ancak evre artt?k?a D-dimer d?zeyinin anlaml? olarak y?kseldi?i g?r?ld?.
D-dimer d?zeylerinin tedaviye yan?t? de?erlendirmek i?in de de?erli bir belirte? olabilece?i d???n?lmektedir. Lokal ve ileri evre hastalarda D-dimer d?zeyleriyle kemoterapiye yan?t aras?nda anlaml? bir ili?ki bildirilmi?tir (11,16,17). D-dimer d?zeyleri, regresyon g?steren veya stabil hastal?kta, progresif hastal?ktan daha d???k saptanm??t?r (16). Antoniou ve arkada?lar? kemoterapi ? radyoterapi uygulanan evre IIIA/B ve IV hastalarda, tam ve k?smi yan?t? olanlar?n %73.7'sinde takipte D-dimer d?zeylerinde azalma, progresif hastal??? olanlar?n ise %68.8'inde anlaml? bir art?? bulmu?tur (18). Ayr?ca, ilk olarak remisyona girip, takibinde progresyon g?sterenlerin %92.3'?nde D-dimer d?zeylerinde art?? g?stermi?lerdir (18). ?al??mam?zda progresyon g?r?len grupta 4. k?rden sonra D-dimer d?zeylerinin anlaml? olarak artt??? g?r?ld?.
Y?ksek D-dimer'in, akci?er kanseri olan hastalarda k?t? prognozla ili?kili oldu?u tespit edilmi?tir (10,12,16,18,19,20). D-dimer d?zeyinin, sa?kal?m?n ba??ms?z bir belirleyicisi oldu?u ortaya konulmu?tur (11,12,16,19,20). Baz? ?al??malarda, metastatik akci?er kanserinde D-dimer d?zeylerinin artt??? g?sterilmi?tir (10,12,16,17). Ancak, metastaz b?lgelerine g?re farkl?l?k saptanmam??t?r (16). ?al??mam?zda da KHDAK'da ba?lang??ta y?ksek D-dimer d?zeylerinin k?sa sa?kal?mla ili?kili oldu?u g?r?ld?.
Di?er ?al??malarda hasta say?s?n?n ?ok az olmas?ndan dolay? KHAK alt tipinin ayr? bir sa?kal?m analizi yap?lmad??? g?r?lmektedir. ?al??mam?zda, ba?lang?? d???k D-dimerin, k?sa sa?kal?mla ili?kisi saptand?. Bu durum ?eli?kili gibi g?r?nse de KHAK ve KHDAK'?n davran?? farkl?l???ndan kaynaklanabilir. Ancak, yayg?n KHAK'da y?ksek D-dimer saptand???n? da unutmamak gerekir.
Sonu? olarak, akci?er kanserinde tan? an?nda bak?lacak D-dimer d?zeyiyle progresyon ve sa?kal?m hakk?nda ?nceden bilgi sahibi olabiliriz. D-dimer basit ve ucuz bir y?ntemle bak?labilmektedir. En s?k g?r?len ve y?ksek oranda mortaliteye sahip akci?er kanserinde, tedavi ?ncesi D-dimer d?zeyinin bu anlamda yararl? bilgiler sa?layaca?? d???n?lmektedir.
?IKAR?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Edwards RL, Rickles FR, Moritz TE, Henderson WG, Zacharski LR, Forman WB, et al. Abnormalities of blood coagulation tests in patients with cancer. Am J Clin Pathol 1987; 88: 596-602.
- Falanga A, Panova-Noeva M, Russo L. Procoagulant mechanisms in tumour cells. Best practice and research. Clin Hematol 2009; 22: 49-60.
- Malik G, Knowles LM, Dhir R, Xu S, Yang S, Ruoslahti E, et al. Plasma fibronectin promotes lung metastasis by contributions to fibrin clots and tumor cell invasion. Cancer Research 2010; 70: 4327-34.
- Thompson WD, Smith EB, Stirk CM, Marshall FI, Stout AJ, Kocchar A. Angiogenic activity of fibrin degradation products is located in fibrin fragment E. J Pathol 1992; 168: 47-53.
- Lippi G, Franchini M, Targher G, Favaloro EJ. Help me, Doctor! My D-dimer is raised. Annals Med 2008; 40: 594-605.
- Ay C, Dunkler D, Pirker R, Thaler J, Quehenberger P, Wagner O, et al. High D-dimer levels are associated with poor prognosis in cancer patients. Haematologica 2012; 97: 1158-64.
- Falanga A, Rickles FR. Pathophysiology of the thrombophilic state in the cancer patient. Seminars in thrombosis and hemostasis. 1999; 25: 173-82.
- Kwaan HC, Keer HN. Fibrinolysis and cancer. Seminars in thrombosis and hemostasis. 1990; 16: 230-5.
- Bick RL. Coagulation abnormalities in malignancy: a review. Seminars in thrombosis and hemostasis 1992; 18: 353-72.
- Buccheri G, Torchio P, Ferrigno D. Plasma levels of D-dimer in lung carcinoma: clinical and prognostic significance. Cancer 2003; 97: 3044-52.
- Altiay G, Ciftci A, Demir M, Kocak Z, Sut N, Tabakoglu E, et al. High plasma D-dimer level is associated with decreased survival in patients with lung cancer. Clin Oncol (R Coll Radiol) 2007; 19: 494-8.
- Unsal E, Atalay F, Atikcan S, Yilmaz A. Prognostic significance of hemostatic parameters in patients with lung cancer. Respir Med 2004; 98: 93-8.
- Chew HK, Wun T, Harvey D, Zhou H, White RH. Incidence of venous thromboembolism and its effect on survival among patients with common cancers. Arch Intern Med 2006; 166: 458-64.
- Noble S. Low-molecular-weight heparin and survival in lung cancer. Thrombosis research 2012; 129(Suppl 1): S114-8.
- Lyman GH, Khorana AA, Kuderer NM, Lee AY, Arcelus JI, Balaban EP, et al. Venous thromboembolism prophylaxis and treatment in patients with cancer: American Society of Clinical Oncology clinical practice guideline update. J Clin Oncol: Official Journal of the American Society of Clinical Oncology 2013; 31: 2189-204.
- Komurcuoglu B, Ulusoy S, Gayaf M, Guler A, Ozden E. Prognostic value of plasma D-dimer levels in lung carcinoma. Tumori 2011; 97: 743-8.
- Seitz R, Rappe N, Kraus M, Immel A, Wolf M, Maasberg M, et al. Activation of coagulation and fibrinolysis in patients with lung cancer: relation to tumour stage and prognosis. Blood Coagul Fibrinolysis 1993; 4: 249-54.
- Antoniou D, Pavlakou G, Stathopoulos GP, Karydis I, Chondrou E, Papageorgiou C, et al. Predictive value of D-dimer plasma levels in response and progressive disease in patients with lung cancer. Lung Cancer 2006; 53: 205-10.
- Taguchi O, Gabazza EC, Yasui H, Kobayashi T, Yoshida M, Kobayashi H. Prognostic significance of plasma D-dimer levels in patients with lung cancer. Thorax 1997; 52: 563-5.
- Ferrigno D, Buccheri G, Ricca I. Prognostic significance of blood coagulation tests in lung cancer. Eur Respir J: Official Journal of the European Society for Clinical Respiratory Physiology 2001; 17: 667-73.
Yaz??ma Adresi (Address for Correspondence):
Dr. ?zlem KAR KURT,
Abant ?zzet Baysal ?niversitesi T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
14280, G?lk?y, BOLU ? TURKEY
e-mail: aghhozlem@yahoo.com