Toplumda geli?en pn?monide tigesiklin kullan?m?
Aykut ??LL?
Akdeniz ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Antalya.
?ZET
Toplumda geli?en pn?monide tigesiklin kullan?m?
Tigesiklin, yap?sal olarak tetrasiklin s?n?f?na benzeyen glisilsiklin s?n?f? bir antibiyotiktir. Gram-pozitif, gram-negatif, anaerop ve atipik mikroorganizmalar? da kapsayan geni? bir etki spektrumuna sahiptir. Bu ?al??man?n amac?, toplumda geli?en pn?monide tigesiklin kullan?m?n?n etkinli?ini de?erlendiren ?al??malar? sunmakt?r. ?ki ?ok-merkezli, randomize, ?ift-k?r faz III ?al??mada, hastaneye yat?r?lan toplumda geli?en pn?monili hastalarda tigesiklinin en az levofloksasin kadar etkili oldu?u g?sterilmi?tir. Tigesiklin genel olarak iyi tolere edilmi?tir. Maj?r yan etkiler primer olarak gastrointestinal sistemle ili?kilidir. Tigesiklin hastaneye yat?r?lan hafif-orta a??rl?ktaki toplumda geli?en pn?monili hastalarda alternatif bir tedavi se?ene?i olarak d???n?lebilir.
Anahtar Kelimeler: Tigesiklin, toplumda geli?en pn?moni.
SUMMARY
The yield of tigecycline in the treatment of community-acquired pneumonia
Aykut ??LL?
Department of Chest Diseases, Faculty of Medicine, Akdeniz University, Antalya, Turkey.
Tigecycline is a novel antibiotic and it is the first glycylcycline of the tetracycline antibiotic class. It exhibits potent in vitro activity against causative pathogens that are most frequently isolated in patients with community-acquired pneumonia. The objective of this study is to review the literature about the efficacy of tigecycline in community-acquired pneumonia. Two randomized clinical studies showed tigecycline was not inferior when compared with levofloxacin for the treatment of patients with bacterial community-acquired pneumonia requiring hospitalization. Tigecycline was generally well tolerated in patients with community-acquired pneumonia. Major adverse effects were primarily gastrointestinal in nature. Tigecycline offers an antibiotic option that can be used in hospitalized patients with mild to moderate community-acquired pneumonia.
Key Words: Tigecycline, community-acquired pneumonia.
Tuberk Toraks 2013; 61(2): 155-161 • doi: 10.5578/tt.5032
Geli? Tarihi/Received: 04/03/2013 - Kabul Edili? Tarihi/Accepted: 08/03/2013
Toplumda geli?en pn?moni (TGP), infeksiyonla ili?kili ?l?mlerin ?nde gelen nedenidir ve t?ptaki geli?melere ra?men ?nemli bir ?l?m nedeni olarak kalmaya devam etmektedir. Amerika Birle?ik Devletleri'nde her y?l yakla??k olarak 5-6 milyon yeni olgu ile pn?moni, ?l?me yol a?an nedenler aras?nda alt?nc? s?radad?r (1). T?rkiye'de alt solunum yolu infeksiyonlar?, ?l?m nedenleri aras?nda %4.2 ile be?inci s?rada g?r?lmektedir (2). ?lkemizde ger?ekle?tirilen de?i?ik ?al??malarda, pn?moni mortalitesinin, hastal???n a??rl??? ile ili?kili olarak %1 ile %60 aras?nda de?i?ti?i ve ?zellikle hastanede tedavi edilen pn?monilerde mortalitenin belirgin olarak y?ksek oldu?u (%10.3-60) g?sterilmi?tir (3). T?rkiye'de TGP olgular?n? kapsayan ?al??malara genel olarak bak?ld???nda, etyolojik ajan saptama oran?n?n %21-62.8 aras?nda de?i?ti?i g?r?lmektedir (3). Bu ?al??malara g?re, ?lkemizde TGP'den en s?k sorumlu patojenler Streptococcus pneumoniae, enterik gram-negatif bakteriler (EGNB), streptokoklar, Staphylococcus aureus, Haemophilus influenzae, Pseudomonas aeruginosa, Mycoplasma pneumoniae ve Chlamydophila pneumoniae olarak g?r?lmektedir.
TGP'de etyolojik ajan ?o?unlukla saptanmaz. Baz? klinik ve radyolojik ?zellikler pn?moniye neden olan spesifik mikroorganizmalar? d???nd?rse de g?venilir de?ildir. Bu nedenle genelde ampirik olarak tedavi edilir. Di?er yandan yetersiz antibiyotik tedavisi istenmeyen klinik sonu?lara ve antibiyotik diren? art???na yol a?abilir. Pn?moninin tan? ve tedavisi yeni patojenlerin ortaya ??k???, antibiyotik direncinin yayg?nla?mas?, imm?ns?prese hastalar?n say?s?n?n artmas? ve yeni tan?sal ara?lar ve antimikrobiyal ajanlarla bug?n daha komplike hale gelmi?tir. TGP'nin ampirik tedavisi hastal???n a??rl???na, hastaneye yat?? gerekip gerekmedi?ine, komorbid durumlar?n varl???na, ?ok ilaca diren?li patojenler i?in risk fakt?rlerinin olup olmad???na ve ulusal veya b?lgesel diren? paternlerine ba?l? olarak de?i?kenlik g?sterebilir. Hastal???n a??rl???n? belirlemede en s?k kullan?lan objektif ?l??tler CURB-65 ve PSI'd?r. G?n?m?zde kullan?lan pek ?ok uluslararas? rehberde, hastaneye yat?r?lan TGP'li olgular?n tedavisinde beta-laktam (?rn. ampisilin, amoksisilin veya ampisilin-sulbaktam, sefuroksim, sefotaksim veya seftriakson) + bir makrolid (?rn. azitromisin veya klaritromisin) veya bir solunum florokinolonu (moksifloksasin, levofloksasin veya gemifloksasin) ?nerilir. T?rk Toraks Derne?i TGP Rehberinde, klinikte tedavi edilen olgular i?in ???nc? ku?ak antips?domonal sefalosporin veya beta-laktamaz inhibit?rl? aminopenisilin + makrolid ya da tek ba??na bir solunum florokinolonu ?nerilmektedir (4).
Tigesiklin, yap?sal olarak tetrasiklin s?n?f?na benzeyen glisilsiklin s?n?f? bir antibiyotiktir. Gram-pozitif, gram-negatif, anaerop ve atipik mikroorganizmalar? da kapsayan geni? bir etki spektrumuna sahiptir. Daha ?nce yay?nlanan kontroll? klinik ?al??malarda, komplike deri ve yumu?ak doku infeksiyonlar? ve komplike intra-abdominal infeksiyonlardaki etkinli?i g?sterilmi?tir. S?z? ge?en infeksiyonlar i?in FDA 2005 y?l?nda onay vermi?tir. Geni? etki spektrumu ve iyi akci?er penetrasyonu hastaneye yat?r?lan TGP'li hastalarda etkili bir antibiyotik olabilece?ini d???nd?rm?? ve bu nedenle son zamanlarda TGP tedavisinde ?al???lm??t?r. FDA tigesiklinin TGP'de kullan?m? i?in 2009 y?l?nda onay vermi?tir. T.C. Sa?l?k Bakanl??? da tigesiklinin TGP'de kullan?labilece?ini 2010 y?l?nda onaylam??t?r.
T?GES?KL?NE GENEL BAKI?
Farmakoloji
Tigesiklinin, tetrasiklin gibi bakteriyel ribozomal alt ?nitesi 30S'ye geri d?n???ml? bir ?ekilde ba?lan?r ve tRNA molek?llerinin ribozomun A b?lgesine giri?ini bloke ederek protein sentezini inhibe eder (5). Zaman-ba??ml? bakteriyostatik etkilidir fakat S. pneumoniae ve Legionella pneumophila i?in bakterisidal aktivite g?sterir (5). Tigesiklinin in vitro aktivitesi beta-laktamaz ?retiminden, hedef b?lgedeki de?i?ikliklerden veya hedef enzimlerden etkilenmez (5). Ayr?ca, tetrasiklinleri etkileyen ?o?u diren? mekanizmas?ndan da (ribozomal korunma ve se?ilmi? ak?? pompalar?) etkilenmedi?i bildirilmi?tir (6,7,8,9,10). Bununla birlikte, tigesiklinle ili?kili en s?k g?r?len diren? mekanizmas?, ak?? pompalar?yla ili?kili gibi g?z?kmektedir (5).
Mikrobiyoloji
Tigesiklin, bir?ok fak?ltatif aerop gram-pozitif, gram-negatif ve anaerop bakteriye kar?? in vitro aktivite g?steren geni? spektrumlu bir antibiyotiktir (Tablo 1). ?Clinical and Laboratory Standards Institute (CLSI)?e g?re, S. aureus (metisiline diren?li mikroorganizmalar dahil) i?in minimum inhibit?r konsantrasyonu (M?K)'nun ≤ 0.5 mg/L, S. pneumoniae d??? Streptococcus spp. ve Enterococcus faecalis izolatlar? i?in ≤ 0.25 mg/L olmas? tigesikline duyarl?l??? d???nd?rmektedir (11,12). S. pneumoniae i?in duyarl? M?K k?r?l?m noktas? ≤ 0.06 mg/L'dir (11,12). Enterobacteriaceae ve H. influenzae duyarl?l??? i?in M?K k?r?l?m noktalar? s?ras?yla ≤ 2 mg/L ve ≤ 0.25 mg/L'dir (11,12). E?er M?K de?erleri ≤ 4 mg/L ise anaeroplar?n tigesikline duyarl? olduklar? d???n?l?r (11).
Tigesiklin, pek ?ok gram-pozitif mikroorganizma i?in potent in vitro aktivite g?sterir. S. aureus (n= 8765) izolatlar? %99.4 duyarl?l?k g?stermi?tir (13). Koag?laz-negatif stafilokok (n= 3570), Enterococcus spp. (n= 3258), beta-hemolitik streptokok (n= 769) ve viridans grup streptokok (n= 378) i?in in vitro duyarl?l?klar s?ras?yla %97.5, %92.7, %99.7 ve %98.1 olarak bildirilmi?tir (13). Tigesiklin, TGP'de en s?k g?r?len etken olarak kar??m?za ??kan S. pneumoniae i?in potent in vitro aktivite g?sterir. Toplam 605 izolat?n %92.7'si tigesikline duyarl? saptanm??t?r (13). M?K s?n?rlar? ≤ 0.12 ve ≤ 0.12-1 mg/L olarak bulunmu?tur. Tigesiklinin aktivitesi ayr?ca penisiline orta duyarl? ve penisiline diren?li S. pneumoniae mikroorganizmalar?n? da i?ermektedir ve Kuzey Amerikal? su?lar i?in s?ras?yla %90.2 (n= 1077) ve %91.2 (n= 555) duyarl?l?k g?stermi?tir (14). Ek olarak, florokinolona diren?li S. pneumoniae'ya kar?? tigesiklinin 0.12 mg/L M?K de?eri bildirilmi?tir (15). Toplumda-geli?en metisiline diren?li S. aureus (MRSA) izolatlar?na kar?? da tigesiklinin in vitro aktif oldu?u g?sterilmi?tir (%98.2 duyarl?l?k oran?) (n= 1989) (16).
Tigesiklin, Proteus ve Pseudomonas spp. hari? pek ?ok gram-negatif mikroorganizmaya kar?? potent in vitro aktivite g?sterir (13). Yirmi alt? bin izolat? i?eren k?talararas? bir ?al??mada, tigesiklin bir?ok gram-negatif mikroorganizma i?in (Escherichia coli, Enterobacter spp., Klebsiella spp.) %95'in ?zerinde bir duyarl?l?k g?stermi?tir (13). Tigesikline duyarl? olan di?er mikroorganizmalar aras?nda Serratia spp. (%93.1 duyarl?l?k), Stenotrophomonas maltophilia (%93.1 duyarl?l?k) ve Acinetobacter spp. (%94.5 duyarl?l?k) bulunmaktad?r (13). Tigesiklin H. influenzae (beta-laktamaz ?retenler dahil diren?li izolatlar? da i?eren) ve Moraxella catarrhalis'e kar?? da potent in vitro aktivite g?stermektedir (14,17). Tigesiklin, TGP'de etken ajan olarak g?rmedi?imiz geni? spektrumlu beta-laktamaz ?reten E. coli ve Klebsiella pneumoniae i?in de yeterli in vitro aktiviteye sahiptir (18,19). Anaeroplar, TGP olgular?nda genellikle aspirasyon pn?monilerinde etken olarak kar??m?za ??kan mikroorganizmalard?r. Tigesiklinin anaeroplara kar?? olan in vitro aktivitesi de ?al???lm??t?r ve Clostridium perfringens, Peptostreptococcus micros, Bacteroides fragilis, Bacteroides thetaiotaomicron ve Bacteroides uniformis'e kar?? olduk?a etkili oldu?u bildirilmi?tir (20).
C. pneumoniae, M. pneumoniae ve L. pneumophila, TGP'de s?k kar??la?t???m?z atipik etkenlerdir. Tigesiklin i?in M?K90 ve duyarl?l?k s?n?rlar? C. pneumoniae (n= 10) i?in 0.125 ve 0.125-0.25 mg/L, Legionella spp. (n= 100) i?in 8 ve 0.5-8 mg/L, M. pneumoniae i?in ise 0.25 ve 0.06-0.25 mg/L'dir (21,22,23).
Farmakokinetik/Farmakodinamik
Tigesiklin intraven?z uygulamay? takiben iki-kompart?manl? lineer kinetikleri g?sterir (24,25). Sa?l?kl? yeti?kinlerden (n= 103) elde edilen verilere g?re, 100 mg y?klenmeyi takiben her 12 saatte bir al?nan tigesiklin 0.63 ?g/mL maksimum plazma konsantrasyonu (Cmax), 60 dakika inf?zyondan sonra 0.13 ?g/mL minimum plazma konsantrasyonu (Cmin) g?sterir (24). Plazma konsantrasyonu-zaman e?risi alt?ndaki alan 0'dan 24'e (AUC0-24) 4.7 ?g.saat/mL olarak ?l??lm??t?r (24). Hayvan ve insan deneyleri, tigesiklinin pek ?ok doku ve v?cut s?v?s?na (akci?erler, cilt, periton s?v?s?, safra kesesi, kolon, kalp, karaci?er, meninksler ve kemik gibi) da??labilece?ini g?stermi?tir (5,26,27,28,29,30). En y?ksek konsantrasyon safrada bulunmu?tur. Tigesiklinin akci?er penetrasyonu, sa?l?kl? yeti?kinlerde (n= 30) 100 mg y?kleme ve ard?ndan her 12 saatte bir 50 mg olmak ?zere toplam 6 doz tigesiklinden sonra de?erlendirilmi?tir (26). Serumda AUC0-12 1.73 ?g.saat/mL, alveoler s?v?da 134 ?g.saat/mL ve epitelyal s?v?da 2.28 ?g.saat/mL olarak saptanm??t?r. Tigesiklinin primer eliminasyon yolu fe?es (%59) ve safra yoludur. Terminal yar? ?mr? 37-67 saat ve toplam sistemik klerensi 0.2-0.3 L/saat/kg'd?r (24).
Tigesiklinin farmakokinetik profili bir?ok farkl? hasta pop?lasyonunda de?erlendirilmi?tir. Ya?, cinsiyet ve ?rka g?re bir farkl?l?k saptanmam??t?r (31,32). B?brek yetmezli?i (kreatinin klerensi ≤ 30 mL/dakika) ve hemodiyaliz hastalar?nda da farmakokinetik ?zelliklerinde bir farkl?l?k g?r?lmemi?tir (33). Tigesiklin hemodiyaliz ile belirgin bir ?ekilde uzakla?t?r?lmamaktad?r (33). A??r karaci?er yetmezli?inde yar? ?mr?nde %43 ve tigesiklin klerensinde %55 azalma saptanm??t?r (34). Bu ki?ilerde tigesiklinin idame dozunun her 12 saatte bir 25 mg'a d???r?lmesi ?nerilmektedir (5,34). Tigesiklinin, olas? teratojenik etkileri nedeniyle gebelik kategorisi D olarak s?n?fland?r?lm??t?r, bu nedenle gebelik s?ras?nda kullan?lmamal?d?r. ?ocuk ve ad?lesanlarda ve emziren kad?nlarda g?venlik ve etkinli?i ile ilgili veriler mevcut de?ildir (5). Tigesiklin, sitokrom P450 yoluyla metabolize edilmez, bu nedenle bu yolla olu?abilecek ila? etkile?imleri beklenmez. Tigesiklin e?er warfarin ile birlikte kullan?lacaksa, warfarin klerensi azalaca?? i?in protrombin zaman?n?n monit?rize edilmesi gerekir (5).
Tigesiklin k?t? oral biyoyararlan?m? nedeniyle sadece intraven?z olarak uygulan?r. ?nerilen doz ?emas? ba?lang??ta 100 mg, takiben her 12 saatte bir 50 mg ?eklindedir. Uygulama s?resinin 30-60 dakika aras?nda olmas? gerekir.
TGP TEDAV?S?NDE T?GES?KL?N?N ETK?NL???
Tigesiklinin TGP'deki etkinli?i iki ?ok-merkezli, randomize, ?ift-k?r faz III ?al??mada de?erlendirilmi?tir (37,38). Bu ?al??malarda tigesiklin, levofloksasin ile etkinlik ve g?venilirlik a??s?ndan kar??la?t?r?lm??t?r. Sekonder ama?lar ise, tigesiklinin mikrobiyolojik etkinli?i ve TGP patojenlerinin duyarl?l?klar?n? saptamakt?r. ?al??malara al?nan hastalar TGP nedeniyle hastaneye yat?r?lan ve intraven?z antibiyotik tedavi gereksinimi olan 18 ya? ?st? yeti?kin hastalard?r. Daha ?nce florokinolon tedavisinin ba?ar?l? olmad??? hastalar, huzurevinde kalan hastalar, yo?un bak?m ?nitesine yat?? gereken hastalar veya baz? infeksiyon ajanlar?ndan (P. aeruginosa, L. pneumophila, Pneumocystis jiroveci veya aktif t?berk?loz) ??phe edilen veya tan?s?n?n konuldu?u durumdaki hastalar ?al??ma d??? b?rak?lm??lard?r. Hastalar ya tigesiklin (100 mg IV y?kleme, daha sonra g?nde iki kez 50 mg IV) ya da levofloksasin [g?nl?k 500 mg IV (bir ?al??mada, ara?t?rmac?n?n takdirine g?re g?nde iki kez 500 mg IV opsiyonu da var)] i?in randomize edilmi?lerdir. ?ki ?al??man?n birinde, ?? g?n IV antibiyotikten sonra ara?t?rmac?n?n takdirine g?re iki grupta da oral levofloksasine ge?i? yap?labilmi?tir. Her iki ?al??mada da hastalar?n ald??? toplam antibiyotik s?resi 7-14 g?nd?r.
?lk ?al??ma Kuzey, G?ney ve Orta Amerika/Meksika'da yap?lm?? ve iki y?l s?rm??t?r (37). ?kinci ?al??ma ise bir y?l s?rm?? ve Avrupa, Afrika ve Asya-Pasifik b?lgesinde yap?lm??t?r (38). B?t?nle?tirilmi? sonu?lar 2008 y?l?nda Tanaseanu ve arkada?lar? taraf?ndan yay?nlanm??t?r (39). Her iki ?al??mada hastalar ba?lang??taki taramadan sonra tedavi ila?lar?n? almak ?zere randomize edilmi?lerdir [tedavi edilmesi planlanan (ITT) hastalar]. Bir veya daha fazla doz ?al??ma ilac? alan hastalar modifiye ITT (mITT) pop?lasyonunu olu?turmu?tur. Klinik mITT pop?lasyonu, TGP'nin klinik kan?t? olan mITT hastalar?ndan olu?mu?tur. Klinik olarak de?erlendirilebilir (CE) bireyler dahil edilme ve hari? b?rak?lma kriterlerinin bulu?tu?u klinik-mITT hastalar, TGP epizodu i?in bir dozdan fazla antibiyotik almayan hastalar, k?r veya tedavi yetersizli?i i?in k?r-testi (TOC) de?erlendirmesi olan hastalar ve ?al??ma boyunca k?r kalan hastalardan olu?mu?tur. Sa?l?k kaynaklar?n?n kapsaml? kullan?m? her iki ?al??mada da de?erlendirilmi?tir. E?er TGP bulgu ve semptomlar? iyile?ti veya d?zeldiyse, akci?er grafisinde iyile?me varsa veya k?t?le?me yoksa ve ek antibiyotik tedavi gerekmediyse klinik yan?t k?r olarak de?erlendirilmi?tir. Yetersizlik, TGP semptom ve bulgular?nda persistans veya k?t?le?me varsa d???n?lm??t?r. Tigesiklinin g?venilirli?i mITT pop?lasyonunda de?erlendirilmi?tir.
ITT pop?lasyonundaki hastalar?n (n= 846) ortalama ya?? 52 y?l idi ve %60'? erkekti. Fine PSI skorlar?na g?re hastalar?n %21.9'u I, %31.3'? II, %27'si III, %19.3'? IV ve %0.6's? V. gruba girmektedir. PSI skoru I-III aras?ndaki hastalar?n genellikle hastaneye yat?r?lmad?klar? g?z?n?ne al?nd???nda bu ?al??malara kat?lan hastalar?n ?o?unlu?unun hafif ve orta a??rl?kta pn?monili olgular oldu?u s?ylenebilir. CURB-65'e g?re da??l?mlar?na bak?ld???nda hastalar?n; %34.2'si 0, %36.8'i 1, %20.9'u 2, %7.2'si 3, %0.9'u ise 4. grupta yer almaktad?r. mITT pop?lasyonunun yakla??k %13'?nde diabetes mellitus, %11'inde kronik obstr?ktif akci?er hastal???, %7'sinde konjestif kalp yetmezli?i bulundu?u ve %30'unun 65 ya? ?zeri oldu?u saptanm??t?r.
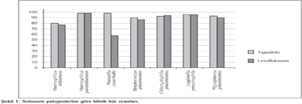
Klinik yan?t a??s?ndan de?erlendirildi?inde, her iki ?al??ma i?in de tigesiklin levofloksasinden a?a?? bulunmam??t?r. CE pop?lasyonunda TOC vizitte k?r olan hastalar?n oran? tigesiklin i?in %89.7, levofloksasin i?in %86.3 olarak saptanm??t?r [tam fark %3.4 (%95 GA -2.2, 9.1)] (Tablo 2). Klinik-mITT pop?lasyonundaki k?r oran? %81.0'a kar?? %79.7 olarak bulunmu?tur [tam fark %1.3 (%95 GA -4.5, 7.1)] (Tablo 3). Demografik ?zellikler ve risk fakt?rlerine dayal? alt grup analizi sonu?lar? genellikle primer analiz sonu?lar?na benzer ?zellikler g?sterdi?i; de?erlendirilen t?m alt grup analizinde tigesiklinin levofloksasinden a?a?? olmad??? saptanm??t?r. Mikrobiyolojik olarak de?erlendirilebilir 40 hastadaki S. pneumoniae bakteremisi i?in klinik k?r oranlar? tigesiklin i?in %90.9, levofloksasin i?in %72.2 olarak bulunmu?tur. Mikrobiyolojik olarak de?erlendirilebilir pop?lasyonda, solunum patojenlerine g?re kategorize edilen alt gruplardaki klinik k?r oranlar?n?n her iki grupta benzer oldu?u belirtilmektedir (?ekil 1). Mikrobiyolojik yan?t oranlar? a??s?ndan tigesiklin ve levofloksasin grubunda belirgin bir farkl?l?k g?r?lmemi?tir. Sadece dokuz penisiline-diren?li S. pneumoniae izole edilmi? ve iki tedavi kolunda da klinik etkinlik a??s?ndan belirgin bir farkl?l?k saptanmam??t?r.
Sa?l?k kaynaklar?n?n kullan?m? a??s?ndan tigesiklin ve levofloksasin kullanan hastalar aras?nda bir farkl?l?k saptanmam??t?r; ortalama hastanede kal?? s?resi her iki grupta da 9.8 g?n, ortalama antibiyotik kullan?m s?resi tigesiklin grubunda 9.8 g?n, levofloksasin grubunda 10 g?n, ortalama intraven?z tedavi s?resi tigesiklin grubunda 4.6, levofloksasin grubunda 4.3 g?n ve parenteral tedaviden oral tedaviye ge?i?ten sonraki oral tedavi s?resi tigesiklin grubunda 5.2, levofloksasin grubunda ise 5.5 g?n olarak saptanm??t?r.
Taburculuktan sonra tigesiklin ve levofloksasin gruplar?nda yeniden hastaneye yat??, yo?un bak?ma ba?vuru, acil servise ba?vuru, evde sa?l?k bak?m? gereksinimi veya bak?mevi ba?vurusu a??s?ndan bir farkl?l?k saptanmam??t?r. Bununla birlikte, ilk hastaneye ba?vuruda veya taburculuktan sonra tigesiklin grubunda belirgin olarak daha az hasta e? zamanl? antibiyotik tedavi gereksinimi g?stermi?tir (%5.6'ya kar??n %11.7; p= 0.002).
?ki faz III ?al??mada da tigesiklinin genel olarak iyi tolere edildi?i s?ylenebilir. Bununla birlikte, mITT pop?lasyonunda tigesiklin ile tedavi edilen hastalarda belirgin olarak daha fazla ila?la ili?kili yan etkiler g?r?lm??t?r (%47.9'a kar?? %37.4; p< 0.01). Tigesiklin kullanan hastalarda belirgin olarak daha y?ksek insidansta bulant? ve kusma saptan?rken, levofloksasin grubunda belirgin olarak daha s?k ALT ve AST y?ksekli?i g?r?lm??t?r. Tigesiklin ve levofloksasin alan gruplar aras?nda ciddi yan etki (%9.9'a kar?? %10.9) veya yan etki nedeniyle ila? b?rakan hasta oranlar? (%6.1'e kar?? %8.1) a??s?ndan belirgin bir farkl?l?k izlenmemi?tir. Her iki gruptaki ?l?m oranlar? da benzer g?r?lm?? (%2.8'e kar?? %2.6) ve ila?la ili?kili bulunmam??t?r.
Sonu? olarak, solunum patojenlerini kapsayan geni? etki spektrumu ve y?ksek akci?er konsantrasyonu nedeniyle tigesiklin, hastaneye yat?r?lan TGP'li hastalarda alternatif bir tedavi se?ene?idir. Yap?lan klinik ?al??malarda, hastaneye yat?r?lan hafif-orta a??rl?ktaki TGP olgular?nda en az levofloksasin kadar etkili oldu?u g?sterilmi?tir. A??r TGP'li hastalarda kullan?m?yla ilgili yeterli veri bulunmad???ndan, bu hastalarda kullan?lmamas? gerekir.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Niederman MS, Mandell LA, Anzueto A, Bass JB, Broughton WA, Campbell GD, et al. Guidelines for the management of adults with community-acquired pneumonia. Diagnosis, assessment of severity, antimicrobial therapy, and prevention. Am J Respir Crit Care Med 2001; 163: 1730-54.
- T.C. Sa?l?k Bakanl???, Refik Saydam H?fz?ss?hha Merkezi Ba?kanl??? H?fz?ss?hha Mektebi M?d?rl???, Ba?kent ?niversitesi Ulusal Hastal?k Y?k? ve Maliyeti Etkinlik Projesi, 2004.
- ?zl? T, B?lb?l Y, ?zsu S. Community-acquired pneumonia with national data. Tuberk Toraks 2007; 55: 191-212.
- ?zl? T, B?lb?l Y, Alata? F, Arseven O, Co?kun A?, ?illi A, et al. Turkish Thoracic Society Community-Acquired Pneumonia Guideline. Turk Toraks Derg 2009; 10: 3-16.
- Wyeth Pharmaceuticals. Tygacil (Package Insert). Philadelphia (PA): Wyeth Pharmaceuticals; 2010.
- Chopra I, Roberts M. Tetracycline antibiotics: mode of action, applications, molecular biology, and epidemiology of bacterial resistance. Microbiol Mol Biol Rev 2001; 65: 232-60.
- Speer BS, Shoemaker NB, Salyers AA. Bacterial resistance to tetracycline: mechanisms, transfer, and clinical significance. Clin Microbiol Rev 1992; 5: 387-99.
- Rasmussen BA, Gluzman Y, Tally FP. Inhibition of protein synthesis occurring on tetracycline-resistant, TetM-protected ribosomes by a novel class of tetracyclines, the glycylcyclines. Antimicrob Agents Chemother 1994; 38: 1658-60.
- Tally FT, Ellestad GA, Testa RT. Glycylcyclines: a new generation of tetracyclines. J Antimicrob Chemother 1995; 35: 449-52.
- Zhanel GG, Homenuik K, Nichol K, Noreddin A, Vercaigne L, Embil J, et al. The glycylcyclines: a comparative review with the tetracyclines. Drugs 2004; 64: 63-88.
- Clinical and Laboratory Standards Institute (CLSI) [formerly National Committee for Clinical Laboratory Standards (NCCLS)]. Methods for Dilution Antimicrobial Susceptibility Tests for Bacteria That GrowAerobically. 8th ed. Wayne (PA): CLSI; 2009.
- Clinical and Laboratory Standards Institute (CLSI) [formerly National Committee for Clinical Laboratory Standards (NCCLS)]. Performance Standards for Antimicrobial Susceptibility Testing-19th Informational Supplement. Wayne (PA): CLSI; 2009.
- Sader HS, Jones RN, Stilwell MG, Dowzicky MJ, Fritsche TR. Tigecycline activity tested against 26,474 bloodstream infection isolates: a collection from 6 continents. Diagn Microbiol Infect Dis 2005; 52: 181-6.
- Darabi A, Hocquet D, Dowzicky MJ. Antimicrobial activity against Streptococcus pneumoniae and Haemophilus influenzae collected globally between 2004 and 2008 as part of the Tigecycline Evaluation and Surveillance Trial. Diagn Microbiol Infect Dis 2010; 67: 78-86.
- Garrison MW, Nuemiller JJ. In vitro activity of tigecycline against quinolone-resistant Streptococcus pneumoniae, methicillin-resistant Staphylococcus aureus and vancomycin-resistant enterococci. Int J Antimicrob Agents 2007; 29: 191-6.
- Mendes RE, Sader HS, Deshpande L, Jones RN. Antimicrobial activity of tigecycline against community-acquired methicillin-resistant Staphylococcus aureus isolates recovered from North American medical centers. Diagn Microbiol Infect Dis 2008; 60: 433-6.
- Zhanel GG, Palatnick L, Nichol KA, Low DE, Hoban DJ; CROSS Study Group. Antimicrobial resistance in Haemophilus influenzae and Moraxella catarrhalis respiratory tract isolates: results of the Canadian Respiratory Organism Susceptibility Study, 1997 to 2002. Antimicrob Agents Chemother 2003; 47: 1875-81.
- Ko KS, Song JH, Lee MY, Park S, Kwon KT, Heo ST, et al. Antimicrobial activity of tigecycline against recent isolates of respiratory pathogens from Asian countries. Diagn Microbiol Infect Dis 2006; 55: 337-41.
- Waites KB, Duffy LB, Dowzicky MJ. Antimicrobial susceptibility among pathogens collected from hospitalized patients in the United States and in vitro activity of tigecycline, a new glycylcycline antimicrobial. Antimicrob Agents Chemother 2006; 50: 3479-84.
- Bradford PA, Weaver-Sands DT, Petersen PJ. In vitro activity of tigecycline against isolates from patients enrolled in phase 3 clinical trials of treatment for complicated skin and skin-structure infections and complicated intra-abdominal infections. Clin Infect Dis 2005; 41(Suppl 5): 315-32.
- Kenny GE, Cartwright FD. Susceptibilities of Mycoplasma hominis, M. pneumoniae, and Ureaplasma urealyticum to GAR-936, dalfopristin, dirithromycin, evernimicin, gatifloxacin, linezolid, moxifloxacin, quinupristin-dalfopristin, and telithromycin compared to their susceptibilities to reference macrolides, tetracyclines, and quinolones. Antimicrob Agents Chemother 2001; 45: 2604-8.
- Roblin PM, Hammerschlag MR. In vitro activity of GAR-936 against Chlamydia pneumoniae and Chlamydia trachomatis. Int J Antimicrob Agents 2000; 16: 61-3.
- Edelstein PH, Weiss WJ, Edelstein MA. Activities of tigecycline (GAR-936) against Legionella pneumophila in vitro and in guinea pigs with L. pneumophila pneumonia. Antimicrob Agents Chemother 2003; 47: 533-40.
- Muralidharan G, Micalizzi M, Speth J, Raible D, Troy S. Pharmacokinetics of tigecycline after single and multiple doses in healthy subjects. Antimicrob Agents Chemother 2005; 49: 220-9.
- Rubino CM, Forrest A, Bhavnani SM, Dukart G, Cooper A, Korth-Bradley J, et al. Tigecycline population pharmacokinetics in patients with community-or hospital acquired pneumonia. Antimicrob Agents Chemother 2010; 54: 5180-6.
- Conte JE Jr, Golden JA, Kelly MG, Zurlinden E. Steady-state serum and intrapulmonary pharmacokinetics and pharmacodynamics of tigecycline. Int J Antimicrob Agents 2005; 25: 523-9.
- Gotfried MH, Rodvold KA, Cwik M, Troy SM, Dukart G, Ellis-Grosse EJ. An open-label clinical evaluation of tigecycline concentrations in selected tissues and fluids. Clin Pharmacol Ther 2005; 77(Suppl 2): 98.
- Sun HK, Ong CT, Umer A, Harper D, Troy S, Nightingale CH, et al. Pharmacokinetic profile of tigecycline in serum and skin blister fluid of healthy subjects after multiple intravenous administrations. Antimicrob Agents Chemother 2005; 49: 1629-32.
- Rodvold KA, Gotfried MH, Cwik M, Korth-Bradley JM, Dukart G, Ellis-Grosse EJ. Serum, tissue and body fluid concentrations of tigecycline after a single 100 mg dose. J Antimicrob Chemother 2006; 58: 1221-9.
- Scheetz MH, Reddy P, Nicolau DP, Noskin GA, Postelnick MJ, Stosor V, et al. Peritoneal fluid penetration of tigecycline. Ann Pharmacother 2006; 40: 2064-7.
- Meagher AK, Ambrose PG, Grasela TH, Ellis-Grosse EJ. Pharmacokinetic/pharmacodynamic profile for tigecycline-a new glycylcycline antimicrobial agent. Diagn Microbiol Infect Dis 2005; 52: 165-71.
- Muralidharan G, Fruncillo RJ, Micalizzi M, Raible DG, Troy SM. Effects of age and sex on single-dose pharmacokinetics of tigecycline in healthy subjects. Antimicrob Agents Chemother 2005; 49: 1656-9.
- Troy SM, Muralidharan G, Micalizzi M, Mojavarian P, Salacinski L, Raible D. The effects of renal disease on the pharmacokinetics of tigecycline (GAR-936). 43rd Interscience Conference on Antimicrobial Agents and Chemotherapy [meeting abstract]; September 14-17, 2003; Chicago,IL.
- Saunders S, Baird-Bellaire SJ, Patat AA, et al. Pharmacokinetics of tigecycline (TGC) in patients with hepatic impairment. European Association for Clinical Pharmacology and Therapeutics [meeting abstract]; June 24-29, 2005; Poznan, Poland.
- Garrison MW, Mutters R, Dowzicky MJ. In vitro activity of tigecycline and comparator agents against a global collection of gram-negative and gram-positive organisms: Tigecycline Evaluation and Surveillance Trial 2004 to 2007. Diagn Microbiol Infect Dis 2009; 65: 288-99.
- Wyeth Pharmaceuticals. Response Letter for Tigecycline Inquiry Regarding Legionella pneumophila in vitro Data (Data on File). Philadelphia (PA): Wyeth Pharmaceuticals; 2010.
- Bergallo C, Jasovich A, Teglia O, Oliva ME, Lentnek A, de Wouters L, et al.; 308 Study Group. Diagn Microbiol Infect Dis 2009; 63: 52-61. doi:10.1016/j.diagmicrobio.2008.09.001. Epub 2008 Nov 5.
- Tanaseanu C, Milutinovic S, Calistru PI, Strausz J, Zolubas M, Chernyak V, et al; 313 Study Group. BMC Pulm Med 2009; 9: 44.
- Tanaseanu C, Bergallo C, Teglia O, Jasovich A, Oliva ME, Dukart G, et al; 308 Study Group; 313 Study Group. Integrated results of 2 phase 3 studies comparing tigecycline and levofloxacin in community-acquired pneumonia. Diagn Microbiol Infect Dis 2008; 61: 329-38.
Yaz??ma Adresi (Address for Correspondence):
Dr. Aykut ??LL?,
Akdeniz ?niversitesi T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
ANTALYA - TURKEY
e-mail: aykutcilli@hotmail.com