MikroRNA'lar ve akci?er kanseri
Ay?e G?l ZAMAN?1, Adil ZAMAN?2
1 Necmettin Erbakan ?niversitesi Meram T?p Fak?ltesi, T?bbi Genetik Anabilim Dal?, Konya,
2 Necmettin Erbakan ?niversitesi Meram T?p Fak?ltesi, G???sHastal?klar? Anabilim Dal?, Konya.
?ZET
MikroRNA'lar ve akci?er kanseri
MikroRNA'lar, mRNA'larla hibridize olarak translasyon inhibisyonu ya da mRNA y?k?l?m?na yol a?an kodlama yapmayan RNA'lard?r. Kanserde de?i?en miRNA ekspresyonu t?m?r tan?s?nda, hastal??a ?zg? prognozun ve tedaviye yan?t?n molek?ler biyomark?rlar? olarak kullan?labilir. Ayr?ca, miRNA'lar gen tedavisinde ?zg?l hedefler olarak se?ilebilir. Bu derlemede, miRNA'lar?n akci?er kanserindeki rol? ve yeni geli?meler ?zetlenecektir.
Anahtar Kelimeler: Akci?er kanseri, mikroRNA, onkojen, t?m?r bask?lay?c?, biyomark?r.
SUMMARY
MicroRNAs and lung cancer
Ay?e G?l ZAMAN?1, Adil ZAMAN?2
1 Department of Medical Genetic, Faculty of Meram Medicine, Necmettin Erbakan University, Konya, Turkey,
2 Department of Chest Diseases, Faculty of Meram Medicine, Necmettin Erbakan University, Konya, Turkey.
MicroRNAs (miRNAs) are a class of non-coding RNAs that hybridize to mRNAs and induce either translation repression or mRNA cleavage. Patterns of altered miRNA expression in cancer may work as molecular biomarkers for tumor diagnosis, prognosis of disease-specific outcomes, and prediction of therapeutic responses. In addition, miRNAs can serve as specific targets for gene therapies. This review summarizes the current knowledge of miRNAs and their roles in lung cancer.
Key Words: Lung cancer, microRNA, oncogene, tumour suppressor, biomarker.
Tuberk Toraks 2013; 61(1): 57-62 • doi: 10.5578/tt.4874
Geli? Tarihi/Received: 09/02/2013 - Kabul Edili? Tarihi/Accepted: 24/02/2013
Akci?er kanseri t?m d?nyada kanserlerden kaynaklanan ?l?mlerin ba?l?ca sebebidir. ?ki ana tipi vard?r: k???k h?creli akci?er kanseri (KHAK) ve k???k h?creli d??? akci?er kanseri (KHDAK). KHDAK'lar t?m akci?er kanserlerinin %80'ini olu?turur. Cerrahi y?ntemlerdeki yeniliklere, radyoterapi ve kemoterapideki geli?melere ra?men, akci?er kanserinin sa?kal?m s?resi %16'd?r (1). Bu nedenle, akci?er kanserinin genetik olarak geli?imini ??zmek ve yeni tedavi hedefleri geli?tirmek i?in h?cresel molek?ller ?zerinde daha ?ok ?al???lmas? gerekmektedir.
MikroRNA'lar ?o?alma, h?cre farkl?la?mas? ve apopitoz gibi temel h?cre fonksiyonlar? ger?ekle?irken, hedef mRNA'lar?n proteine d?n???m?n?n d?zenlenmesinde g?rev yapmaktad?r. Gen ifadesini d?zenleyebilen kodlama yapmayan, korunmu?, k???k boyutlu RNA'lard?r. ?lk miRNA (lin-4) 1993 y?l?nda ke?fedilmi? ve ikinci bir miRNA'n?n ke?fi i?in aradan uzun y?llar ge?mi?tir. MikroRNA terimi ise 2001 y?l?ndan itibaren kullan?lmaya ba?lanm??t?r (2). Bug?n tan?mlanm?? yakla??k 2000 miRNA vard?r. Bir?ok farkl? hastal???n patogenezinde miRNA'lar?n rol oynad??? g?sterilmi?tir (3). Kanser geli?iminde onkojen ve t?m?r bask?lay?c? genler gibi davrand?klar? deneysel ?al??malarla g?sterilmi?tir (4).
Bu derlemede k?saca miRNA biyogenezi, akci?er karsinogenezinde miRNA'lar?n t?m?r bask?lay?c? ve onkojenik etkiye nas?l yol a?t?klar?, tan? ve tedavide nas?l kullan?labilecekleri ?zerinde durulacakt?r.
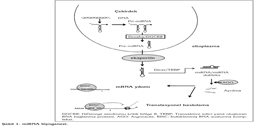
M?KRORNA B?YOGENEZ?
miRNA genlerinin b?y?k ?o?unlu?u (%61) protein kodlayan genlerin intronik b?lgelerindedir, ancak eksonlarda veya genler aras? b?lgelerde de bulunabilir. Birbirini izleyen ?? basamakl? bir i?lem s?reci sonucunda i?levsel hale gelir (?ekil 1). miRNA genlerinden RNA polimeraz II taraf?ndan genellikle boyut olarak farkl?, uzun primer miRNA kopyalar? (pri-miRNA) sentezlenir. H?cre ?ekirde?inde pri-miRNA, mikroi?lemci kompleks de denilen RNAaz III enzim ailesinden bir endon?kleaz olan Drosha ve kofakt?r? ?ift zincirli RNA ba?lama proteini DGCR8 (DiGeorge syndrome critical region gene 8) taraf?ndan kesilerek yakla??k olarak 70 n?kleotid uzunlu?unda pre-miRNA'ya d?n??t?r?l?r. Pre-miRNA bir n?kleer ta??ma resept?r? olan Exportin 5 ile ba?lanarak sitoplazmaya ta??n?r (5). Sitoplazmada yine RNAaz III enzim ailesinden bir endon?kleaz olan Dicer enzimi ve transaktive edici yan?t olu?turan ?ift zincir RNA ba?lanma proteini [transactivating response RNA binding protein (TRBP)] ile kesilerek 18-24 n?kleotid uzunlu?unda ?ift zincirli olgun miRNA'lara d?n??t?r?l?r. Dicer, pre-miRNA'y? kestikten sonra, miRNA zincirlerinden sadece biri "argonaute" (AGO) i?eren ind?klenmi? RNA-susturma kompleksine [RNA induced silencing complex (RISC)] dahil olur (6). Anti-k?lavuz veya "yolcu iplik" olarak adland?r?lan di?er zincir ise y?k?l?r. Olu?an miRNA'lar, aktif RISC kompleksine entegre olduktan sonra, hedef mRNA'n?n y?k?m?na ya da protein sentezinin bask?lanmas?na neden olur (7). Yani, posttranskripsiyonel d?zeyde hedef mRNA'n?n ifadesini d?zenler. miRNA'lar, hedef mRNA'larla 3'-okunmayan b?lgelerinde [untranslated region (UTR)] yer alan k?smen e?lenik dizilerle sahip olduklar? y?ksek oranda korunmu? ve tohum ad? verilen 6-8 n?kleotidlik bir b?lge arac?l???yla etkile?ir (8). Bu miRNA-mRNA ba?lant?s? mRNA'n?n istikrars?zla?mas?na ve y?k?lmas?na yol a?ar. Her miRNA benzer e?lenik dizileri payla?an farkl? mRNA'lara ba?lanabilir (9). H?cre ve doku tipine ba?l? olarak gen ifadesinde ortaya ??kan miRNA-arac?l? de?i?ikliklerin yol a?t??? farkl? fizyolojik ve patofizyolojik de?i?iklikler halen ara?t?r?lmaktad?r. ?rne?in; miR-31 akci?er, ba? ve boyun kanserlerinde, bir onkojenik miRNA olarak davran?r ve meme kanserinde metastaz?n ortaya ??kmas?nda ?nemli bir rol oynar (10,11,12). Etkilenen dokulardaki farkl? etkiler miRNA'lar arac?l???yla ifadesi d?zenlenen hedef genlerin farkl? setlerinden olu?mas?yla ilintilidir. Son y?llarda, ara?t?rmalar bu konu ?zerinde giderek yo?unla?maktad?r.
AKC??ER KANSER?NDE T?M?R BASKILAYICI FONKS?YONA SAH?P miRNA'LAR
Let-7 miRNA ailesinin genleri farkl? kromozomal b?lgelerde, ?zellikle kromozomlardaki frajil b?lgelerde haritalanm??t?r. Bu genler akci?er kanserinde s?kl?kla kaybolur (13). Normalde Let-7 ailesine ait miRNA'lar?n akci?er dokusunda y?ksek seviyelerde bulundu?u in vivo ve in vitro ?al??malarla g?sterilmi?tir (14,15). T?m?r bask?lay?c? aktiviteye sahiptir. H?cre b?y?mesini ve h?cre siklusunun ilerlemesini bask?lay?c? g?rev yapar (15). Takamizawa ve arkada?lar? Let-7 ailesine ait miRNA'lar?n akci?er t?m?rlerinde %40 ve akci?er kanseri h?cre dizilerinde %60 oran?nda azald???n? g?stermi?lerdir. Ayr?ca, bu ?al??mada KHDAK olgular?nda azalm?? LET-7 ekspresyonu k?t? prognozla ili?kilendirilmi?tir (16). ?ok say?da Let-7 ailesi hedef geni vard?r. Bunlar h?cre siklusu kontrol?rleri: CDC25A, CDK6, cyclin D2 ve K-RAS, HMGPA2, c-MYC onkojenleridir (17). Let-7 ailesinin hedef genleri de?erlendirildi?inde t?m?r bask?lay?c? aktivite kolayca anla??lmaktad?r.
Bir ba?ka miRNA ailesi miR-34'?n, bir?ok farkl? kanser tipinde, p53 taraf?ndan uyar?lan t?m?r bask?lay?c? etkisi oldu?u g?sterilmi?tir (18-21). Bir transkripsiyon fakt?r? olan p53 miR-34 ailesi genlerinin okunmas?n? ind?kler. Bu aileye ait genlerin promoterleri metilasyonla inaktive edilebilen CpG b?lgesine sahiptir. miR-34 ailesinin hedef genleri c-myc, CREB, cyclin E, CDK4/6, Bcl-2'dir (17). Bu ailenin ektopik ekspresyonu akci?er kanserli h?crelerde b?y?me ve ?o?almay? ?zellikle cyclin E'yi bask?layarak yava?lat?r (22).
Feng ve arkada?lar?, farelerde ve KHDAK h?cre dizilerinde yapt?klar? ?al??malar?nda artm?? miR-192 ekspresyonunun retinoblastoma 1 (RB1) mRNA's?n? hedefleyerek t?m?r bask?lay?c? etkiye yol a?t???n?, dolay?s?yla h?cre ?o?almas?n? bask?lad???n? ve apopitozu uyard???n? g?stermi?lerdir (23).
Yap?lan bir ba?ka ?al??mada ise miR-451 seviyesinde izlenen art???n, KHDAK hastalar?nda t?m?r h?crelerinin farkl?la?mas?nda, patolojik evreleme ve lenf nodu metastaz?n ?zerinde etkili oldu?u saptanm??t?r. miR-451, ras related protein14 (RAB14)'? hedef alarak kuvvetle bask?lar. Bunun sonucunda t?m?r bask?lay?c? etkiye yol a?ar (24).
Akci?er kanserlerinin yay?lmas?nda miRNA'lar?n yeri oldu?u g?sterilmi?tir. KHDAK'larda kanser dokusu normal akci?er dokusu ile kar??la?t?r?lm?? ve bu iki dokudaki h?crelerin farkl? hsa-miR-125a-3p ve hsa-miR-125a-5p ekspresyon profilleri sergiledi?i anla??lm??t?r. Bu miRNA'lar?n A549 ve SPC-A-1 h?cre dizilerinde h?cre g??? ve invazyonu a??s?ndan bask?lay?c? veya art?c? ters etkilere sahip oldu?u da g?sterilmi?tir (25). Bir adapt?r protein olan proto-onkojen c-Crk (CRK) h?cre adezyonu, proliferasyonu ve migrasyonunu art?ran intrasel?ler sinyal yolaklar?nda g?rev yapmaktad?r. Akci?er kanseri h?crelerinde miR-126 CRK'yi bask?layarak bu etkileri azaltmaktad?r (26). Adenokarsinomlarda CRK benzeri bir etkiye sahip olan Flt1 ise miR-200 taraf?ndan bask?lanmaktad?r (27).
AKC??ER KANSER?NDE ONKOJEN?K FONKS?YONA SAH?P miRNA'LAR: ONKOM?RLER
Onkojenik ?zelliklere sahip miRNA'lar onkomir olarak adland?r?lmaktad?r. Onkomirler ?ok ?e?itli kanser t?rlerinde kontrols?z b?y?meyi art?r?c? ve antiapopitotik y?nde fonksiyon g?sterirler. MiR-17-92 (miR-17, miR-18a, miR-19a, miR-20a, miR-19b-1, miR-92-1) toplulu?unun t?m ?yeleri 13q31.3'de yer al?r ve onkojen olarak de?erlendirilir. C-MYC ile birlikte ?al??arak t?m?r geli?imini h?zland?r?r ve neovask?larizasyonu kolayla?t?r?r. KHAK'da t?m?r dokusunda miktarlar? artmaktad?r. D?zeylerindeki art?? RB1 inaktivasyonuna yol a?ar (28). HeLa h?crelerinde PTEN mRNA'lar?n? hedef ald?klar? g?sterilmi?tir (29). PTEN PI3K/Akt yola??nda g?rev yapmakta ve apopitoz yolunu a??k tutmaktad?r. Akci?er kanserleri ve di?er baz? herediter ve sporadik kanserlerde mutasyona u?rar veya ortamdan elimine edilir (30). MiR-17-92'nin akci?er kanserlerinde h?cre ?o?almas?n? nas?l ind?kledi?i halen molek?ler mekanizmas? tam olarak bilinmeyen, ara?t?r?lmas? gereken bir aland?r.
MiR-31 ise direkt olarak t?m?r bask?lay?c? "large tumor suppressor 2 (LATS2)" ve "PP2A regulatory subunit-Ba isoform (PPP2R2A)" genlerinin mRNA'lar?n? y?karak onkojenik etki yapar. MiR-31'in ortamda olmad??? durumlarda klonal olarak akci?er kanseri h?crelerinin b?y?mesi ve in vivo t?m?r geli?imi bask?lanmaktad?r (10).
AKC??ER KANSER?NDE miRNA'LARIN B?YOMARKIR OLARAK YER?
MikroRNA'lar onkogenezde oynad?klar? ?nemli rol nedeniyle, gelecek vadeden tan?sal ve prognostik biyomark?rlar olarak kabul edilmeye ba?lanm??t?r. Belli miRNA'lar?n t?m?r dokusunda, serumda ve balgamda ekspresyon profillerinin saptanmas?n?n bilgi sa?lay?c? oldu?u d???n?lmektedir.
TANISAL B?YOMARKIRLAR
Balgam sitolojisi akci?er kanserinin tan?s?nda ?ok uzun y?llardan beri kullan?l?r. Xie ve arkada?lar? kanser hastalar?n?n balgam ?rneklerinde miR-21 ekspresyonunun kanser olmayan bireylere g?re artm?? oldu?unu g?stermi?lerdir (31). Daha sonra yap?lan ?al??malarda da balgamda artm?? miR-21 ekspresyonunun %69.9 duyarl?l?k ve %100 ?zg?ll?kle akci?er kanserinde tan? koyduruculu?u oldu?u rapor edilmi?tir (32). B?ylece balgamda artm?? miR-21 ekspresyonunun tespiti akci?er kanseri tan?s?nda kullan?labilecek noninvaziv bir yakla??m olarak de?er kazanm??t?r.
Shen ve arkada?lar? erken d?nem KHDAK'da 12 farkl? miRNA'n?n al???lmad?k bir ?ekilde eksprese oldu?unu tan?mlam??lard?r. Bunlar?n aras?ndan be? miRNA'n?n t?m?r dokusu ve plazmadaki ekspresyon d?zeyleri kar??la?t?r?ld???nda ?nemli derecede bir fark saptanm??t?r. Ayr?ca, miR-21, miR-126, miR-210 ve miR-486-5p d?zeylerini normal kontrollerle kar??la?t?r?ld???nda %86.2 duyarl?l?k ve %96.6 ?zg?ll?kle KHDAK'?n ay?rt edebildi?i g?r?lm??t?r. Olu?turduklar? bir miRNA paneli ile de evre I KHDAK'l? hastalara %73.3 duyarl?l?k ve %96.6 ?zg?ll?kle tan? koymu?lard?r. Ek olarak, bu miRNA'lar?n d?zeylerini skuam?z h?creli kanserler ve akci?er adenokarsinomlar?nda k?yaslad?klar?nda tan? koyduruculu?un akci?er adenokarsinomlar?nda daha ?zg?l oldu?unu g?stermi?lerdir (33). KHDAK'da erken d?nemde miR-1254 ve miR-574-5p ekspresyonu ?nemli derecede artm?? olarak bulunmu?tur (34). Bir ba?ka ?al??mada ameliyatla elde edilen t?m?r dokular?ndan ve balgamdan yap?lan miRNA analizlerinde normal kontrollerle yap?lan kar??la?t?rman?n sonucunda miR-21, miR-486, miR-375 ve miR-200b'nin y?ksek ekspresyonunun akci?er adenokarsinomlar?nda %80.6 duyarl?l?k ve %91.7 ?zg?ll?kle tan? koydurucu oldu?u g?sterilmi?tir (35). Xing ve arkada?lar? da benzer sonu?lara ula?arak akci?er kanserinin tan?s?nda balgamda miR-205, miR-210 ve miR-708 ekspresyonunun g?sterilmesinin %73 duyarl?l?k ve %96 ?zg?ll?kle tan? koydurucu oldu?unu rapor etmi?lerdir (36).
PROGNOZ B?YOMARKIRLARI
Az diferansiye t?m?r dokusunda d???k seviyede ifade edilen let-7a-2 ve y?ksek d?zeyde ifade edilen miR-155 akci?er adenokarsinomlar?nda azalm?? sa?kal?m s?resine i?aret etmektedir (14,37). Ayr?ca, evre ba??ms?z olarak akci?er kanserlerinde azalm?? let-7 ekspresyonunun postoperatif azalm?? sa?kal?m s?resiyle ili?kili oldu?u da ileri s?r?lm??t?r (25). Hu ve arkada?lar? cerrahi ve adjuvan kemoterapi ile tedavi edilen evre I-IIIa akci?er adenokarsinom ve skuam?z h?creli karsinom tan?s? alm?? hastalarda serumda y?ksek oranda ifade bulan miR-486 ve miR-30d'nin azalm?? sa?kal?m s?resine i?aret etti?ini bildirmi?lerdir. Ayn? ?al??mada, serumda miR-1 ve miR-499'un d???k oranda ifade edilmesinin de yine k?sa sa?kal?m s?resiyle ili?kili oldu?u g?sterilmi?tir (38). Bir ba?ka ?al??mada ise skuam?z h?creli karsinom t?m?r dokusunda y?ksek miR-146b d?zeyinin yine k?sa sa?kal?mla ili?kili oldu?u saptanm??t?r (39). Gallardo ve arkada?lar? taraf?ndan yap?lan ?al??mada ise, t?m?r dokular?ndaki d???k miR-34 ekspresyonu ile y?ksek n?ks riski aras?nda ili?ki bulunmu?tur. Bu hastalarda d???k miR-34 ekspresyonu P53 mutasyonlar? ile birlikte de?erlendirildi?inde ise yine hastalar?n relaps olas?l???n?n y?ksek oldu?u g?sterilmi?tir (40). KHDAK olan hastalarda be? farkl? miRNA'n?n ifade profili ile prognoz aras?nda nas?l bir ili?kili oldu?unu ara?t?ran Yu ve arkada?lar? let-7a ve miR-221'in koruyucu olarak hareket etti?ini, miR-137, miR-372 ve miR-182'nin ise ?l?m riskini art?rd???n? rapor etmi?lerdir (41). Gao ve arkada?lar? ise y?ksek miR-21, d???k miR-143 ve d???k miR-181a ekspresyonunun KHDAK tan?s? ve/veya prognozu a??s?ndan de?eri oldu?unu g?stermi?lerdir (42). KHAK'da y?ksek d?zeyde miR-574-5'in kemoterapiye diren? ile ?nemli derecede ilgili oldu?u saptanm??t?r (43). Bir ba?ka ?al??mada ise adenokarsinom olgular?n?n dondurulmu? dokular?ndan yap?lan ?? kohortta miR-21, miR-17 ve miR-155 de?erlendirilmi?tir. Y?ksek miR-21 ekspresyonu k?t? prognozla ili?kili olarak bulunmu?tur (44).
AKC??ER KANSER?NDE miRNA'LAR ve HEDEFE Y?NEL?K TEDAV?
?zg?l miRNA'lar t?m?r geli?iminin kontrol?nde ?nemli bir rol oynar. Bu karsinogenezin de ?zg?l miRNA'lar?n farmakolojik hedefler olarak se?ilmesine yol a?m??t?r. Bu yakla??mla, onkomirleri bask?layan miRNA deriveleri antikanser ajanlar olarak kullan?ma sunulmaya ba?lanm??t?r. Bu ama?la, modifiye edilmi? miRNA deriveleri olan kilitlenmi? n?kleik asitler [locked nucleic acid (LNA)] kullan?lm??t?r. LNA'lar antagomirler olarak da adland?r?lmaktad?r. Fare modelleri ve insan olmayan primatlarda LNA'lar?n ?zg?l olarak miRNA'lar? bask?lad?klar? g?sterilmi?tir (45). ?e?itli antagomirler hayvan modellerinde ba?ar?l? sonu?lar vermi?tir (46,47). Yak?n gelecekte akci?er kanserinde antagomirleri kullanarak onkomirleri bask?lamak olduk?a ra?bet g?ren bir yakla??m olacakt?r. ?kinci yakla??m ise t?m?r bask?lay?c? aktivitesi olan miRNA'lar?n etkisini art?rmak ya da bozulmu? olan aktivitelerini d?zeltmektir. Fare modellerinde intraven?z olarak verilen miR-34 analoglar? ile antit?m?rojenik etki sa?lanm??t?r (48). Yine, miR-34 tedaviye diren?li K-ras (LSL-G12D) (/+); Trp53 (LSL-R172H) (/+) akci?er adenokarsinomlu farelerde t?m?r olu?umunu ve ilerlemesini engellemi?tir (49). Bir ba?ka ?al??mada ise KHDAK'l? farelerde intranazal olarak verilen let-7'nin antit?m?ral etkisi oldu?u g?sterilmi?tir (50). EGFR ve sinyal yola??n? hedefleyen miR-133b'nin KHDAK'da h?cre b?y?mesini inhibe etti?i g?sterilerek gelecek i?in potansiyel tedavi ajan? olabilece?i bildirilmi?tir (51).
Akci?er kanseri geli?iminde ortaya ??kan onkomirlerin ve t?m?r bask?lay?c? aktiviteye sahip olan miRNA'lar?n ekspresyon profillerinin daha iyi anla??lmas? miRNA temelli tedaviler i?in olduk?a ayd?nlat?c? olacakt?r. ?imdilik erken d?nem preklinik testlerin yap?lm?? olmas?na ra?men var olan ?al??malar gelecek i?in umut vermektedir.
?IKAR ?ATI?MASI
Bildirilmemi?tir.
KAYNAKLAR
- Jemal A, Siegel R, Ward E, Hao Y, Xu J, Thun MJ. Cancer statistics, 2009. CA Cancer J Clin 2009; 59: 225-49.
- Sayed D, Abdellatif M. MicroRNAs in development and disease. Physiol Rev 2011; 91: 827-87.
- Ruvkun G. Molecular biology. Glimpses of a tiny RNA world. Science 2001; 294: 797-9.
- Lotterman CD, Kent OA, Mendell JT. Functional integration of microRNAs into oncogenic and tumor suppressor pathways. Cell Cycle 2008; 7: 2493-9.
- Kim VN. MicroRNA biogenesis: coordinated cropping and dicing. Nat Rev Mol Cell Biol 2005; 6: 376-85.
- Gregory RI, Chendrimada TP, Cooch N, Shiekhattar R. Human RISC couples microRNA biogenesis and posttranscriptional gene silencing. Cell 2005; 123: 631-40.
- Lagos-Quintana M, Rauhut R, Lendeckel W, Tuschl T. Identification of novel genes coding for small expressed RNAs. Science 2001; 294: 853-8.
- Lau NC, Lim LP, Weinstein EG, Bartel DP. An abundant class of tiny RNAs with probable regulatory roles in Caenorhabditis elegans. Science 2001; 294: 858-62.
- Selbach M, Schwanhausser B, Thierfelder N, Fang Z, Khanin R, Rajewsky N. Widespread changes in protein synthesis induced by microRNAs. Nature 2008; 455: 58-63.
- Liu X, Sempere LF, Ouyang H, Memoli VA, Andrew AS, Luo Y, et al. MicroRNA-31 functions as an oncogenic microRNA in mouse and human lung cancer cells by repressing specific tumor suppressors. J Clin Invest 2010; 120: 1298-309.
- Liu CJ, Tsai MM, Hung PS, Kao SY, Liu TY, Wu KJ, et al.miR-31 ablates expression of the HIF regulatory factor FIH to activate the HIF pathway in head and neck carcinoma. Cancer Res 2010; 70: 1635-44.
- Valastyan S, Chang A, Benaich N, Reinhardt F, Weinberg RA. Concurrent suppression of integrin alpha5, radixin, and RhoA phenocopies the effects of miR-31 on metastasis. Cancer Res 2010; 70: 5147-54.
- Calin GA, Sevignani C, Dumitru CD, Hyslop T, Noch E, Yendamuri S, et al. Human microRNA genes are frequently located at fragile sites and genomic regions involved in cancers. Proc Natl Acad Sci USA 2004; 101: 2999-3004.
- Yanaihara N, Caplen N, Bowman E, Seike M, Kumamoto K, Yi M, et al. Unique microRNA molecular profiles in lung cancer diagnosis and prognosis. Cancer Cell 2006; 9: 189-98.
- Johnson SM, Grosshans H, Shingara J, Byrom M, Jarvis R, Cheng A, et al. RAS is regulated by the let-7 microRNA family. Cell 2005; 120: 635-47.
- Takamizawa J, Konishi H, Yanagisawa K, Tomida S, Osada H, Endoh H, et al. Reduced expression of the let-7 microRNAs in human lung cancers in association with shortened postoperative survival. Cancer Res 2004; 64: 3753-6.
- Liu X, Sempere LF, Guo Y, Korc M, Kauppinen S, Freemantle SJ, et al. Involvement of microRNAs in lung cancer biology and therapy. Transl Res 2011; 157: 200-8.
- Corney DC, Flesken-Nikitin A, Godwin AK, Wang W, Nikitin AY. MicroRNA-34b and MicroRNA-34c are targets of p53 and cooperate in control of cell proliferation and adhesion-independent growth. Cancer Res 2007; 67: 8433-8.
- Welch C, Chen Y, Stallings RL. MicroRNA-34a functions as a potential tumor suppressor by inducing apoptosis in neuroblastoma cells. Oncogene 2007; 26: 5017-22.
- Tazawa H, Tsuchiya N, Izumiya M, Nakagama H. Tumor-suppressive miR-34a induces senescence-like growth arrest through modulation of the E2F pathway in human colon cancer cells. Proc Natl Acad Sci USA 2007; 104: 15472-7.
- Bommer GT, Gerin I, Feng Y, Kaczorowski AJ, Kuick R, Love RE, et al. p53-mediated activation of miRNA34 candidate tumor-suppressor genes. Curr Biol 2007; 17: 1298-307.
- Liu X, Sempere LF, Galimberti F, Freemantle SJ, Black C, Dragnev KH, et al. Uncovering growth-suppressive MicroRNAs in lung cancer. Clin Cancer Res 2009; 15: 1177-83.
- Feng S, Cong S, Zhang X, Bao X, Wang W, Li H, et al. MicroRNA-192 targeting retinoblastoma 1 inhibits cell proliferation and induces cell apoptosis in lung cancer cells. Nucleic Acids Res 2011; 39: 6669-78.
- Wang R, Wang ZX, Yang JS, Pan X, De W, Chen LB. MicroRNA-451 functions as a tumor suppressor in human non-small cell lung cancer by targeting ras-related protein 14 (RAB14). Oncogene 2011; 30: 2644-58.
- Jiang L, Huang Q, Zhang S, Zhang Q, Chang J, Qiu X, et al. Hsa-miR-125a-3p and hsa-miR-125a-5p are down regulated in non-small cell lung cancer and have inverse effects on invasion and migration of lung cancer cells. BMC Cancer 2010; 10: 318.
- Crawford M, Brawner E, Batte K, Yu L, Hunter MG, Otterson GA, et al. MicroRNA-126 inhibits invasion in non-small cell lung carcinoma cell lines. Biochem Biophys Res Commun 2008; 373: 607-12.
- Roybal JD, Zang Y, Ahn YH, Yang Y, Gibbons DL, Baird BN, et al. miR-200 Inhibits lung adenocarcinoma cell invasion and metastasis by targeting Flt1/VEGFR1. Mol Cancer Res 2011; 9: 25-35.
- Lin PY, Yu SL, Yang PC. MicroRNA in lung cancer. Br J Cancer 2010; 103: 1144-8.
- He L, Thomson JM, Hemann MT, Hernando-Monge E, Mu D, Goodson S, et al. A microRNA polycistron as a potential human oncogene. Nature 2005; 435: 828-33.
- Salmena L, Carracedo A, Pandolfi PP. Tenets of PTEN tumor suppression. Cell 2008; 133: 403-14.
- Xie Y, Todd NW, Liu Z, Zhan M, Fang H, Peng H, et al. Altered miRNA expression in sputum for diagnosis of non-small cell lung cancer. Lung Cancer 2010; 67: 170-6.
- Wang Q, Wang S, Wang H, Li P, Ma Z. MicroRNAs: novel biomarkers for lung cancer diagnosis, prediction and treatment. Exp Biol Med (Maywood) 2012; 237: 227-35.
- Shen J, Todd NW, Zhang H, Yu L, Lingxiao X, Mei Y, et al. Plasma microRNAs as potential biomarkers for non-small-cell lung cancer. Lab Invest 2011; 91: 579-87.
- Foss KM, Sima C, Ugolini D, Neri M, Allen KE, Weiss GJ. miR-1254 and miR-574-5p: serum-based microRNA biomarkers for early-stage non-small cell lung cancer. J Thorac Oncol 2011; 6: 482-8.
- Yu L, Todd NW, Xing L, Xie Y, Zhang H, Liu Z, et al. Early detection of lung adenocarcinoma in sputum by a panel of microRNA markers. Int J Cancer 2010; 127: 2870-8.
- Xing L, Todd NW, Yu L, Fang H, Jiang F. Early detection of squamous cell lung cancer in sputum by a panel of microRNA markers. Mod Pathol 2010; 23: 1157-64.
- Donnem T, Eklo K, Berg T, Sorbye SW, Lonvik K, Al-Saad S, et al. Prognostic impact of MiR-155 in non-small cell lung cancer evaluated by in situ hybridization. J Transl Med 2011; 9: 6.
- Hu Z, Chen X, Zhao Y, Tian T, Jin G, Shu Y, et al. Serum microRNA signatures identified in a genome-wide serum microRNA expression profiling predict survival of non-small-cell lung cancer. J Clin Oncol 2011; 28: 1721-6.
- Raponi M, Dossey L, Jatkoe T, Wu X, Chen G, Fan H, et al. MicroRNA classifiers for predicting prognosis of squamous cell lung cancer. Cancer Res 2009; 69: 5776-83.
- Gallardo E, Navarro A, Vinolas N, Marrades RM, Diaz T, Gel B, et al. miR-34a as a prognostic marker of relapse in surgically resected non-small-cell lung cancer. Carcinogenesis 2009; 30: 1903-9.
- Yu SL, Chen HY, Chang GC, Chen CY, Chen HW, Singh S, et al. MicroRNA signature predicts survival and relapse in lung cancer. Cancer Cell 2008; 13: 48-57.
- Gao W, Yu Y, Cao H, Shen H, Li X, Pan S, et al. Deregulated expression of miR-21, miR-143 and miR-181a in non small cell lung cancer is related to clinicopathologic characteristics or patient prognosis. Biomed Pharmacother 2010; 64: 399-408.
- Ranade AR, Cherba D, Sridhar S, Richardson P, Webb C, Paripati A, et al. MicroRNA 92a-2*: a biomarker predictive for chemoresistance and prognostic for survival in patients with small cell lung cancer. J Thorac Oncol 2010; 5: 1273-8.
- Saito M, Schetter AJ, Mollerup S, Kohno T, Skaug V, Bowman ED, et al. The association of microRNA expression with prognosis and progression in early-stage, non-small cell lung adenocarcinoma: a retrospective analysis of three cohorts. Clin Cancer Res 2011; 17: 1875-82.
- Elmen J, Lindow M, Sch?tz S, Lawrence M, Petri A, Obad S, et al. LNA-mediated microRNA silencing in non-human primates. Nature 2008; 452: 896-9.
- Kr?tzfeldt J, Rajewsky N, Braich R, Rajeev KG, Tuschl T, Manoharan M, et al. Silencing of microRNAs in vivo with 'antagomirs'. Nature 2005; 438: 685-9.
- Ma L, Reinhardt F, Pan E, Soutschek J, Bhat B, Marcusson EG, et al. Therapeutic silencing of miR-10b inhibits metastasis in a mouse mammary tumor model. Nat Biotechnol 2010; 28: 341-7.
- Wiggins JF, Ruffino L, Kelnar K, Omotola M, Patrawala L, Brown D, et al. Development of a lung cancer therapeutic based on the tumor suppressor microRNA-34. Cancer Res 2010; 70: 5923-30.
- Kasinski AL, Slack FJ. miRNA-34 prevents cancer initiation and progression in a therapeutically resistant K-ras and p53-induced mouse model of lung adenocarcinoma. Cancer Res 2012; 72: 5576-87.
- Trang P, Medina PP, Wiggins JF, Ruffino L, Kelnar K, Omotola M, et al. Regression of murine lung tumors by the let-7 microRNA. Oncogene 2010; 29: 1580-7.
- Liu L, Shao X, Gao W, Zhang Z, Liu P, Wang R, et al. MicroRNA-133b inhibits the growth of non-small-cell lung cancer by targeting the epidermal growth factor receptor. FEBS J 2012; 279: 3800-12.
Yaz??ma Adresi (Address for Correspondence):
Dr. Ay?e G?l ZAMAN?,
Necmettin Erbakan ?niversitesi
Meram T?p Fak?ltesi,
T?bbi Genetik Anabilim Dal?,
KONYA - TURKEY
e-mail: agzamani@yahoo.com