Kronik obstr?ktif akci?er hastal???nda TGF-β1 G/A ve
TNF-α 308 G/A gen
polimorfizmleri ile hava yolu direncinin de?erlendirilmesi
Kevser MELEK1, Gaye ULUBAY1, Sevin? SARIN ?ULA?LI2, Hasibe VERD?3, Belgin ATA?3,
F?sun ?NER EY?BO?LU1
1 Ba?kent ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Ankara,
2 Afyon Kocatepe ?niversitesi T?p Fak?ltesi, G???s Hastal?klar? Anabilim Dal?, Afyonkarahisar,
3 Ba?kent ?niversitesi T?p Fak?ltesi, T?bbi Biyoloji Anabilim Dal?, Ankara.
?ZET
Kronik obstr?ktif akci?er hastal???nda TGF-β1 G/A ve TNF-α 308 G/A gen polimorfizmleri ile hava yolu direncinin de?erlendirilmesi
Giri?: Kronik obstr?ktif akci?er hastal??? (KOAH) t?m d?nyada ?nemli bir mortalite ve morbidite nedenidir. Her ne kadar KOAH i?in spesifik bir gen b?lgesi tan?mlanmam?? olsa da ?zellikle inflamatuvar s?re?te rol alan t?m?r nekroz fakt?r?-alfa (TNF-α), d?n??t?r?lm?? b?y?me fakt?r?-beta1 (TGF-β1) gibi sitokin genlerine ait baz? polimorfizmlerin KOAH geli?iminde etkili olabilece?i g?sterildi. Bu ?al??ma, KOAH'l? olgularda TGF-β1 G/A ve TNF-α 308 G/A gen polimorfizmleriyle hava yolu direnci art???n? de?erlendirmek amac?yla yap?ld?.
Hastalar ve Metod: ?al??maya toplam 264 olgu dahil edildi (Grup 1; KOAH tan?s? alm?? 75 hasta, Grup 2; en az 10 paket y?l? sigara i?mi? ancak hava yolu obstr?ksiyonu geli?memi? 139 hasta, Grup 3;? sa?l?kl? 50 birey). Olgulara solunum fonksiyon testi ve v?cut pletismografisiyle hava yolu direnci ?l??m? yap?ld?. TGF-β1 800 G/A ve TNF-α 308 G/A gen polimorfizmleri de?erlendirildi. ?statistiksel analiz i?in ki-kare testi, Anova ve korelasyon analizleri kullan?ld?.
Bulgular: KOAH olgular? evrelerine g?re TNF-α 308 G/A polimorfizm a??s?ndan kar??la?t?r?ld???nda istatistiksel olarak anlaml? fark bulundu (p< 0.05). Evre I olgular?n 13 (%23.6)'?n?n bu polimorfizmi ta??d???, evre II ve evre III olgularda bu polimorfizmin olmad??? saptand?. KOAH olgular? evrelerine g?re TGF-β1 800 G/A polimorfizmi a??s?ndan kar??la?t?r?ld???nda istatistiksel olarak anlaml? farkl?l?k bulunmad? (p> 0.05). Gruplar aras?nda TNF-α genotipi ve TGF-β1 genotipi ve TNF-α 308 G/A ve TGF-β1 800 G/A polimorfizm s?kl??? a??s?ndan farkl?l?k saptanmad?. Ayr?ca, hava yolu direnci artm?? ve artmam?? olgular aras?nda da TNF-α 308 G/A ve TGF-β1 800 G/A polimorfizmi a??s?ndan anlaml? fark bulunmad?.
Sonu?: Bu sonu?lar ile TNF-α 308 G/A ve TGF-β1 800 G/A polimorfizmlerinin toplumumuzda KOAH geli?imine ve hava yolu direncine katk?s?n?n ?nemli derecede olmad??? ?ng?r?lebilir.
Anahtar Kelimeler: KOAH, hava yolu direnci, TGF-β1 G/A gen polimorfizmi, TNF-α 308 G/A gen polimorfizmi.
SUMMARY
Associations
between TGF-β1 G/A and TNF-α 308 G/A gene polymorphisms with
airway resistance in chronic obstructive pulmonary disease
Kevser MELEK1, Gaye ULUBAY1, Sevin? SARIN ?ULA?LI2, Hasibe VERD?3, Belgin ATA?3,
F?sun ?NER EY?BO?LU1
1 Department of Chest Diseases, Faculty of Medicine, Baskent University, Ankara, Turkey,
2 Department of Chest Diseases, Faculty of Medicine, Afyon Kocatepe University, Afyonkarahisar, Turkey,
3 Department of Medical Biology, Faculty of Medicine, Baskent University, Ankara, Turkey.
Introduction: Chronic obstructive pulmonary disease (COPD) is an important morbidity and mortality cause all over the world. Although specific gene region has not been defined in the pathogenesis of COPD, cytokine gene polymorphisms like tumor necrosis factor-alfa (TNF-α) and transforming growth factor-beta1 (TGF-β1) may contribute to the development of COPD. The aim of the present study was to evaluate the associations between airway resistance with TGF-β1 G/A and TNF-α 308 G/A gene polymorphisms in COPD patients.
Patients and Methods: 264 subjects were included to the study (Group 1; 75 COPD patients, Group 2; 139 subjects with at least 10 packet year smoking history without airflow obstruction, Group 3; 50 healthy subjects). Pulmonary function tests and body plethysmography to measure airway resistance were performed to the subjects. TGF-β1 800 G/A and TNF-α 308 G/A gene polymorphisms were evaluated. Chi-square, Anova and correlation analysis were used for statistical analysis.
Results: There were significant difference among COPD stages in terms of TNF-α 308 G/A polymorphism (p< 0.05). Thirteen (23.6%) stage 1 COPD patients had TNF-α 308 G/A polymorphism and the other did not have. We did not find statistically significant difference among COPD stages in terms of TGF-β1 800 G/A polymorphism (p> 0.05). TNF-α and TGF-β1 genotypes and TNF-α 308 G/A and TGF-β1 800 G/A polymorphisms were not different among study groups. Moreover, no significant differences betweeen subjects with and without increased airway resistance in terms of TNF-α 308 G/A and TGF-β1 800 G/A polymorphisms were present.
Conclusion: These results can suggest the lack of association between TNF-α 308 G/A and TGF-β1 800 G/A gene polymorphisms with COPD development and airway resistance in Turkish population.
Key Words: COPD, airway resistance, TGF-β1 800 G/A gene polymorphism, TNF-α 308 G/A gene polymorphism.
Tuberk Toraks 2013; 61(1): 1-11 • doi:10.5578/tt.4390
Geli? Tarihi/Received: 12/10/2012 - Kabul Edili? Tarihi/Accepted: 08/01/2013
G?R??
Kronik obstr?ktif akci?er hastal??? (KOAH) k?resel olarak artmaktad?r ve 2020 y?l?nda ???nc? s?kl?kta ?l?m nedeni olaca?? d???n?lmektedir (1). G?n?m?ze kadar hastal???n progresyonunu azaltacak ya da seyrini de?i?tirecek bir tedavi y?ntemi geli?tirilememi?tir. Epidemiyolojik verileri d???k de?erlere ?ekebilmek i?in, hastal???n tedavisi kadar, sorumlu risk fakt?rlerinin de bilinmesi ve engellenmesi ?nemlidir. G?n?m?zde KOAH hastalar?n?n yakla??k %20'sinin ya?amlar? boyunca sigara i?memi? olmas?, buna kar??l?k yo?un sigara i?icilerinin sadece %10-20'sinde KOAH geli?ti?inin bilinmesi nedeniyle KOAH'?n etyolojisine y?nelik ?al??malar ?zellikle sitokin genlerinin polimorfizmine y?nelmi?tir (2,3,4). Her ne kadar KOAH i?in spesifik bir gen b?lgesi tan?mlanmam?? olsa da ?zellikle inflamatuvar s?re?te rol alan t?m?r nekroz fakt?r?-alfa (TNF-α), d?n??t?r?c? b?y?me fakt?r?-beta1 (TGF-β1) gibi sitokin genlerine ait baz? polimorfizmlerin KOAH geli?iminde etkili olabilece?ini g?steren ?al??malar vard?r (5,6).
KOAH hastalar?nda hava ak?m? k?s?tlanmas?n? ortaya koyan en sa?l?kl? tan? y?ntemi spirometredir. Ancak periferik hava yolu direncinde hafif bir art?? konvansiyonel spirometrik testlere yans?mamaktad?r. G?n?m?zde rutin kullan?lmayan hava yolu direnci (Raw) ?l??m? ise do?rudan hava yolunun ?ap?n? yans?tan bir parametredir (7).
Bu bilgilerden yola ??karak ?al??mam?z;
1. KOAH'l? olgularda TGF-β1 G/A ve TNF-α 308 G/A gen polimorfizmlerinin rol?n?,
2. KOAH'l? olgularda gen polimorfizminin hava yolu direncine etkisini,
3. KOAH'l? olgularda hava yolu direnci ile hava yolu obstr?ksiyonu aras?ndaki ili?kiyi de?erlendirmek amac?yla yap?ld?.
HASTALAR ve METOD
?al??ma Hastalar?
?al??ma grubumuza dahil edilen hastalar Eyl?l 2007- A?ustos 2008 tarihleri aras?nda merkezimize ba?vuran hastalar aras?ndan randomize olarak se?ildi. ?al??ma i?in Ara?t?rma Kurulu etik kurul onay? al?nd? ve hastalar bilgilendirme ve onam formu kendilerine okutulup imzalar? al?nd?ktan sonra ?al??maya dahil edildi.
?al??maya toplam 264 olgu dahil edildi. Olgular sigara ve KOAH varl??? ?zelliklerine g?re iki gruba ayr?ld?, grup 3 sa?l?kl? kontrol olgular?ndan olu?turuldu.
Grup 1; GOLD'da tan?mlanan kriterlere g?re yeni tan? KOAH ya da ?nceden KOAH tan?s? alm?? 75 hastadan olu?mu?tur (8). Hastalar?n stabil d?nemde olmalar? g?z ?n?ne al?narak son alt? hafta i?erisinde infeksiyon bulgular?n?n olmamas?, son alt? haftada alevlenme olmamas? ve laboratuvar de?erlerinde ?nemli bir de?i?iklik olmamas?na dikkat edildi.
Grup 2; en az 10 paket y?l? sigara i?mi? ancak GOLD'da tan?mlanan kriterlere g?re KOAH tan?s? olmayan 139 hastadan olu?tu. Bu grup da kendi i?inde hava yolu direnci artmayan 28 hasta ve hava yolu direnci artm?? 111 hasta olarak iki alt gruba ayr?ld?. Hastalarda son alt? hafta i?erisinde ate?, balgam miktar? ya da p?r?lans?nda art?? gibi infeksiyon bulgular?n?n olmamas?na dikkat edildi.
Grup 3; kontrol grubu ise hi? sigara i?memi? 50 sa?l?kl? g?n?ll?den olu?tu (Tablo 1).
?al??mam?zdan d??lama kriterleri;
1. Son alt? hafta i?inde KOAH atak/infeksiyon tablosu olan hastalar.
2. Bronkodilatasyon testi pozitif olan hastalar: Bronkodilatasyon testi pozitifli?i bazal de?ere g?re FEV1'de en az %12'lik ve 200 mL'lik art?? olmas? olarak de?erlendirildi (9).
3. Solunum fonksiyon testi bulgular?na g?re restriktif akci?er hastal??? olan hastalar.
4. K?rk ya??ndan k???k, 70 ya??ndan b?y?k olan hastalar.
Genotip Tayini
Her bir hastadan molek?ler analiz i?in 0.072 mL %7.5 K3-etilendiamintetraasetik asit (EDTA) sol?syonu i?eren standart t?plere 10'ar mL ven?z kan al?nd?. Molek?ler analiz i?in gerekli olan genomik DNA izole edilip -80?C'de sakland?.
Olgular?n TGF-β1 800 G/A ve TNF-α 308 G/A genotiplemesi T?bbi Biyoloji ve Genetik Anabilim Dal? DNA Analiz Laboratuvar?nda yap?ld?. Olgulara ait DNA'lar fenol kloroform ekstraksiyon y?ntemi kullan?larak elde edildi. Hedef b?lgelere ?zg? primerler kullan?larak yap?lan polimeraz zincir reaksiyonu (PCR)'nu takiben uygun restriksiyon enzimi ile keserek RFLP analiziyle genotipleme ger?ekle?tirildi. ?rnekler TGF-β1 800 i?in G/A, G/G ve A/A; TNF-α 308 i?in G/A, G/G ve A/A olmak ?zere ?? genotip ?eklinde s?n?fland?r?ld?.
Solunum Fonksiyon Testi ve V?cut Pletismografisiyle Hava Yolu Direncinin ?l??m?
Solunum fonksiyon testi manevralar?, deneyimli bir teknisyen taraf?ndan i?lem ?ncesi olgulara anlat?ld?. T?m manevralar hasta 90? dik oturur konumda iken, spirometri cihaz? (Sensormedics, Vmax Spectra 229 Bilthoven, The Netherlands) kullan?larak yap?ld?, ATS/ERS kriterlerine uyan testler kabul edildi (10). T?m olgular?n FEV1 ve FVC de?erleri ?l??ld?, FEV1/FVC bu de?erlerden hesapland?. FEV1/FVC beklenen de?erin %70'inin alt?nda olan olgulara 200 ?g salbutamol inhalasyonunu takiben 20 dakika sonra FEV1 de?eri tekrar ?l??ld?. FEV1'de beklenen de?ere g?re %12 ve mutlak de?ere g?re 200 mL'lik art?? olan olgular?n bronkodilatasyon testi kabul edilerek ?al??ma d??? b?rak?ld?.
Solunum fonksiyon testi laboratuvar?m?zda yer alan vol?m-sabit v?cut pletismografisi (MasterScope Body version 5.0; Viasys Healthcare GmbH, Hoechberg, Germany) ile olgular?n hava yolu diren?leri ?l??ld?. Cihaz her g?n 2.46 L ??r?nga kullan?larak kalibre edildi. Elektronik olarak vol?mlerin BTPS kar??l??? hesapland?.
Cihaz, hastan?n uygun oturabilece?i ?ekilde (boyun fleksiyonu/ekstansiyonu olmadan a??zl??a eri?ebilecek ?ekilde) ayarland?. ?l??m s?ras?nda burun mandal? kullan?ld? ve hasta yanaklar?n? elleriyle destekledi. Kap? kapan?p hasta a??z par?as?n? a?z?na ald?ktan sonra shutter (hava yolu kapat?c?) a??k olarak hastaya saniyede iki kez ve y?zeyel solunumla (tidal vol?mden d???k vol?mde) k?sa kesik soluma manevras? (panting) yapt?r?ld?. Hava ak?m? direkt olarak pn?motakograf arac?l???yla a??zdan ?l??ld? ve ak?m ile pletismograf bas?nc? aras?nda S bi?iminde bir e?ri elde edildi. Daha sonra shutter kapat?ld? ve hasta normal nefes al?p vermeye devam ettirildi. Shutter 3-5 saniye sonra otomatik a??ld???nda hastaya g??l? bir ekspiryum yapt?r?ld?. Ekspiryum sonunda FVC manevras? da yapt?r?l?p test sonland?r?ld?. Bu manevralar s?ras?nda ?l??len hava yolu ak?m?, alveoler bas?n?, a??z i?i bas?n? kullan?larak hava yolu direnci sistem taraf?ndan a?a??da verilen form?l ile otomatik olarak hesapland? (11,12,13):
Raw: Hava yolu direnci (cmH2O/L/s)
Pao: A??z i?i bas?n? (cmH2O)
PA: Alveoler bas?n? (cmH2O)
V: Ak?m (L/s)
?statistiksel Analiz
Bu ara?t?rmada elde edilen veriler SPSS 15.0 (SPSS INC, Chicago, IL, USA) program?nda istatistiksel olarak de?erlendirildi. Gruplara g?re de?i?kenler (cinsiyet, aktif sigara i?icisi ve sigaray? b?rakm?? olma durumu, TNF-α 308 G/A, TGF-β1 800 G/A polimorfizmlerinin varl???) a??s?ndan farkl?l?k ki-kare testiyle de?erlendirildi. Ayr?ca KOAH evrelerine TNF-α 308 G/A ile TGF-β1 800 G/A polimorfizmleri a??s?ndan ve Raw de?erine g?re TNF-α 308 G/A, TGF-β1 800 G/A polimorfizmleri a??s?ndan farkl?l?k yine ki-kare testiyle de?erlendirildi. Gruplara g?re ya? ortalamas?, hematokrit ortalamas?, spirometrik ve pletismografik parametrelerin ortalamas? ? SS de?erleri verilerek Anova ile de?erlendirildi. FEV1/FVC, FEV1, %FEF25-75 de?erleri ile Raw ve sRaw de?erleri aras?ndaki ili?ki Pearson's korelasyon analiziyle de?erlendirildi.
BULGULAR
?al??mam?za toplam 264 olgu dahil edildi. Olgular?n 75'i stabil KOAH'l? (Grup 1), 139'u sigara i?icisi ancak KOAH'? olmayan (Grup 2) ve 50'si sigara i?memi? sa?l?kl? kontrol olgular?yd? (Grup 3). Gruplar aras? ya? da??l?m?nda istatistiksel anlaml? farkl?l?k yoktu (p> 0.05) (Tablo 2). Gruplar aras?nda cinsiyet da??l?m?na bak?ld???nda istatistiksel anlaml? farkl?l?k vard? (p< 0.0001). Sigara i?en sa?l?kl? olgular ve KOAH grubunda olgular?n ?o?unlu?u erkekti (Tablo 2). Grup 1'deki olgular?n ortalama FEV1 (L) de?eri 2.5 ? 0.7, Grup 2'de 3.3 ? 0.7 ve Grup 3'te 3.0 ? 0.9 olarak bulundu. KOAH grubunda ortalama FEV1 (L) de?erleri daha d???kt? (p< 0.0001). Grup 1'de olgular?n ortalama FEF25-75 (L/saniye) de?eri 1.2 ? 0.5, Grup 2'de 4.4 ? 6.1 ve Grup 3'te 3.2 ? 1.4 olarak bulundu. Gruplar aras?nda k???k hava yolu obstr?ksiyonu a??s?ndan istatistiksel olarak anlaml? fark bulunmad? (p> 0.05). T?m gruplarda spirometrik parametrelerin ortalama ? SS de?erleri Tablo 2'de g?r?lmektedir.
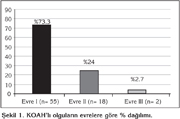
Evrelere g?re KOAH'l? olgulara bak?ld???nda 55 olgu evre I, 18 olgu evre II, 2 olgu evre III KOAH'l?yd? (?ekil 1).
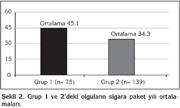
Grup 1'deki olgular?n sigara paket y?l? ortalamas? 45.1 ? 29.4, Grup 2'deki olgular?n sigara paket y?l? ortalamas? 34.3 ? 17.9 idi. Grup 1 ile Grup 2 aras?nda sigara paket y?l? a??s?ndan istatistiksel olarak anlaml? fark saptand?, ortalama paket y?l say?s? KOAH'l? grupta daha fazlayd? (p< 0.05) (?ekil 2).
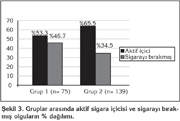
Grup 1'deki 40 (%53.3) olgu aktif sigara i?icisi iken, 35 (%46.7) olgu sigaray? b?rakm??t?. Grup 2'nin ise 91 (%65.5)'i aktif sigara i?icisi, 48 (%34.5)'i sigaray? b?rakm?? olgulardan olu?maktayd?. Gruplar aras?nda aktif sigara i?icisi ve sigaray? b?rakm?? olma a??s?ndan anlaml? bir fark bulunmad? (p> 0.05) (?ekil 3).
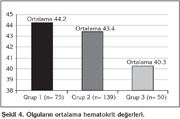
Grup 1'deki olgular?n ortalama hematokrit de?eri 44.2 ? 4.4, Grup 2'deki olgular?n 43.4 ? 4.5, Grup 3'teki olgular?n ise 40.2 ? 4.1 olarak saptand?. Sigara i?memi? sa?l?kl? kontrol grubundaki olgular?n hematokrit de?eri daha d???k bulundu (p< 0.0001) (?ekil 4).
Olgular?n grup 1'de ortalama Raw (cmH2O.saniye/L) ve sRaw (cmH2O.saniye) de?erleri s?ras?yla 3.4 ? 1.5 ve 15.3 ? 7.1, Grup 2'de 3.1 ? 1.4 ve 11.2 ? 4.1, Grup 3'te ise 3.3 ? 1.5 ve 10.6 ? 4.4 olarak saptand?. Gruplar aras?nda ortalama Raw de?eri a??s?ndan istatistiksel olarak anlaml? farkl?l?k bulunmazken (p> 0.05), ortalama sRaw'?n KOAH olgular?nda istatistiksel olarak anlaml? ?ekilde farkl? ve daha y?ksek oldu?u saptand? (p< 0.001). Raw 2 cmH2O.saniye/L e?ik de?er olarak kabul edildi?inde Grup 1'deki olgular?n 60 (%80)'?nda, Grup 2'deki olgular?n 111 (%79.9)'inde, Grup 3'teki olgular?n 44 (%88)'?nde y?ksek bulundu ancak gruplar aras?nda istatistiksel anlaml? fark bulunmad? (p> 0.05). T?m gruplarda pletismografik ?l??m sonu?lar? Tablo 3'te verilmi?tir.
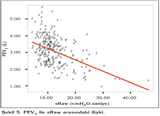
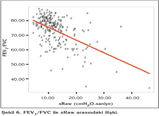
Olgular?n FEV1/FVC, FEV1, %FEF25-75 de?erleri ile Raw ve sRaw de?erleri aras?nda negatif bir korelasyon saptad?k (p< 0.05) (Tablo 4) (?ekil 5,6).
Gruplar TNF-α genotipi y?n?nden kar??la?t?r?ld???nda; Grup 1'de A/A genotipi 45 (%60) olguda, G/A genotipi 13 (%17.3) olguda, G/G genotipi ise 17 (%22.7) olguda saptand?. Grup 2'de A/A genotipi 84 (%60.4) olguda, G/A genotipi 32 (%23) olguda, G/G genotipi ise 23 (%16.5) olguda saptand?. Grup 3'te A/A genotipi 35 (%70) olguda, G/A genotipi 8 (%16) olguda, G/G genotipi 6 (%12) olguda, A/G genotipi ise sadece 1 (%2) olguda saptand?. Gruplar aras?nda TNF-α genotipi y?n?nden istatistiksel anlaml? farkl?l?k saptanmad? (p> 0.05). TNF-α 308 G/A polimorfizm s?kl??? a??s?ndan gruplar kar??la?t?r?ld???nda istatistiksel olarak anlaml? bir fark bulunmad? (p> 0.05). Gruplara g?re TNF-α 308 G/A polimorfizm da??l?m? Tablo 5'te verilmi?tir.
Gruplar TGF-β1 genotipi y?n?nden kar??la?t?r?ld???nda; Grup 1'de A/A genotipi 1 (%1.3) olguda, G/A genotipi 35 (%46.7) olguda, G/G genotipi ise 39 (%52) olguda saptand?. Grup 2'de A/A genotipi 2 (%1.4) olguda, G/A genotipi 49 (%35.3) olguda, G/G genotipi ise 88 (%63.3) olguda saptand?. Grup 3'te A/A genotipi 1 (%2) olguda, G/A genotipi 21 (%42) olguda, G/G genotipi ise 28 (%56) olguda saptand?. Gruplar aras?nda TGF-β1 genotipi y?n?nden farkl?l?k saptanmad? (p> 0.05). Ayr?ca, TGF-β1 800 G/A polimorfizm s?kl??? a??s?ndan da gruplar aras?nda istatistiksel olarak anlaml? bir fark bulunmad? (p> 0.05). Gruplar aras?nda TGF-β1 800 G/A polimorfizm da??l?m? Tablo 5'te verilmi?tir.
KOAH olgular? evrelerine g?re TNF-α 308 G/A polimorfizm a??s?ndan kar??la?t?r?ld???nda istatistiksel olarak anlaml? fark bulundu (p< 0.05). Evre I olgular?n 13 (%23.6)'?n?n bu polimorfizmi ta??d???, evre II ve evre III olgularda bu polimorfizmin olmad??? saptand?. KOAH evrelerine g?re TNF-α 308 G/A polimorfizm da??l?m? Tablo 6'da g?sterilmi?tir. KOAH olgular? evrelerine g?re TGF-β1 800 G/A polimorfizm a??s?ndan de?erlendirildi?inde ise evre I olgular?n?n 26 (%47.3)'s?n?n, evre II olgular?n?n 8 (%44.4)'inin ve evre III olgular?n?n 1 (%50)'inin bu polimorfizmi ta??d??? saptand?. Ancak bu fark istatistiksel olarak anlaml? bulunmad? (p> 0.05) (Tablo 6).
Grup 2'de sigara i?imi, Raw ve TNF-α 308 G/A polimorfizmi aras?ndaki ili?kiyi g?stermek amac?yla olgular de?erlendirildi?inde; hava yolu direnci 2 ve ?zerinde olan 24 (%21.6) olguda ve hava yolu direnci 2'nin alt?nda olan 8 (%28.6) olguda TNF-α 308 G/A polimorfizmi saptand?. Ancak hava yolu direnci artm?? ve artmam?? olgular aras?nda TNF-α 308 G/A polimorfizmi a??s?ndan anlaml? fark bulunmad? (p> 0.05). Grup 2 olgular?n TNF-α 308 G/A polimorfizm da??l?m? Tablo 7'de verilmi?tir.
Grup 2'de sigara i?imi, Raw ve TGF-β1 800 G/A polimorfizmi aras?ndaki ili?kiyi g?stermek amac?yla olgular de?erlendirildi?inde; hava yolu direnci 2 ve ?zerinde olan 37 (%33.3) olguda ve hava yolu direnci 2'nin alt?nda olan 12 (%42.9) olguda TGF-β1 800 G/A polimorfizmi saptand?. Ancak hava yolu direnci artm?? ve artmam?? olgular aras?nda TGF-β1 800 G/A polimorfizmi a??s?ndan anlaml? fark bulunmad? (p> 0.05) (Tablo 8).
TARTI?MA
?al??mam?zda KOAH'l? ve sigara i?en grupta erkek cinsiyetin daha fazla oldu?u (s?ras?yla %81.3 ve %72.7) g?r?ld?. ?al??ma sonu?lar?m?zla benzer olarak D?nya Sa?l?k ?rg?t? verilerinde KOAH'?n erkeklerde daha fazla oldu?u bildirilmektedir (14). ?lkemiz verilerine bakt???m?zda ise 2003-2004 y?llar?nda Adana B?lgesinde yap?lan BOLD ?al??mas?nda da erkeklerde KOAH oran? %29.3 ve kad?nlara g?re daha y?ksek (%9.9) olarak bulunmu?tur (15). Cinsiyet farkl?l???, erkeklerde sigara i?me oran?n?n daha y?ksek olmas?, ?al??ma hayat?nda toz ve partik?llerle daha ?ok kar??la?mas?yla a??klanabilir.
?al??mam?zda ortalama sigara i?im miktar? KOAH'l? hastalarda daha fazlayd?. KOAH geli?me riski sigaraya ba?lama ya?? ve ortalama sigara paket y?l? ile artmaktad?r. KOAH'?n 20 paket y?ldan fazla sigara i?enlerde s?kl???n?n artt??? bildirilmektedir (16). Ayr?ca sigara i?meyen bireylerde 35 ya??ndan sonra y?ll?k FEV1 kayb? ortalama 30 mL iken sigara i?enlerde bu azalma iki kat daha fazla olup, duyarl? sigara i?icileri olarak adland?r?lan grupta ise y?ll?k FEV1 kayb? 120-150 mL'ye ula?maktad?r (16). Bizim ?al??mam?zda da bu literat?r verileriyle uyumlu olarak, KOAH'? olmayan sigara i?icisi gruba g?re KOAH'l? olgularda ortalama paket y?l?n?n daha fazla ve ortalama FEV1 de?eri daha d???k olarak bulundu.
KOAH'l? hastalarda sekonder polisitemi arteryel hipoksemiye ikincil olarak dokulara oksijen sunumunu art?rmak amac?yla geli?ebilir ve bu durum ?zellikle de sigara i?meye devam edenlerle FEV1 de?eri %50'nin alt?nda olan olgularda daha belirgindir. Yine sigara i?en olgularda da karbonmonoksite ba?l? eritropoetin art???na ikincil polisitemi geli?ti?i bilinmektedir (17,18,19,20). ?al??mam?z?n sonu?lar?na bakt???m?zda KOAH'l? ve sigara i?en sa?l?kl? olgularda polisitemili olgu olmad??? g?r?ld?. Bu sonucun olgular?m?z?n ?o?unlu?unun (%97.3) hafif-orta KOAH'l? olmas?na ba?l? oldu?unu d???nd?k. KOAH'l? olgular?m?z ve sigara i?en sa?l?kl? olgular?m?zda, sigara i?meyen sa?l?kl? kontrol grubuna g?re ortalama hematokrit de?erleri daha y?ksekti ve bu fark istatistiksel analizle anlaml? ve literat?rle uyumluydu.
KOAH'?n tan?s?, ?iddetinin belirlenmesi, hastal?k seyrinin izlenmesi ve prognozun takibi i?in solunum fonksiyon testleri kullan?lmaktad?r. Rutin uygulamada hava yollar? obstr?ksiyonunun de?erlendirilmesinde maksimal ekspiratuar ak?m h?zlar?n?n ?l??m? kullan?lmaktad?r (21). KOAH'l? olgularda hava yolu direnci ?l??m?n?n hava yolu ?ap? hakk?nda maksimal ekspiratuar ak?m h?zlar?na g?re daha direkt bilgiler verdi?i ve bu olgularda hava yolu direncinin artt??? bilinmektedir (7). Ancak ?al??mam?zda, KOAH'l? olgularla sigara i?en sa?l?kl? olgular ve kontrol grubu aras?nda hava yolu direnci a??s?ndan anlaml? farkl?l?k bulunmam??t?r. Raw'?n ?zellikle ileri derecede hava yolu obstr?ksiyonu olan olgularda artt???, buna kar??n erken ve hafif hava yolu obstr?ksiyonu olan olgularda Raw'?n artmas?n?n beklenmedi?i bildirilmektedir (7). Bu nedenle ?al??mam?zda gruplar aras?nda ortalama Raw de?eri a??s?ndan farkl?l?k olmamas?n?n olgular?m?z?n ?o?unlu?unun hafif (n= 55) ve orta (n= 18) KOAH'l? olmas?na ba?lanabilece?ini d???nd?k.
Di?er yandan Saryal ve arkada?lar? bizim ?al??mam?zdan farkl? olarak kronik hava yolu obstr?ksiyonu olan hastalarda sa?l?kl? kontrol grubuna g?re hava yolu direncinin artt???n? bildirmi?lerdir (22). Ancak bu ?al??mada hasta grubu olarak KOAH'l? olgular d???nda hava yolu obstr?ksiyonu olan bron?ektazili ve ast?ml? olgular da ?al??maya dahil edilmi?tir ve olgular?n?n %59'unun orta ve ileri derecede hava yolu obstr?ksiyonu vard?r. Bu nedenle sonu?lar?m?z aras?ndaki farkl?l???n se?ilen hasta grubu ve hastal?k ?iddetinin farkl?l???na ba?l? oldu?unu d???nd?k.
Wagner ve arkada?lar? maksimal ekspiratuar ak?m h?zlar? normal olan asemptomatik sigara i?icilerinde periferik hava yolu direncini normalden y?ksek bulmu?lard?r ve bu art??tan k???k hava yollar?ndaki inflamasyonu sorumlu tutmu?lard?r (23). Bizim ?al??mam?zda sigara i?en sa?l?kl? olgularda ve sigara i?meyen sa?l?kl? kontrol olgular? aras?nda Wagner ve arkada?lar? taraf?ndan yap?lan ?al??ma sonu?lar?ndan farkl? olarak hava yolu direnci a??s?ndan anlaml? farkl?l?k bulunmad?. Wagner ve arkada?lar? ?al??malar?nda daha az say?da (n= 19) olguyu de?erlendirmi?ler ve y?ntem olarak bronkoskopik yolla sa? ?st lobdan hava yolu direncini ?l?m??lerdir (23). Bu nedenle ?al??malar?m?z aras?ndaki farkl? sonu?lar?n hasta say?s? ve y?ntemdeki farkl?l??a ba?l? oldu?unu d???nd?k. ?al??mam?za dahil edilen KOAH'l?, sigara i?en sa?l?kl? olgular ve kontrol grubunda ortalama Raw de?eri normalden daha y?ksekti. Bu nedenle gruplar aras?nda Raw a??s?ndan anlaml? farl?l?k olmamas?na y?nelik di?er bir a??klama; ev i?i ve ev d??? kullan?lan yak?tlar ile ?evresel maruziyete ba?l? olarak ?al??mam?zda t?m gruplarda hava yolu obstr?ksiyonu geli?mese dahi hava yolu inflamasyonunun ve direncinin artm?? olabilece?idir. Biyomass maruziyetinin hava yolu direnci ?zerine etkisini g?stermeye y?nelik yeni ?al??malara ihtiya? oldu?u g?r???ndeyiz.
G?n?m?zde Raw ?l??m? i?in beklenen de?er olarak, hasta ?zelliklerine g?re de?i?meyen farkl? sabit de?erler (1.5-2 cmH2O/L/saniye ve 0.6-2.4 cmH2O/L/saniye) kullan?lmaktad?r. Bu kaynaklar?n ?????nda ?al??mam?zda Raw i?in ?st s?n?r? 2 cmH2O/L/saniye olarak kabul ederek gruplar? kar??la?t?rd???m?zda da istatistiksel olarak anlaml? farkl?l?k bulamad?k. Baz? laboratuvarlar kendi gruplar?nda eri?kin olgularda normal Raw de?erinin bu de?erlerden daha y?ksek oldu?unu bildirmi?lerdir (7,24). Ayn? d???nceden yola ??karak gruplar aras?nda Raw a??s?ndan anlaml? farkl?l?k olmamas?na y?nelik ???nc? bir a??klama; kulland???m?z beklenen Raw de?erinin toplumumuz i?in uygun olmayabilece?idir.
Hava yolu direncini burun, a??z ve yukar? hava yollar? %50, trakea ve bron?lar %30, periferik hava yollar? %20 katk? ile olu?turur (7). ?al??mam?zda b?y?k, orta ve k???k hava yolu obstr?ksiyonunu g?steren parametreler olan FEV1, FEV1/FVC ve FEF25-75 ile Raw ve sRaw aras?nda korelasyon bulunmas?n?n hava yolu direncini olu?turan unsurlara ba?l? oldu?unu d???nd?k.
Di?er yandan sRaw ile FEV1, FEV1/FVC ve FEF25-75 aras?ndaki korelasyonun Raw'a g?re daha kuvvetli olmas?n?n sRaw'?n KOAH'l? olgularda daha tercih edilebilir bir parametre oldu?u g?r???n? destekledi?i inanc?nday?z.
Raw'?n vol?m ile ?arp?lmas? sonucu elde edilen sRaw, Raw'dan farkl? olarak ya? ve v?cut ?l??mlerinden ba??ms?z bir ?ekilde hava yolu direncinin de?erlendirilmesine olanak verir (23,25,26,27). Klug ve arkada?lar? da ?al??malar?nda sRaw ile ya?, boy ve kilo aras?nda anlaml? ili?ki saptamam??lard?r (28). sRaw ve Raw'? kar??la?t?ran yeterli ?al??ma olmamas?na ra?men, ?e?itli kaynaklarda sRaw'?n ya?, boy ve kilodan ba??ms?z olmas? nedeniyle Raw'a g?re kullan?m?n?n daha uygun oldu?u belirtilmektedir (7,28). ?al??mam?zda KOAH'? olan olgular?m?zda sRaw d?zeyi obstr?ksiyonu olmayan sa?l?kl? ve sigara i?en kontrol olgular?na g?re anlaml? olarak y?ksek ve istatistiksel olarak farkl? bulundu. Olgular?n FEV1, FEV1/FVC ve sRaw de?erleri aras?nda anlaml? ve negatif bir korelasyon saptand?. sRaw'?n KOAH'l? olgularda sigara i?en sa?l?kl? ve sigara i?meyen kontrol olgular?na g?re daha y?ksek olmas?, hava yolu direncinin belirgin obstr?ksiyonu olan olgularda artt???n?n bilinmesi nedeniyle beklenen ve literat?rle uyumlu bir sonu?tu. ?al??mam?zda ortalama sRaw d?zeyi, sigara i?en (11.3 ? 4.1) ve i?meyen olgularda (10.6 ? 4.4) birbirine yak?nd?. Bu nedenle sRaw d?zeyinin sigara i?en olgularda hen?z ak?m k?s?tlanmas? olu?madan KOAH'?n erken tan?s?nda kullan?lmas?n?n uygun olmayaca?? inanc?nday?z.
Genetik olarak duyarl? ki?ilerin uygun ?evresel risk fakt?rleri ile uzun s?re kar??la?mas? KOAH geli?imine neden olmaktad?r. Bug?ne kadar etkisi kesin olarak ispatlanm?? tek genetik risk fakt?r? herediter AAT yetmezli?idir (29). KOAH etyolojisinde rol ald??? d???n?len di?er ?nemli bir gen aday? TNF-α genidir. G?n?m?ze kadar yap?lan ?al??malara bak?ld???nda KOAH'l? olgularda en ?ok ara?t?r?lan TNF-α -308 G/A polimorfizmidir. Sakao ve arkada?lar? iki ayr? ?al??mada Japon halk?ndaki sa?l?kl? kontrol gruplar?na g?re KOAH'l? olgularda TNF-α -308 G/A polimorfizminin; artm?? TNF-α sitokin seviyesiyle ba?lant?l? oldu?unu, bunun da KOAH geli?imiyle ili?kili oldu?unu belirtmi?lerdir (30,31). Ancak Chierakul ve arkada?lar?n?n Tayland pop?lasyonunu i?eren ?al??mas? ile Ishii ve arkada?lar?n?n Japon halk?n? i?eren ?al??mas?nda TNF-α'n?n tek n?kleotid polimorfizmi ile KOAH aras?nda ili?ki bulamam??lard?r (32,33). Benzer ?ekilde Patuzzo ve arkada?lar? ise Kafkasya halk?nda TNF gen kompleksinin KOAH geli?iminde rol? olmad???n? belirtmi?lerdir (34). Bu bulgu Ferraroti ve arkada?lar?n?n ?al??mas?yla desteklenmi?tir (35). K???kaycan ve arkada?lar? da Kafkas ?rk?nda ?al??malar?nda TNF-α -376 G/A, -308 G/A ve -238 G/A gen polimorfizmlerinin KOAH'l? olgularla kontrol gruplar? aras?nda fark saptamam??lard?r (36). Biz de ?al??mam?zda TNF-α -308 G/A polimorfizm s?kl??? a??s?ndan KOAH'l? olgular?m?z, sigara i?en sa?l?kl? olgular?m?z ve sa?l?kl? kontrol grubumuz aras?nda anlaml? fark bulamad?k.
KOAH evrelerine g?re olgular?m?za bakt???m?zda ise evre I'de %23.6 olguda TNF-α -308 G/A polimorfizmi vard?, ancak evre II ve III'te TNF-α -308 G/A polimorfizmi hi? yoktu. Bu sonucun ?al??mam?za dahil edilen KOAH'l? olgular?n ?o?unlu?unun (%73.3) evre I KOAH'l? olmas?na ba?l? olabilece?ini d???nd?k.
Literat?rde TGF-β1'in etkilerinden baz?lar?n?n KOAH geli?imini engelleyici nitelikte olabilece?ine i?aret eden baz? ?al??malar vard?r. Bir ?al??mada TGF-β1 geninin 10. kodunda prolin allelinin KOAH'l?larda normal pop?lasyona g?re daha az oldu?u, bu allelin y?ksek konsantrasyonlarda TGF-β1 seviyesiyle ili?kili ve TGF-β1'in KOAH geli?iminde koruyucu rol oynad??? ?ne s?r?lm??t?r (37). Bu sonu? Celedon ve arkada?lar?n?n yapt??? daha fazla say?da KOAH'l? ve kontrol olgular? i?eren bir ?al??mayla desteklenmi?tir (38). Aksine TGF-β1 -509 C/T, 869 T/C, 915 G/C polimorfizmleri ile FEV1 kay?p h?z?na bak?lan bir ?al??mada ise anlaml? bir sonu? bulunamam??t?r (38). Su ve arkada?lar? ise Japon halk?nda yapt?klar? bir ?al??mada TGF-β1 -800A/-509C haplotipinin KOAH'a yatk?nl??? art?ran bir fakt?r oldu?unu g?stermi?lerdir (39). Biz ?al??mam?zda TGF-β1 800 G/A polimorfizm s?kl??? a??s?ndan KOAH'l? olgular?m?z, sigara i?en sa?l?kl? olgular?m?z ve sa?l?kl? kontrol grubumuz aras?nda anlaml? fark saptamad?k. KOAH olgular?n?n evreleri aras?nda da TGF-β1 800 G/A polimorfizmi a??s?ndan da bir farkl?l?k yoktu. TGF-β1 800 G/A polimorfizminin ara?t?r?ld??? ?al??malar, farkl? alleller ?al???lm?? olmakla birlikte Japonya, Amerika ve Avrupa halk?n? kapsamaktad?r. Bizim toplumumuza benzer ?zellikler ta??d??? d???n?len Kafkas ?rk?nda yap?lan Ogawa ve arkada?lar?n?n ?al??ma sonu?lar? ise bizim sonu?lar?m?zla uyumludur (40). Bu sonu?lar?n ?????nda TGF-β1 800 G/A polimorfizminin toplumumuzdaki KOAH'l? olgular i?in bir risk fakt?r? olmayaca?? ?ng?r?lebilir. Kesin sonu?lar i?in daha fazla say?da ?al??maya gereksinim vard?r.
Sonu? olarak; ?al??mam?zda KOAH olgular?nda spesifik hava yolu direncinin sa?l?kl? kontrol olgular?ndan daha y?ksek oldu?u saptanm??t?r. Olgular?n FEV1, FEV1/FVC ve sRaw de?erleri aras?nda anlaml? ve negatif bir korelasyon bulunmu?tur. Bu nedenle KOAH'l? hastalarda hava yolu direncini de?erlendirirken Raw'dan ziyade sRaw'?n kullan?lmas?n?n daha uygun olaca?? g?r???ndeyiz.
Ayr?ca ?al??mam?zda KOAH'l? olgularla sigara i?en sa?l?kl? olgular ve kontrol grubu aras?nda TNF-α 308 G/A ve TGF-β1 G/A gen polimorfizmleri a??s?ndan da farkl?l?k bulunamam??t?r. Bu nedenle TNF-α 308 G/A ve TGF-β1 800 G/A gen polimorfizmlerinin toplumumuzda KOAH geli?imine katk?s?n?n ?nemli derecede olmad??? ?ng?r?lebilir. KOAH ve TNF-α 308 G/A ve TGF-β1 800 G/A gen polimorfizmlerine ve toplumumuz i?in uygun Raw ve sRaw de?erlerine y?nelik ?ok say?da hasta gruplar? ile yap?lacak yeni ?al??malara ihtiya? oldu?unu d???nmekteyiz.
?IKAR ?ATI?MASI
Bu ?al??ma Ba?kent ?niversitesi T?p Fak?ltesi Bilimsel Ara?t?rma Projeleri deste?i ile y?r?t?lm??t?r.
KAYNAKLAR
- Mathers CD, Loncar D. Projections of global mortality and burden of disease from 2002 to 2030. PLoS Med 2006; 3: e442.
- Petty TL. Chronic obstructive pulmonary disease. In: Hanley ME, Welsh CH (eds). Current Diagnosis and Treatment in Pulmonary Medicine Lange Medical Boks. MacGraw-Hill Companies, 2003: 82-91.
- Stanford AJ, Weir TD, Pare PD. Genetic risk factors for chronic obstructive pulmonary disease. Eur Respir J 1997; 10: 1380-91.
- Barnes PJ, Shapiro SD, Pauwels RA. Chronic obstructive pulmonary disease: molecular and cellular mechanisms. Eur Respir J 2003; 22: 672-88.
- Zhang S, Wang C, Xi B, Li X. Association between the tumour necrosis factor-a -308 G/A polymorphism and chronic obstructive pulmonary disease: an update. Respirology 2011; 16: 107-15.
- Gong Y, Fan L, Wan H, Shi Y, Shi G, Feng Y, et al. Lack of association between the TGF-b(1) gene and development of COPD in Asians: a case-control study and meta-analysis. Lung 2011; 189: 213-23.
- Kaminsky DA. Spirometry and related tests. In: Ruppel GL (ed). Manual of Pulmonary Function Testing. 9th ed. Chapter 2, Mosby Elsevier, 2009: 36-89.
- Global Initiative for chronic obstructive pulmonary disease updated, chapter 1 (definition), 2007: 2-6.
- Pellegrino R, Viegi G, Brusasco V, Crapo RO, Burgos F, Casaburi R, et al. Interpretative strategies for lung function tests. Eur Respir J 2005; 26: 948-68.
- Miller MR, Hankinson J, Brusasco V, Burgos F, Casaburi R, Coates A, et al; ATS/ERS Task Force. Standardisation of spirometry. Eur Respir J 2005; 26: 319-38.
- Fishman AP, Elias JA, Fishman JA, Grippi MA, Senior RM, Pack AI, et al. Physiological principles of normal lung function. In: Fishman AP (ed). Fishman's Pulmonary Diseases and Disorders. 4th ed. Vol. I. China: Mc Graw Hill Companies, 2008: 147-60.
- DuBois AB. Significance of measurement of airway resistance. In: International Symposium on Body Plethysmography, Nijmegen, the Netherlands, 1968. Vol. 4. Progr Res Basel, Switzerland: Karger, Res 1969: 109-15.
- Matthys H, Orth U. Comparative measurements of airway resistance. Respiration 1975; 32: 121-34.
- Murray CJL, Lopez AD. Global health statistics: a compendium of incidence, prevalence and mortality estimates for over 200 conditions. Geneva, Switzerland: World Health Organization, 1996.
- Kocaba?, A, Hanc?o?lu A, T?rky?lmaz S, ?nalan T, Umut S, ?ak?r B, et al. Prevelance of COPD in Adana, Turkey (BOLD-Turkey Study). Proceedings of the American Thoracic Society 2006; 3: A543.
- Shapiro SD, Snider GL, Rennard SI. Chronic bronchitis and emphysema. In: Mason RJ, Murray JF, Broaddus VC, Nadel JA (eds). Murray and Nadel's Textbook of Respiratory Medicine. 4th ed. Section J-Chapter 36. Vol 1. USA: Elsevier Saunders, 2005: 1115-68.
- Calverley PM, Leggett RJ, McElderry L, Flenley DC. Cigarette smoking and secondary polycythemia in hypoxic cor pulmonale. Am Rev Respir Dis 1982; 125: 507-10.
- Wedzicha JA, Cotes PM, Empey DW, Newland AC, Royston JP, Tam RC. Serum immunoreactive erythropoietin in hypoxic lung disease with and without polycythaemia. Clin Sci 1985; 69: 413-22.
- Goldsmith JR, Landaw SA. Carbon monoxide and human health. Science 1968; 162: 1352-9.
- Tanabe N, Ohnishi K, Fukui H, Ohno R. Effect of smoking on the serum concentration of erythropoietin and granulocyte-colony stimulating factor. Intern Med 1997; 36: 680-4.
- Quanjer PH, Tammeling GJ, Cotes JE, Pedersen OF, Peslin R, Yernault JC. Lung volumes and forced ventilatory flows. Eur Respir J Suppl 1993; 16: 5-40.
- Saryal SB, Karab?y?ko?lu G, Akkoca ?, ?elik G. Kronik havayollar? obstr?ksiyonunda ventilatuvar parametrelerle hava yollar? rezistans? ve iletimi aras?ndaki ili?ki. Solunum Hastal?klar? 1995; 6: 371-82.
- Wagner EM, Bleecker ER, Permutt S, Liu MC. Peripheral airways resistance in smokers. Am Rev Respir Dis 1992; 146: 92-5.
- Pride NB. Airflow resistance. In: Hughes JM, Pride NB (eds). Lung Function Tests: Physiological Principles and Clinical Applications. 1st ed. London: Harcourt Brace and Company Limited, 1999: 27-43.
- Doershuk CF, Fisher BJ, Matthews LW. Specific airway resistance from the perinatal period into adulthood. Alterations in childhood pulmonary disease. Am Rev Respir Dis 1974; 109: 452-7.
- Dab I, Alexander F. Lung function measured with a whole body plethysmograph: standard values for children and young adults. Acta Paediatr Belg 1979; 32: 259-67.
- Bisgaard H, Nielsen KG. Plethysmographic measurements of specific airway resistance in young children. Chest 2005; 128: 355-62.
- Klug B, Bisgaard H. Specific airway resistance, interrupter resistance, and respiratory impedance in healthy children aged 2-7 years. Pediatr Pulmonol 1998; 25: 322-31.
- Stoller JK, Aboussouan LS. Alpha1-antitrypsin deficiency. Lancet 2005; 365: 2225-36.
- Sakao S, Tatsumi K, Igari H, Shino Y, Shirasava H, Kuriyama T. Association of tumor necrosis factor-alpha gene promoter polymorphism with the presence of chronic obstructive pulmonary disease. Am J Respir Crit Care Med 2001; 163: 420-2.
- Sakao S, Tatsumi K, Igari I, Watanabe R. Association of tumor necrosis factor-alpha gene promoter polymorphism with low attenuation areas on high-resolution CT in patients with COPD. Chest 2002; 122: 416-20.
- Chierakul N, Wongwisutikul P, Vejbaesya S, Chotvilaiwan K. Tumor necrosis factor-alpha gene promoter polymorphism is not associated with smoking-related COPD in Thailand. Respirology 2005; 10: 36-9.
- Ishii T, Matsuse T, Teramoto S, Matsui H, Miyao M, Hosoi T, et al. Neither IL-1beta, IL-1 receptor antagonist, nor TNF-αlpha polymorphisms are associated with susceptibility to COPD. Respir Med 2000; 94: 847-51.
- Patuzzo C, Gile LS, Zorzetto M, Trabetti E, Malerba G, Pignatti PF, et al. Tumor necrosis factor gene complex in COPD and disseminated bronchiectasis. Chest 2000; 117: 1353-8.
- Ferrarotti I, Zorzetto M, Beccaria M, Gile LS, Porta R, Ambrosino N, et al. Tumour necrosis factor family genes in a phenotype of COPD associated with emphsema. Eur Resp J 2003; 21: 444-9.
- K???kaycan M, Van Krugten M, Pennings HJ, Huizinga T, Buurman WA, Dentener MA, et al. Tumor necrosis factor-alpha +489G/A gene polymorphism is associated with chronic obstructive pulmonary disease. Respir Res 2002; 3: 29.
- Wu L, Chau J, Young RP, Pokorny V, Mills GD, Hopkins R, et al. Transforming growth factor-beta1 genotype and susceptibility to chronic obstructive pulmonary disease. Thorax 2004; 59: 126-9.
- Celedon JC, Lange C, Raby BA, Litonjua AA, Palmer LJ, DeMeo DL, et al. The transforming growth factor-beta 1 (TGF-β1 gene is associated with chronic obstructive pulmonary disease (COPD). Hum Mol Genet 2004; 13: 1649-56.
- Su ZG, Wen FQ, Feng YL, Xiao M, Wu XL. Transforming growth factor-beta1 gene polymorphisms associated with chronic obstructive pulmonary disease in Chinese population. Acta Pharmacol Sin 2005; 26: 714-20.
- Ogawa E, Ruan J, Connett JE, Anthonisen NR, Pare PD, Sandford AJ. Transforming growth factor-beta1 polymorphisms, airway responsiveness and lung function decline in smokers. Respir Med 2007; 101: 938-43.
Yaz??ma Adresi (Address for Correspondence):
Dr. Sevin? SARIN? ULA?LI,
Afyon Kocatepe ?niversitesi T?p Fak?ltesi,
G???s Hastal?klar? Anabilim Dal?,
AFYONKARAH?SAR - TURKEY
e-mail: sevincsarinc@gmail.com